Psoríase
A psoríase[1][2] é unha doenza autoinmune que se caracteriza por manchas anormais na pel.[3] Estas manchas na pel son polo xeral vermellas, resecas, con proído e descamación.[4] Nas persoas coa pel escura as manchas poden adquirir a cor púrpura.[5] A psoríase varía en función do seu tamaño e poden ser manchas localizadas ou estendidas por todo o corpo.[4] As lesións na pel poden desencadear cambios psoriáticos na rexión afectada, o cal é coñecido como fenómeno de Koebner.[6]
| Psoríase | |
|---|---|
| Clasificación e recursos externos | |
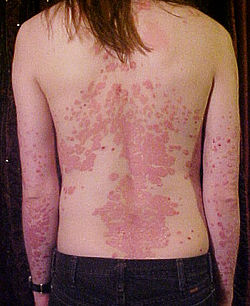 Un home novo coas costas e brazos afectados polas placas da psoríase vulgar. | |
| ICD-10 | L40 |
| ICD-9 | 696 |
| OMIM | 177900 138900 |
| DiseasesDB | 10895 |
| MedlinePlus | 000434 |
| eMedicine | derm/365 |
Se cre que pode requirir tratamento, por favor, consúltello ao médico. | |
Existen cinco tipos principais de psoríase: vulgar, guttata, inversa, pustulosa e eritrodérmica.[3] A psoríase de placas, tamén coñecida como psoriasis vulgaris, supón arredor do 90% dos casos.[7] Preséntase polo xeral como manchas vermellas con escamas brancas na parte superior.[7] As áreas do corpo que adoitan ser as máis afectadas son a parte posterior dos antebrazos, canelas, área do embigo e o coiro cabeludo.[7] A psoríase guttata presenta lesións en forma de pinga.[3] A psoríase pustulosa presenta pequenas bóchegas non infecciosas cheas de brume.[8] A psoríase inversa forma parches vermellos nos pregos da pel.[3] A psoríase eritrodérmica ocorre cando a erupción se estende moito e pode desenvolverse a partir de calquera dos outros tipos.[7] As unllas das mans e dos pés vense afectadas na maioría das persoas con psoríase nalgún momento da súa vida.[7] Isto pode provocar manchas ou cambio de cor nas unllas.[7]
Considérase que a psoríase é unha doenza xenética que é desencadeada por factores ambientais.[4] En estudos de xemelgos, os xemelgos idénticos teñen tres veces máis de posibilidades de verse afectados en comparanza cos xemelgos non idénticos. Isto suxire que os factores xenéticos predispoñen a psoríase.[7] Os síntomas adoitan empeorar durante o inverno e con certas menciñas, como beta bloqueadores ou antiinflamatorios non-esteroides.[7] As infeccións e o estrés psicolóxico poden xogar un papel determinante na doenza.[4][3] A psoríase non é unha doenza contaxiosa.[7] O seu mecanismo subxacente implica o sistema inmunitario en reacción ás células da pel.[7] A diagnose baséase polo xeral en sinais e síntomas.[7]
Non existe cura para a psoríase mais diversos tratamentos poden axudar a controlar os síntomas.[7] Estes tratamentos inclúen cremas de esteroides, cremas de vitamina D3, luz ultravioleta e menciñas inmunosupresoras, como o metotrexato.[3] Arredor do 75% dos casos poden ser controlados só con cremas.[7] A doenza afecta entre o 2 ó 4% da poboación.[9] Os homes e as mulleres vense afecatadas por ela coa mesma frecuencia.[3] A doenza pode comezar a calquera idade, mais polo xeral comeza na idade adulta.[10] A psoríase está asociada cun incremento no risco de padecer artrite psoriásica, linfoma, unha doenza cardiovascular, o mal de Crohn e depresión.[7] A artrite psoriásica afecta ó 30% dos individuos con psoríase.[8]
Sinais e síntomas
editarPsoríase vulgar
editarA psoríase vulgar (tamén coñecida como psoríase crónica estacionaria ou psoríase de placas) é a forma máis común e afecta ó 85%–90% das persoas co psoríase.[11] A psoríase en placas aparece tipicamente como zonas de pel inflamada cubertas con escamas de cor branca prateada. Estas áreas son máis comúns en cóbados, xeonllos, coiro cabeludo e lombo.[11][12] A eritrodermia psoriásica implica inflamación xeneralizada e exfoliación da pel sobre a maior parte da superficie do corpo. Pode estar acompañada de pel seca, proído, inchazón e dor. A miúdo é o resultado dunha exacerbación da psoríase vulgar inestable, en particular despois da retirada abrupta de glicocorticoides sistémicos.[13] Esta forma de psoríase pode ser fatal, xa que a inflamación extrema e a exfoliación interrompen a capacidade do corpo para regular a temperatura e realizar as funcións de barreira.[14]
-
Placas de psoríase.
-
Brazo cuberto de placas de psoríase.
-
Psoríase nas palmas das mans.
Outras formas
editarAs outras formas de psoríase abranguen arredor do 10% dos casos. Inclúen as formas pustulosa, inversa, de cueiro, guttata, oral e seborreica.[15]
Psoríase pustulosa
editarA psoríase pustulosa aparece como protuberancias elevadas cheas de brume non infeccioso (pústulas).[16] A pel baixo e arredor das pústulas é vermella e mol.[17]
Psoríase inversa
editarA psoríase inversa (tamén coñecida como psoríase flexural) aparece como manchas na pel, lisas e inflamadas. As manchas afectan de forma frecuente os pregamentos da pel, particularmente arredor dos xenitais (entre a coxa e a ingua), os sobrazos, nos pregamentos da pel dun abdome con sobrepeso (coñecido como panniculus), entre as nádegas e na fenda interglútea, e baixo os seos no pregamento inframamario. Crese que a calor, o trauma e infección desempeñan un papel no desenvolvemento desta forma atípica de psoríase.[18]
Psoríase de cueiro
editarA psoríase de cueiro é un subtipo de psoríase común en nenos que se caracteriza por pápulas vermellas con escamas prateadas na área do cueiro que poden estenderse ó torso ou extremidades.[19] A psoríase de cueiro é diagnosticada ás veces de forma errada como dermatite por cueiro.[20]
Psoríase guttata
editarA psoríase guttata caracterízase por numerosas e pequenas lesións escamosas, vermellas ou rosadas con forma de pinga (pápulas). Estas numerosas manchas de psoríase aparecen en grandes áreas do corpo, principalmente no torso, mais tamén nas extremidades e o coiro cabeludo. A psoríase guttata é desencadeada a miúdo por unha infección de Streptococcus pyogenes, normalmente unha farinxite estreptocócica.[18]
Boca
editarA psoríase na boca é moi rara,[21] ó contrario que o lique plano, outra desorde papuloescamosa común que adoita afectar a pel e a boca. Cando a psoríase afecta a mucosa bucal (o revestimento da boca), pode ser asintomática,[21] mais pode aparecer como placas brancas ou agrisadas-amareladas.[21] A lingua fisurada é o trazo máis común nas persoas con psoríase oral e informouse que ocorre no 6,5 ó 20% das persoas con psoríase que afecta a pel. A aparencia microscópica da mucosa oral afectada por lingua xeográfica é moi semellante á aparencia da psoríase.[22] Porén, os estudos modernos non conseguiron demostrar ningunha relación entre as dúas condicións.[23]
Psoríase de tipo seborreica
editarA psoríase de tipo seborreica é unha forma común de psoríase cos aspectos clínicos comúns desta doenza e os da dermatite seborreica, o cal fai que sexa difícil distinguila desta última. Esta forma de psoríase maniféstase como placas vermellas con escamas agrisadas nas áreas de maior produción de sebo como o coiro cabeludo, a fronte, os sucos nasolabiais, a pel arredor da boca, a pel do peito por enriba do esterno, e as áreas intertrixinosas.[19]
Artrite psoriásica
editarA artrite psoriásica é unha forma de artrite inflamatoria crónica que ten unha presenza altamente variable e que adoita ocorrer en asociación coa psoríase na pel e unllas.[24][25] Polo xeral implica a inflamación dolorosa das articulacións e do tecido conxuntivo e pode aparecer en calquera articulación, aínda que as máis comúns son as dos dedos e as das dedas. Pode provocar a inchazón en forma de salchicha dos dedos e das dedas coñecida como dactilite.[24] A artrite psoriásica tamén pode afectar os cadrís, os xeonllos, a columna (espondilite), e a articulación sacro-ilíaca (sacroileíte).[26] Arredor do 30% das persoas con psoríase desenvolve artrite psoriásica.[11] As manifestacións cutáneas da psoríase adoitan ocorrer antes das manifestacións artríticas en arredor do 75% dos casos.[25]
Cambios nas unllas
editarA psoríase pode afectar as unllas e produce unha serie de cambios na aparencia das unllas dos dedos e das dedas. A psoríase nas unllas prodúcese no 40–45% das persoas afectadas por psoríase na pel, e ten unha incidencia de por vida no 80–90% de tódolos casos de artrite psoriásica.[27] Estes cambios inclúen manchas nas unllas (as depresións na unlla do tamaño dun alfinete aparece no 70% dos casos), leuconiquia, pequenas áreas de sangrado de capilares baixo as unllas, coloración avermellada das unllas coñecida como pinga de aceite ou mancha de salmón, secura, engrosamento da pel debaixo da unlla (hiperqueratose subungueal), afrouxamento ou separación das unllas (onicolise) e desprendemento da unlla.[27]
Sinais médicos
editarAdemais da aparición e distribución da erupción, os sinais médicos específicos poden ser usados polos médicos profesionais para axudar na diagnose. Estes poden incluír o sinal de Auspitz (sangrado puntual cando se retira a escama), o fenómeno de Koebner (lesións psoriásicas da pel inducidas por un traumatismo),[19] e proído e dor localizados en pápulas e placas.[18][19]
Causas
editarA causa da psoríase non está completamente entendida mais existen diversas teorías.
Xenética
editarArredor dun terzo das persoas con psoríase teñen antecedentes familiares da doenza, e os investigadores identificaron os loci xenéticos asociados coa condición. Os estudos en xemelgos idénticos suxiren un 70% de probabilidades de que un xemelgo desenvolva psoríase se o outro ten o trastorno. O risco é de arredor do 20% en xemelgos non idénticos. Estes descubrimentos suxiren susceptibilidade xenética e unha resposta ambiental no desenvolvemento da psoríase.[28]
A psoríase ten un forte compoñente hereditario, e moitos xenes están asociados a ela, mais non está claro de que xeito os xenes traballan xuntos. A maioría dos xenes identificados están relacionados co sistema inmunolóxico, particularmente o complexo maior de histocompatibilidade (CMH) e o linfocito T. Os estudos xenéticos son valiosos debido á súa capacidade para identificar mecanismos moleculares e vías para estudos adicionais e posibles obxectivos farmacolóxicos.[29]
A análise clásica de ligamento do xenoma identificou nove loci en diferentes cromosomas asociados coa psoríase. Denomínanse susceptibilidade á psoríase do 1 ó 9 (PSORS1 a PSORS9). Nestes loci existen xenes en vías que conducen á inflamación. Certas variacións (mutacións) destes xenes aparecen comunmente na psoríase.[29] As exploracións de asociación de todo o xenoma identificaron outros xenes que se alteran por variantes características na psoríase. Algúns destes xenes expresan proteínas de sinal inflamatorio que afectan as células do sistema inmunolóxico, as cales tamén están involucradas na psoríase. Algúns destes xenes tamén están involucrados noutras doenzas autoinmunes.[29]
O principal determinante é PSORS1, o que probablemente representa o 35%-50% da herdabilidade da psoríase.[30] Controla os xenes que afectan o sistema inmunolóxico ou codifica proteínas da pel que son abondosas na psoríase. PSORS1 atópase no cromosoma 6 no complexo maior de histocompatibilidade (CMH), que controla importantes funcións inmunes. Tres xenes do locus PSORS1 teñen unha forte asociación coa psoríase vulgar: HLA-C variante HLA-Cw6,[31] que codifica unha proteína MHC de clase I; CCHCR1, variante WWC, que codifica unha proteína de hélice superenrolada que está sobreexpresada na epiderme psoriásica; e CDSN, variante alelo 5, que codifica a corneodesmosina, unha proteína que se expresa na capa granular e cornificada da epiderme e que regula o abrocho da psoríase.[29]
Dous xenes principais do sistema inmunitario baixo investigación son a subunidade beta de interleucina 12 (IL12B) no cromosoma 5q, que expresa a interleucina-12B; e o IL23R no cromosoma 1p, que expresa o receptor de interleucina-23 e está involucrado na diferenciación de células T. O receptor de interleucina-23 e IL12B foron fortemente vinculados coa psoríase.[31] As células T están involucradas no proceso inflamatorio que conduce á psoríase.[29] Estes xenes atópanse entre os que regulan á alza o factor de necrose tumoral α e o factor nuclear κB, dous xenes involucrados na inflamación.[29] Recentemente, identificouse o primeiro xene directamente ligado coa psoríase. Unha mutación rara no xene que codifica a proteína CARD14 máis un causante ambiental foron suficientes para causar a psoríase en placa (a forma máis común de psoríase).[32][33]
Estilo de vida
editarEntre as condicións de vida que se teñen rexistrados como agravantes da doenza están as infeccións crónicas, o estrés e os cambios de estación e clima.[31] Outras que poden empeorar a condición son a auga quente, as lesións produto do rañado, a secura da pel, o consumo excesivo de alcohol, fumar e a obesidade.[31][34][35]
VIH
editarA taxa de psoríase en individuos VIH positivos é comparable á de individuos VIH negativos, porén, a psoríase tende a ser máis grave en persoas infectadas co VIH.[36] Os individuos VIH positivos teñen unha taxa moito maior de artrite psoriásica que os que non teñen a infección.[36] A resposta inmune naqueles infectados con VIH caracterízase polo xeral por sinais celulares no subconxunto Th2 de células T auxiliares CD4+,[37] mentres que a resposta inmune na psoríase vulgar caracterízase por un padrón de sinais celulares típicas do subconxunto Th1 de células T auxiliares CD4+ e de células T Th17 auxiliares.[38][39] Propúxose a hipótese de que a diminución da presenza de células T CD4+ provoca unha sobreactivación das células T CD8+, responsables da exacerbación da psoríase en persoas VIH positivas. A psoríase nas persoas con VIH/SIDA a miúdo é grave e pode ser intratable coa terapia convencional.[40] Nas persoas con psoríase ben controlada a longo prazo, a infección por VIH pode desencadear un abrocho grave de psoríase e ou artrite psoriásica.
Microbios
editarA psoríase foi descrita como unha doenza que xorde despois da farinxite estreptocócica, e pode empeorar pola colonización na pel ou do intestino de Staphylococcus aureus, Malassezia e Candida albicans.[41]
Medicacións
editarA psoríase inducida por fármacos pode producirse por mor de beta bloqueadores,[8] litio,[8] medicación contra a malaria,[8] antiinflamatorios non-esteroides,[8] terbinafina, bloqueadores das canles de calcio, captopril, gliburida, factor estimulante de colonias de granulocitos,[8] interleucinas, interferón,[8] hipolipemiantes,[15]:197 e paradoxalmente inhibidores de TNF como infliximab ou adalimumab.[42] A retirada de corticosteroides (crema tópica de esteroides) pode agravar a psoríase por mor do efecto rebote.[43]
Mecanismo
editarA psoríase caracterízase por un crecemento anormalmente excesivo e rápido da capa epidérmica da pel.[44] A produción anormal de células da pel (especialmente durante a cicatrización) e unha sobreabundancia de células da pel producen como resultado a secuencia de eventos patolóxicos na psoríase.[17] Con psoríase, as células da pel anóvanse cada 3 ou 5 días, no canto dos 28 ou 30 días da pel sa.[45] Crese que estes cambios proveñen da maduración prematura de queratinocitos inducida por un cadoiro inflamatorio na derme, que implica células dendríticas, macrófagos e linfocitos T (tres subtipos de leucocitos).[11][36] Estas células inmunes móvense dende a derme até a epiderme e segregan sinais químicos inflamatorios (citoquinas) como interleucina-36γ, factor de necrose tumoral alfa, interleucina 1β, interleucina 6 e interleucina 22.[29][46] Cóidase que estes sinais inflamatorios estimulan a proliferación de queratinocitos.[29] Unha hipótese propón que a psoríase está relacionada cun defecto nos linfocitos T reguladores, e na citoquina regulatoria interleucina 10.[29]
As mutacións xenéticas das proteínas involucradas na capacidade da pel para funcionar como unha barreira foron identificadas como marcadores de susceptibilidade para o desenvolvemento da psoríase.[47][48]
O ADN liberado das células que morren actúa como un estímulo inflamatorio na psoríase[49] e estimula os receptores en certas células dendríticas, que á súa vez producen a citoquina interferón-α.[49] En resposta ás mensaxes químicas das células dendríticas e das células T, os queratinocitos tamén segregan citoquinas como interleucina 1, interleucina 6 e factor de necrose tumoral alfa, que sinalizan as células inflamatorias posteriores para que cheguen e estimulen unha inflamación adicional.[29]
As células dendríticas unen o sistema inmunitario innato e o sistema inmunitario adaptativo. Aumentan nas lesións psoriásicas[44] e inducen a proliferación de células T e células T auxiliares tipo 1 (Th1). A inmunoterapia dirixida, así como o psoraleno e a terapia con radiación ultravioleta A poden reducir o número de células dendríticas e favorecer a segregación dun padrón de citoquinas de céulas Th2 sobre un perfil de citoquinas de células Th1/Th17.[29][38] As células T psoriásicas móvense dende a derme até a epiderme e segregan interferón-γ e interleucina 17.[50] A interleucina 23 é coñecida por inducir a produción de interleucina 17 e interleucina 22.[44][50] A interleucina 22 traballa en combinación coa interleucina 17 para inducir os queratinocitos a segregar citoquinas atraentes de neutrófilos.[50]
Diagnose
editarA diagnose da psoríase baséase polo xeral na aparencia da pel. As características máis comúns da pel con psoríase son as escamas, as placas eritematosas, as pápulas ou parches da pel que poden ser dolorosos e proer.[18] Normalmente non se requiren análises de sangue ou procedementos especiais para facer a diagnose.[17][51]
A diagnose diferencial da psoríase inclúe condicións dermatolóxicas semellantes en aparencia tales como eccema discoido, dermatite seborreica, pitiríase rosada (pode ser confundida coa psoríase guttata), tinea unguium (pode ser confundida coa psoríase nas unllas) ou linfoma cutáneo de células T (o 50% dos individuos con este cancro son mal diagnosticados con psoríase).[43] As manifestacións dermatolóxicas de doenzas sistémicas como a erupción de sífilis secundaria poden ser confundidas coa psoríase.[43]
Se a diagnose clínica non é clara, pode realizarse unha biopsia da pel ou un raspado para desbotar outros trastornos e confirmar a diagnose. A pel dunha biopsia amosará proxeccións epidérmicas con forma de porra que interdixitan coa derme no microscopio. O engrosamento epidérmico é outra característica histolóxica que se pode atopar nas lesións psoriásicas.[17][52] A capa do estrato granuloso da epiderme a miúdo falta ou redúcese significativamente nas lesións psoriásicas; as células da capa máis superficial da pel tamén son anormais xa que nunca maduran completamente. A diferenza dos seus homólogos maduros, estas células superficiais manteñen o seu núcleo.[17] Os infiltrados inflamatorios pódense visualizar tipicamente en microscopía cando se examina o tecido da pel ou o tecido articular afectado pola psoríase. O tecido cutáneo epidérmico afectado pola inflamación psoriásica a miúdo ten moitas células T CD8+, mentres que o predominio das células T CD4+ constitúe os infiltrados inflamatorios da capa dérmica da pel e das articulacións.[17]
Clasificación
editarMorfolóxica
editar| Tipo de psoríase | Código ICD-10 |
|---|---|
| Psoríase vulgar | L40.0 |
| Psoríase pustulosa | L40.1 |
| Acrodermatite continua | L40.2 |
| Pustulosis palmaris et plantaris | L40.3 |
| Psoríase guttata | L40.4 |
| Artrite psoriásica | L40.50 |
| Espondilite psoriásica | L40.53 |
| Psoríase inversa | L40.8 |
A psoríase clasifícase como un trastorno papuloescamoso e subdivídese normalmente en diferentes categorías segundo as características histolóxicas.[4][8] Entre as súas variantes están a psoríase de placas, pustulosa, guttata e flexural. Cada variante ten o seu propio código CIE-10.[53] A psoríase tamén pode ser clasificada nos tipos pustulosa e non pustulosa.[54]
Patóxena
editarOutro esquema de clasificación considera factores xenéticos e demográficos. O tipo 1 ten un historial familiar positivo, comeza antes dos 40 anos e está asociado co antíxeno leucocitario humano, HLA-Cw6. Pola contra, o tipo 2 non ten historial familiar, preséntase despois dos 40 anos e non está asociado co HLA-Cw6.[55] O tipo 1 representa arredor do 75% das persoas con psoríase.[56]
A clasificación da psoríase como unha doenza autoinmune provocou un debate considerable. Os investigadores propuxeron diferentes descricións da psoríase e a artrite psoriásica; algúns autores clasificáronas como doenzas autoinmunes[17][31][57] mentres que outros autores clasificáronas como diferentes das doenzas autoinmunes e referíronse a elas como doenzas inflamatorias mediadas polo sistema inmunolóxico.[29][58][59]
Gravidade
editarNon hai consenso sobre como clasificar a gravidade da psoríase. A psoríase leve definiuse como unha porcentaxe da área de superficie corporal (BSA)≤10, un índice de gravidade da zona de psoríase (PASI) de ≤10 e o índice de calidade de vida da dermatoloxía (DLQI) de ≤10.[60] A psoríase moderada a grave foi definida polo mesmo grupo como BSA >10 ou PASI >10 e DLQI de >10.[60]
O DLQI é unha ferramenta de dez preguntas empregada para medir o impacto de varias doenzas dermatolóxicas na vida diaria. O DLQI puntúa dende o 0 (deterioración mínima) até o 30 (deterioración máxima) e calcúlase con cada resposta asignada de 0 a 3 puntos, coas puntuacións máis altas indicando unha maior deterioración social ou ocupacional.[61]
O índice de gravidade da área de psoríase (PASI) é a ferramenta de medición máis empregada para a psoríase. PASI avalía a gravidade das lesións e da área afectada e combina estes dous factores nunha puntuación única de 0 (sen enfermidade) a 72 (enfermidade máxima).[62] Porén, o PASI pode ser difícil de máis para empregalo fóra dun contexto de investigación, o cal levou a tentar simplificar o índice para uso clínico.[63]
Tratamento
editarMalia que non hai cura para a psoríase,[43] existen moitas opcións de tratamento. Polo xeral, os axentes tópicos úsanse para doenzas lenes, a fototerapia para doenzas moderadas e os axentes sistémicos para doenzas graves.[64]
Axentes tópicos
editarAs compostos tópicos de corticosteroides son os axentes máis eficaces cando se usan de xeito continuo durante 8 semanas; descubriuse que os retinoides e o alcatrán de hulla teñen un beneficio limitado e poden non ser mellores que o placebo.[65] Observouse un maior beneficio cos corticosteroides moi potentes en comparanza cos corticosteroides potentes.
Análogos da vitamina D como o paricalcitol son superiores ó placebo. A terapia de combinación con vitamina D e un corticosteroide foi superior a calquera tratamento só e descubriuse que a vitamina D é superior ó alcatrán de hulla na psoríase de placas crónica.[66]
Para a psoríase no coiro cabeludo, unha recensión de 2016 describiu que a terapia dual (análogos de vitamina D e corticosteroides tópicos) ou a monoterapia con corticosteroides son máis eficaces e seguras que os análogos tópicos da vitamina D sós.[67] Debido ós seus perfís de seguridade semellantes e ó mínimo beneficio da terapia dual sobre a monoterapia, a monoterapia con corticosteroides parece ser un tratamento aceptable para o manexo a curto prazo.[67]
Cremas hidrantes e emolientes como o aceite mineral, vaselina, calcipotriol e decubal (un emoliente de aceite en auga) aumentan a depuración das placas psoriásicas. Demostrouse que algúns emolientes son aínda máis efectivos para eliminar as placas psoriásicas cando se combinan con fototerapia.[68] Porén, certos emolientes non teñen impacto no aclarado da placa de psoríase ou mesmo poden diminuír o efecto da fototerapia, como o emoliente do ácido salicílico, que ten unha estrutura semellante ó ácido 4-aminobenzoico (PABA) e é moi común nas cremas solares, e é coñecido por interferir na fototerapia en psoríase. O aceite de coco, cando é empregado como emoliente na psoríase, diminúe o aclarado da placa con fototerapia.[68] As cremas e unturas medicinais aplicadas directamente enriba das placas psoriásicas poden axudar a reducir a inflamación, eliminar a escama acumulada, reducir o recambio da pel e despexar a pel afectada das placas. Os ungüentos que conteñen alcatrán de hulla, ditranol, corticosteroides (como desoximetasona), fluocinonide, análogos de vitamina D3 (como o calcipotriol) e retinoides son usados de forma rutineira. O uso da unidade da punta do dedo pode ser unha útil guía para saber canta crema tópica empregar.[34][69]
Os análogos de vitamina D poden ser útiles con esteroides, mais por si sós teñen unha alta taxa de efectos secundarios.[70] En combinación, poden permitir o uso de menos esteroides.[71]
Outra terapia tópica para o tratamento da psoríase é unha forma de balneoterapia, que implica baños diarios no Mar Morto. Isto faise polo xeral durante catro semanas co beneficio atribuído tamén á exposición ó sol, e especificamente á luz ultravioleta. Isto é altamente rendible e propagouse como unha forma efectiva de tratar a psoríase sen medicamentos.[72] Observáronse con frecuencia diminucións das puntuacións PASI superiores ó 75% e a remisión durante varios meses.[72] Os efectos secundarios poden ser lenes, como proído foliculite, queimadura solar, poikiloderma e un risco teórico de cancro de pel non melanoma.[72] Porén, estudos máis recentes determinaron que non semella incrementar o risco de melanoma a longo prazo.[73] Os datos non son concluíntes respecto do cancro de pel non melanoma, pero apoia a idea de que a terapia está asociada cun maior risco de formas benignas de dano cutáneo inducido polo sol, como elastose actínica ou lentixa solar.[73] A balneoterapia no Mar Morto tamén é efectiva para a artrite psoriásica.[73]
Fototerapia ultravioleta
editarA fototerapia na forma de luz solar foi empregada dende hai tempo para tratar a psoríase.[64] A luz ultravioleta con lonxitude de onda de 311 a 313 nanómetros é a máis efectiva, e desenvolvéronse lámpadas especiais para esta aplicación.[64] O tempo de exposición debe ser controlado para evitar danos e queimaduras na pel. As lámpadas ultravioleta deben contar cun temporizador que apague a lámpada cando se cumpra o tempo óptimo. A cantidade de luz empregada é determinada polo tipo de pel da persoa.[64] O aumento do índice de cancro no tratamento parece ser pequeno.[64] A Fototerapia con banda angosta de luz UVB (NB-UVB) demostrou ter unha eficacia semellante á fototerapia de psoraleno e ultravioleta A (PUVA).[74] Nunha metaanálise de 2013 non se atopou diferenza entre os métodos NB-UVB e PUVA no tratamento da psoríase, mais a NB-UVB é polo xeral máis conveniente.[75]
Un dos principais problemas coa fototerapia clínica é a dificultade que moitos pacientes teñen para acceder a unha instalación. As instalacións de bronceado en interiores son case omnipresentes no presente e poderían considerarse como un medio para que os pacientes se expoñan a raios UV cando o dermatólogo non dispoña de fototerapia. Moitas persoas xa utilizan o bronceado en interiores como tratamento para a psoríase; unha instalación interior informou que o 50% dos seus clientes estaban usando o centro para o tratamento da psoríase mentres que outro centro informou que o 36% estaba facendo o mesmo. Porén, existe unha preocupación polo uso de bronceado comercial xa que as cámaras que emiten principalmente UVA poderían non tratar eficazmente a psoríase. Un estudo demostrou que a psoríase en placa responde a doses eritemoxénicas de UVA ou UVB, xa que a exposición a calquera delas pode causar a disipación das placas psoriásicas. Requírese de máis enerxía para chegar até a dose eritemoxénica con UVA.[76]
Tódalas terapias con luz UV teñen riscos; as cámaras de bronceado non son unha excepción, particularmente pola relación entre a luz UV e o incremento no risco de cancro de pel. Hai maiores riscos de melanoma, carcinomas de células escamosas e de células basais; os pacientes máis novos con psoríase, especialmente os menores de 35 anos, teñen un maior risco de melanoma polo tratamento con luz UV. A Organización Mundial da Saúde clasificou as cámaras de bronceado como canceríxenas. Unha recensión de estudos recomenda que a xente que é susceptible de cancro de pel teña moita conta cando empregue a terapia de luz UV como tratamento.[76]
Un mecanismo importante de NBUVB é a indución de danos no ADN en forma de dímeros de pirimidina. Este tipo de fototerapia é útil no tratamento da psoríase porque a formación destes dímeros interfire co ciclo celular e deteno. A interrupción do ciclo celular inducida por NBUVB oponse á división rápida característica das células da piel observada na psoríase.[74] A actividade de moitos tipos de células inmunitarias que se encontran na pel tamén se suprime de maneira efectiva cos tratamentos de fototerapia NBUVB. O efecto secundario a curto prazo máis común desta forma de fototerapia é o avermellado da pel; efectos secundarios menos comúns da fototerapia NBUVB son o proído e as bóchegas na pel tratada, irritación dos ollos en forma de conxuntivite ou inflamación da córnea, ou herpes por mor da activación do virus do herpes simplex na pel arredor dos beizos. É común a protección ocular durante os tratamentos de fototerapia.[74]
O psoraleno e a fototerapia ultravioleta A (PUVA) combina a administración oral ou tópica de psoraleno con exposición á luz ultravioleta A (UVA). O mecanismo de acción da PUVA é descoñecido, mais probablemente involucre a activación do psoraleno pola luz UVA, que inhibe a produción anormalmente rápida das células na pel psoriásica. Existen múltiples mecanismos de acción asociados coa PUVA, incluídos os efectos sobre o sistema inmunolóxico da pel. A PUVA está asociada con náuseas, cefalalxia, cansazo, proído e comechón. O tratamento a longo prazo está asociado co carcinoma espinocelular (mais non con melanoma).[35][77] A terapia de combinación para casos de psoríase moderada e grave usando PUVA máis acitretina tivo beneficios, pero o uso de acitretina está asociado con doenzas conxénitas e danos no fígado.[78]
Axentes sistémicos
editarA psoríase resistente a tratamentos tópicos e fototerapia pode ser tratada con terapias sistémicas, incluíndo fármacos orais ou inxeccións.[79] As persoas sometidas a tratamentos sistémicos deben facer análises de sangue e tests das funcións hepáticas para comprobar a toxicidade dos medicamentos.[79] O embarazo debe ser evitado durante a maioría destes tratamentos. A maioría das persoas experimentan unha recorrencia da psoríase despois de interromper o tratamento sistémico.
Os tratamentos sistémicos non biolóxicos empregados frecuentemente para a psoríase inclúen metotrexato, ciclosporina, hidroxicarbamida, ácidos fumáricos como o dimetilfumarato, e retinoides.[80] O metotrexato e a ciclosporina son fármacos que suprimen o sistema inmune; os retinoides son formas sintéticas de vitamina A. Estes axentes tamén se consideran tratamentos de primeira liña para a eritrodermia psoriásica.[13] Os corticosteroides orais non deben utilizarse, xa que poden provocar unha exacerbación da psoríase ó suspendela.[81]
Os axentes biolóxicos son proteínas fabricadas que interrompen o proceso inmunolóxico involucrado na psoríase. A diferenza das terapias con medicamentos inmunosupresores xeneralizados, como o metotrexato, os produtos biolóxicos enfócanse en aspectos específicos do sistema inmunitario que contribúen á psoriíase.[80] Estes medicamentos xeralmente son ben tolerados e os datos limitados de resultados a longo prazo demostraron que os produtos biolóxicos son seguros para o uso a longo prazo na psoríase en placa de moderada a grave.[80][82] Porén, debido ás súas accións inmunosupresoras, os produtos biolóxicos asociáronse cun pequen aumento no risco de infección.[80]
As directrices oficiais consideran os produtos biolóxicos como tratamentos de terceira liña para a psoríase en placa despois dunha resposta inadecuada ó tratamento tópico, a fototerapia e os tratamentos sistémicos non biolóxicos.[82] A seguridade dos produtos biolóxicos durante o embarazo non foi avaliada. As directrices europeas recomendan evitar os produtos biolóxicos se se propón quedar embarazada; as terapias anti-TNF como o infliximab non se recomendan para uso en portadores crónicos de virus da hepatite B ou individuos afectados polo VIH.[80]
Varios anticorpos monoclonais atacan as citoquinas, as moléculas que as células empregan para enviarse sinais inflamatorios entre elas. O factor de necrose tumoral alfa é unha das principais citoquinas inflamatorias que o executan. Desenvolvéronse catro anticorpos monoclonais (MAbs) (infliximab, adalimumab, golimumab e certolizumab pegol) e un receptor reclamo recombinante TNF-α, o etanercept, para evitar os sinais do TNF-α. Ademais, desenvolvéronse anticorpos monoclonais, como ixekizumab,[83] contra as citoquinas proinflamatorias[84] e inhiben a vía inflamatoria nun punto diferente ós anticorpos anti-TNF-α.[29] IL-12 e IL-23 comparten un dominio común, p40, que é o obxectivo do ustekinumab da Food and Drug Administration.[31] En 2017, a US FDA aprobou guselkumab para psoríase de placas.[85] Realizáronse poucos estudos sobre a eficacia dos fármacos anti-TNF para a psoríase en nenos. Un estudo de control aleatorizado suxeriu que 12 semanas de tratamento con etanercept reduciron a extensión da psoríase en nenos sen efectos adversos duradeiros.[86]
Dous fármacos que se dirixen ás células T son efalizumab e alefacept. Efalizumab é un anticorpo monoclonal que se dirixe especificamente á subnidade CD11a do antíxeno asociado á función do linfocito 1.[80] Tamén bloquea a adhesión de células endoteliais que se atopan nos vasos sanguíneos e que atraen as células T. Efalizumab foi retirado polo fabricante voluntariamente do mercado europeo en febreiro de 2009 e do mercado estadounidense en xuño de 2009 debido á asociación da medicación con casos de leucoencefalopatía multifocal progresiva.[80] Alefacept tamén bloquea as moléculas que as células dendríticas utilizan para comunicarse coas células T e mesmo fai que as células asasinas naturais eliminen as células T como un xeito de controlar a inflamación.[29] Tamén pode utilizarse apremilast con este obxectivo.[11]
As persoas con psoríase poden desenvolver anticorpos neutralizantes contra os anticorpos monoclonais. A neutralización prodúcese cando un anticorpo antifármacos evita que un anticorpo monoclonal como o infliximab se una ó antíxeno nunha proba de laboratorio. Especificamente, a neutralización ocorre cando o anticorpo antifármaco se une no sitio de unión do antíxeno de infliximab no lugar de TNF-α. Cando infliximab xa non se une ó factor de necrose tumoral alfa, xa non diminúe a inflamación, e a psoríase pode empeorar. Non se rexistraron anticorpos neutralizantes contra etanercept, un fármaco biolóxico que é unha proteína de fusión composta de dous receptores de TNF-α. A falta de anticorpos neutralizantes contra o etanercept é probablemente secundaria á presenza innata do receptor de TNF-α, e do desenvolvemento de tolerancia inmunolóxica.[87]
Unha metaanálise de 2017 descubriu que ixekizumab, secukinumab, brodalumab, guselkumab, certolizumab e ustekinumab foron os biolóxicos máis efectivos para trata-la psoríase.[88] En xeral, os biolóxicos anti-IL17, anti-IL12/23, anti-IL23 e anti-TNF alpha son considerados máis efectivos cós tratamentos sistémicos tradicionais.[88] As vías inmunolóxicas da psoríase involucran os linfocitos TH-9, TH-22, TH-17 e TH-1, e os produtos biolóxicos anteriores dificultan diferentes aspectos destas vías.[89]
Outro posible tratamento para psoríase de moderada a grave é o ácido fumárico que pode ter unha efectividade semellante ó metotrexato.[90]
Cirurxía
editarEvidencia limitada suxire que a extirpación das amígdalas pode beneficiar ás persoas con psoríase de placas crónica, psoríase guttata e palmoplantar pustulosa.[91][92]
Dieta
editarEstudos non controlados suxeriron que os individuos con psoríase ou artrite psoriásica poden beneficiarse dunha dieta con suplementos de aceite de pescado rico en ácido eicosapentaenoico (EPA) e ácido docosahexaenoico (DHA).[93] As recomendacións dietéticas inclúen o consumo de peixes de auga fría (preferiblemente peixes silvestres, non de granxa) como o salmón, arenque e xarda, aceite de oliva virxe extra, legumes, vexetais, froitas e cereais, así como evitar o consumo de alcohol, carne vermella e produtos lácteos. O efecto do consumo de cafeína (incluíndo café, té negro, mate e chocolate negro) aínda non foi determinado.[94]
Hai unha alta taxa de enfermidade celíaca entre as persoas con psoríase.[94][95] Ó adoptar unha dieta sen glute, a gravidade da doenza xeralmente diminúe nas persoas con enfermidade celíaca e aquelas con anticorpos anti-gliadina.[93][96][97]
Prognose
editarA maioría das persoas con psoríase non experimentan nada máis que lesións cutáneas lenes que poden tratarse de xeito eficaz con terapias tópicas.[65]
Sábese que a psoríase ten un impacto negativo na calidade de vida tanto da persoa afectada coma dos membros da familia.[31] Dependendo da gravidade e a localización dos abrochos, os individuos poden experimentar un malestar físico significativo e algunha discapacidade. O proído e a dor poden interferir coas funcións básicas, como o coidado persoal e o sono.[45] A participación en actividades deportivas, certas ocupacións e o coidado dos membros da familia poden converterse en actividades difíciles para quen ten placas nas mans e nos pés.[45] As placas no coito cabeludo poden ser particularmente embarazosas xa que as placas escamosas no cabelo poden ser confundidas con caspa.[98]
As persoas con psoríase poden sentirse avergonzadas pola súa aparencia e ter unha mala imaxe de si mesmas, o cal pode derivar nun temor ó rexeitamento público e preocupacións psicosexuais. A psoríase asociouse cunha baixa autoestima e a depresión é máis común entre as persoas con esta condición.[4] As persoas con psoríase a miúdo séntense discriminadas por mor da crenza errada de que a psoríase é contaxiosa.[45] A angustia psicolóxica pode provocar trastorno depresivo maior e illamento social; unha alta taxa de pensamentos suicidas foi asociada coa psoríase.[20] Existen moitas ferramentas para medir a calidade de vida dos pacientes con psoríase e outros trastornos dermatolóxicos. A investigación clínica sinalou que os individuos a miúdo experimentan unha calidade de vida diminuída.[99] Os nenos con psoríase poden ser vítimas de bullying.[100]
Varias condicións están asociadas coa psoríase. Estas ocorren con máis frecuencia nas persoas maiores. Case a metade das persoas con psoríase maiores de 65 anos teñen cando menos tres comorbilidades (condicións concurrentes), e dous terzos teñen cando menos dúas comorbilidades.[101]
Doenzas cardiovasculares
editarA psoríase asociouse coa obesidade[4] e outros trastornos cardiovasculares e metabólicos. A incidencia da diabetes é un 27% máis alta nas persoas afectadas de psoríase que naquelas que non padecen esta condición.[102] A psoríase grave pode asociarse máis estreitamente co desenvolvemento da diabetes que a psoríase lene.[102] As persoas máis novas con psoríase tamén poden ter un maior risco de desenvolver diabetes.[101][103] As persoas con psoríase ou artrite psoriásica teñen un risco lixeiramente maior de padecer doenzas e ataques cardíacos en comparanza coa poboación xeral. O risco de doenza cardiovascular parece estar relacionado coa gravidade da psoríase e da súa duración. Non existen evidencias sólidas que suxiran que a psoríase estea asociada cun maior risco de morte por eventos cardiovasculares. O metotrexato pode achegar un grao de protección para o corazón.[35][101]
As probabilidades de ter hipertensión son 1,58 veces máis altas nas persoas con psoríase que nas que non teñen a condición; estas probabilidades son aínda maiores nos casos graves de psoríase. Observouse unha asociación semellante nas persoas con artrite psoriásica: descubriuse que as probabilidades de ter hipertensión eran 2,07 veces maiores en comparanza coas probabilidades da poboación xeral. O vínculo entre a psoríase e a hipertensión non se entende polo momento. Os mecanismos que se supoñen implicados nesta relación inclúen os seguintes: desregulación do sistema renina-anxiotensina, niveis elevados de endotelina 1 no sangue, e aumento do estrés oxidativo.[103][104] A incidencia da normalidade cardíaca de fibrilación auricular é 1,31 veces máis alta nas persoas con psoríase e 1,63 veces nas persoas con psoríase grave.[105] Pode haber un risco lixeiramente maior de accidente cerebrovascular asociado coa psoríase, especialmente en casos graves.[35][106] O tratamento de niveis elevados de colesterol con estatinas asociouse coa diminución da gravidade da psoríase, medida coa puntuación PASI, e tamén se asociou con melloras noutros factores de risco de doenza cardiovascular como os marcadores de inflamación.[107] Estes efectos cardioprotectores atribúense á capacidade das estatinas de mellorar o perfil de lípidos no sangue e debido ós seus efectos antiinflamatorios. O uso de estatinas en persoas con psoríase e hiperlipidemia foi asociado co incremento dos niveis da proteína C reactiva e TNFα así como a diminución da actividade da proteína inmune LFA-1.[107] En comparanza con persoas sen psoríase, os afectados con psoríase teñen máis posibilidades de satisfacer os criterios da síndrome metabólica.[17][105]
Outras doenzas
editarAs taxas da doenza de Crohn e de colite ulcerosa son superiores ás da poboación xeral, nun factor de 3,8 e 7,5 respectivamente.[4] As persoas con psoríase tamén teñen un alto risco de padecer enfermidade celíaca.[94][97] Poucos estudos avaliaron a relación da esclerose múltiple coa psoríase e a súa relación está en cuestión.[4][108] A psoríase asociouse cun incremento do 16% no risco relativo xeral de cancro non de pel.[35] As persoas con psoríase teñen un 52% máis de risco de padecer cancros de pulmón e bronquios, un 205% máis de desenvolver cancros do tracto gastrointestinal, un 31% máis de desenvolver cancros do tracto urinario, un 90% máis de desenvolver cancro de fígado e un 46% máis de risco de desenvolver cancro de páncreas.[35] O risco de desenvolver cancro de pel non melanoma tamén é maior. A psoríase incrementa o risco de desenvolver cancro epidermoide nun 431% e de cancro basocelular nun 100%.[35] Non existe maior risco de desenvolver melanoma asociado coa psoríase.[35]
Epidemioloxía
editarEstímase que a psoríase afecta a un 2 ou 4% da poboación da sociedade occidental.[9] A taxa de psoríase varía segundo a idade, a rexión e a etnia, e estímase que unha combinación de factores ambientais e xenéticos son os responsables destas diferenzas.[9] Pode producirse a calquera idade, aínda que aparece de maneira máis frecuente por vez primeira entre os 15 e os 25 anos. Arredor dun terzo das persoas con psoríase foron diagnosticadas antes dos 20 anos.[109] A psoríase afecta a ámbolos dous sexos do mesmo xeito.[55]
A psoríase afecta a máis de 6,7 millóns de estadounidenses e é máis frecuente en adultos.[10] No 2011, esta doenza afectaba a máis de 39 000 persoas en Galicia.[110]
As persoas con doenza inflamatoria intestinal como o mal de Crohn ou colite ulcerosa teñen un risco superior de desenvolver psoríase.[42] A psoríase é máis común nos países arredados do ecuador.[42] As persoas de ascendencia europea teñen máis posibilidades de ter psoríase e esta condición é relativamente pouco común entre os afroamericanos e extremadamente pouco común entre os indíxenas americanos.[43]
Historia
editarOs estudosos cren que a psoríase puido ser unha das diversas condicións da pel chamadas tzaraath (traducido como lepra) na Biblia hebrea, unha condición imposta como castigo por difamación. O paciente era considerado "impuro" (véxase tumah e taharah) durante a súa fase de aflición e finalmente era tratado polo kohen.[111] Porén, é máis probable que esta confusión xurdise do uso do mesmo termo grego para ámbalas dúas condicións. Os gregos usaron o termo lepra (λεπρα) para condicións da pel escamosa. Usaron o termo psora para describir comechón na pel.[111] Comezou a ser coñecida como a lepra de Willan a finais do século XVIII cando o dermatólogo inglés Robert Willan e Thomas Bateman a diferenciaron doutras doenzas da pel. A lepra, segundo eles, distínguese pola forma regular e circular dos parches, mentres que a psoríase é sempre irregular. Willan identificou dúas categorías: leprosa graecorum e psora leprosa.[112]
Crese que a psoríase foi descrita por vez primeira polo romano Aulo Cornelio Celso.[113] O dermatólogo británico Thomas Bateman describiu unha posible relación entre a psoríase e os síntomas da artrite en 1813.[113]
A historia da psoríase está inzada de tratamentos de dubidosa eficacia e alta toxicidade. Nos séculos XVIII e XIX, a solución de Fowler, que contiña un veleno e composto arsénico carcinóxeno, foi usado polos dermatólogos para o tratamento da psoríase.[111] Tamén se usou o mercurio para o tratamento da psoríase durante este período de tempo.[111] O xofre, o iodo e o fenol tamén foron usados nesta época porque se cría incorrectamente que a psoríase era unha doenza infecciosa.[111] Os alcatráns de hulla usáronse amplamente coa irradiación con luz ultravioleta como un enfoque de tratamento tópico a comezos do século XX.[111][114] Durante este mesmo período, os casos de artrite psoriásica tratáronse con preparacións de ouro administradas por vía intravenosa da mesma maneira que a artrite reumatoide.[114] Todos estes tratamentos foron substituídos por terapias modernas tópicas e sistémicas.
Etimoloxía
editarA verba psoríase provén do grego ψωρίασις, que quere dicir "condición de proído" ou "ter proído"[115] de psora, "proído" e -iasis, "acción, condición".
Sociedade e cultura
editarA Federación Internacional de Asociacións de Psoríase (IFPA) é a organización paraugas global para asociacións nacionais e rexionais de pacientes de psoríase e tamén reúne os principais expertos en investigación da psoríase e artrite psoriásica para celebrar congresos científicos cada tres anos.[116] A Rede Internacional de Psoríase, un programa da Fundación René Touraine]], reúne dermatólogos, reumatólogos e outros profesionais relacionados co tratamento da psoríase. Organizacións sen ánimo de lucro como a "National Psoriasis Foundation" nos Estados Unidos, a "Psoriasis Association" no Reino Unido e "Psoriasis Australia" ofrecen apoio e educación sobre a psoríase nos seus respectivos países.
Custo
editarO custo anual do tratamento da psoríase nos Estados Unidos estimouse en 32,5 billóns de dólares, incluíndo 12,2 billóns en custos directos. Os custos da farmacia son a principal fonte de gastos directos, sendo a terapia biolóxica a máis prevalente. Estes custos medran significativamente cando se teñen en conta as afeccións concomitantes, como doenzas cardíacas, hipertensión, diabetes, doenzas pulmonares e trastornos psiquiátricos. Os gastos relacionados coas comorbilidades estimáronse en 23 000 dólares engadidos por paciente e por ano.[117]
Investigación
editarO papel da resistencia á insulina na patoxenia da psoríase atópase actualmente en investigación. A investigación preliminar suxeriu que os antioxidantes como o polifenol pode ter efectos beneficiosos nas características inflamatorias da psoríase.[118]
Moitos dos medicamentos novos que se están a investigar diríxense ó eixo Th17/IL-23,[118] particularmente os inhibidores de IL-23p19, xa que a IL-23p19 está presente en concentracións elevadas nas lesións da pel causadas pola psoríase, á vez que contribúe menos á protección contra as infeccións oportunistas.[119] Outras citoquinas como a IL-17 e IL-22 tamén foron obxectivos de inhibición, xa que desempeñan funcións importantes na patoxénese da psoríase.[119] Outra vía de investigación centrouse no uso de inhibidores do factor de crecemento endotelial vascular para tratar a psoríase.[57] Os axentes orais que están sendo investigados como alternativas a medicacións administradas por inxeccións son os inhibidores da quinase Janus, inhibidores da proteína quinase C, inhibidores de proteína quinase activada por mitóxeno e inhibidores de fosfodiesterasae 4, tódolos cales demostraron a súa eficacia en varios ensaios clínicos de fases 2 e 3.[118][119] Porén, estes axentes teñen efectos secundarios potencialmente graves por mor dos seus mecanismos inmunosupresores.[119]
Notas
editar- ↑ Definicións no Dicionario da Real Academia Galega e no Portal das Palabras para psoríase.
- ↑ Termo en galego en Vocabulario de medicina, Universidade de Santiago de Compostela / Consellería de Sanidade, 2008, e Diccionario galego de termos médicos, Santiago de Compostela, Xunta de Galicia, 2002
- ↑ 3,0 3,1 3,2 3,3 3,4 3,5 3,6 "Questions and Answers about Psoriasis". National Institute of Arthritis and Musculoskeletal and Skin Diseases. outubro de 2013. Arquivado dende o orixinal o 08 de xullo de 2015. Consultado o 1 de xullo de 2015.
- ↑ 4,0 4,1 4,2 4,3 4,4 4,5 4,6 4,7 4,8 Menter A, Gottlieb A, Feldman SR, Van Voorhees AS, Leonardi CL, Gordon KB, Lebwohl M, Koo JY, Elmets CA, Korman NJ, Beutner KR, Bhushan R (maio de 2008). "Guidelines of care for the management of psoriasis and psoriatic arthritis: Section 1. Overview of psoriasis and guidelines of care for the treatment of psoriasis with biologics". J Am Acad Dermatol 58 (5): 826–50. PMID 18423260. doi:10.1016/j.jaad.2008.02.039.
- ↑ LeMone, Priscilla; Burke, Karen; Dwyer, Trudy; Levett-Jones, Tracy; Moxham, Lorna; Reid-Searl, Kerry (2015). Medical-Surgical Nursing (en inglés). Pearson Higher Education AU. p. 454. ISBN 9781486014408.
- ↑ Ely JW, Seabury Stone M (marzo de 2010). "The generalized rash: part II. Diagnostic approach". Am Fam Physician 81 (6): 735–9. PMID 20229972. Arquivado dende o orixinal o 02 de febreiro de 2014. Consultado o 27 de xuño de 2019.
- ↑ 7,00 7,01 7,02 7,03 7,04 7,05 7,06 7,07 7,08 7,09 7,10 7,11 7,12 7,13 Boehncke, WH; Schön, MP (26 de maio de 2015). "Psoriasis.". Lancet 386 (9997): 983–94. PMID 26025581. doi:10.1016/S0140-6736(14)61909-7.
- ↑ 8,0 8,1 8,2 8,3 8,4 8,5 8,6 8,7 8,8 Jain, Sima (2012). Dermatology : illustrated study guide and comprehensive board review. Springer. pp. 83–87. ISBN 978-1-4419-0524-6. Arquivado dende o orixinal o 08 de setembro de 2017. Consultado o 27 de xuño de 2019.
- ↑ 9,0 9,1 9,2 Parisi R, Symmons DP, Griffiths CE, Ashcroft DM (febreiro de 2013). Identification and Management of Psoriasis and Associated ComorbidiTy (IMPACT) project team. "Global epidemiology of psoriasis: a systematic review of incidence and prevalence". J Invest Dermatol 133 (2): 377–85. PMID 23014338. doi:10.1038/jid.2012.339.
- ↑ 10,0 10,1 "Questions and Answers About Psoriasis". www.niams.nih.gov (en inglés). 12 de abril de 2017. Arquivado dende o orixinal o 22 de abril de 2017. Consultado o 22 de abril de 2017.
- ↑ 11,0 11,1 11,2 11,3 11,4 Palfreeman AC, McNamee KE, McCann FE (marzo de 2013). "New developments in the management of psoriasis and psoriatic arthritis: a focus on apremilast". Drug Des Devel Ther 7: 201–210. PMC 3615921. PMID 23569359. doi:10.2147/DDDT.S32713.
- ↑ Colledge, N.R.; Walker, B.R.; Ralston, S.H., eds. (2010). Davidson's principles and practice of medicine. (21st ed.). Edimburgo: Churchill Livingstone/Elsevier. pp. 1260–1. ISBN 978-0-7020-3084-0.
- ↑ 13,0 13,1 Zattra E, Belloni Fortina A, Peserico A, Alaibac M (maio de 2012). "Erythroderma in the era of biological therapies". Eur J Dermatol 22 (2): 167–71. PMID 22321651. doi:10.1684/ejd.2011.1569.
- ↑ Stanway A. "Erythrodermic psoriasis". DermNet NZ. Arquivado dende o orixinal o 02 de febreiro de 2014. Consultado o 16 de marzo de 2014.
- ↑ 15,0 15,1 James, William; Berger, Timothy; Elston, Dirk (2005). Andrews' Diseases of the Skin: Clinical Dermatology (10th ed.). Saunders. pp. 191–7. ISBN 978-0-7216-2921-6.
- ↑ Robinson A, Van Voorhees AS, Hsu S, Korman NJ, Lebwohl MG, Bebo BF, Kalb RE (2012). "Treatment of pustular psoriasis: From the Medical Board of the National Psoriasis Foundation". J Am Acad Dermatol 67 (2): 279–88. PMID 22609220. doi:10.1016/j.jaad.2011.01.032.
- ↑ 17,0 17,1 17,2 17,3 17,4 17,5 17,6 17,7 Raychaudhuri SK, Maverakis E, Raychaudhuri SP (xaneiro de 2014). "Diagnosis and classification of psoriasis". Autoimmun Rev 13 (4–5): 490–5. PMID 24434359. doi:10.1016/j.autrev.2014.01.008.
- ↑ 18,0 18,1 18,2 18,3 Weigle N, McBane S (maio de 2013). "Psoriasis". Am Fam Physician 87 (9): 626–33. PMID 23668525.
- ↑ 19,0 19,1 19,2 19,3 Gudjonsson JE, Elder JT, Goldsmith LA, Katz SI, Gilchrest BA, Paller AS, Leffell DJ, Wolff K (2012). "18: Psoriasis". Fitzpatrick's Dermatology in General Medicine (8th ed.). McGraw-Hill. ISBN 978-0-07-166904-7.
- ↑ 20,0 20,1 Gelmetti C (xaneiro de 2009). "Therapeutic moisturizers as adjuvant therapy for psoriasis patients". Am J Clin Dermatol 10 (Suppl 1): 7–12. PMID 19209948. doi:10.2165/0128071-200910001-00002.
- ↑ 21,0 21,1 21,2 Yesudian PD, Chalmers RJ, Warren RB, Griffiths CE (xaneiro de 2012). "In search of oral psoriasis". Arch Dermatol Res 304 (1): 1–5. PMID 21927905. doi:10.1007/s00403-011-1175-3.
- ↑ Ship, Martin S. Greenberg, Michael Glick, Jonathan A. (2008). Burket's oral medicine (11th ed.). Hamilton, Ont.: BC Decker. pp. 103–4. ISBN 978-1-55009-345-2.
- ↑ Reamy BV, Derby R, Bunt CW (marzo de 2010). "Common tongue conditions in primary care". Am Fam Physician 81 (5): 627–34. PMID 20187599.
- ↑ 24,0 24,1 Chimenti MS, Saraceno R, Chiricozzi A, Giunta A, Chimenti S, Perricone R (abril de 2013). "Profile of certolizumab and its potential in the treatment of psoriatic arthritis". Drug Des Devel Ther 7: 339–48. PMC 3633576. PMID 23620660. doi:10.2147/DDDT.S31658.
- ↑ 25,0 25,1 Goldenstein-Schainberg C, Favarato MH, Ranza R (xaneiro-febreiro de 2012). "Current and relevant concepts in psoriatic arthritis" (PDF). Rev Bras Reumatol 52 (1): 98–106. PMID 22286649. doi:10.1590/s0482-50042012000100010. Arquivado dende o orixinal (PDF) o 13 de abril de 2014. Consultado o 27 de xuño de 2019.
- ↑ Krawczyk-Wasielewska A, Skorupska E, Samborski W (abril de 2013). "Sacroiliac joint pain as an important element of psoriatic arthritis diagnosis". Postepy Dermatol Alergol 30 (2): 108–12. PMC 3834688. PMID 24278057. doi:10.5114/pdia.2013.34161.
- ↑ 27,0 27,1 Tan ES, Chong WS, Tey HL (decembro de 2012). "Nail psoriasis: a review". Am J Clin Dermatol 13 (6): 375–88. PMID 22784035. doi:10.2165/11597000-000000000-00000.
- ↑ Krueger G, Ellis CN (2005). "Psoriasis—recent advances in understanding its pathogenesis and treatment". J Am Acad Dermatol 53 (1 Suppl 1): S94–100. PMID 15968269. doi:10.1016/j.jaad.2005.04.035.
- ↑ 29,00 29,01 29,02 29,03 29,04 29,05 29,06 29,07 29,08 29,09 29,10 29,11 29,12 29,13 Nestle FO, Kaplan DH, Barker J (2009). "Psoriasis". N Engl J Med 361 (5): 496–509. PMID 19641206. doi:10.1056/NEJMra0804595.
- ↑ Catherine H, Smith (17 de agosto de 2006). "Psoriasis and its management". TheBMJ 333 (7564): 380–384. PMC 1550454. PMID 16916825. doi:10.1136/bmj.333.7564.380. Arquivado dende o orixinal o 09 de agosto de 2016. Consultado o 8 de outubro de 2015.
- ↑ 31,0 31,1 31,2 31,3 31,4 31,5 31,6 Prieto-Pérez R, Cabaleiro T, Daudén E, Ochoa D, Roman M, Abad-Santos F (agosto de 2013). "Genetics of Psoriasis and Pharmacogenetics of Biological Drugs". Autoimmune Dis. 2013 (613086): 613086. PMC 3771250. PMID 24069534. doi:10.1155/2013/613086.
- ↑ Jordan CT, Cao L, Roberson ED; et al. (abril de 2012). "Rare and common variants in CARD14, encoding an epidermal regulator of NF-kappaB, in psoriasis". The American Journal of Human Genetics 90 (5): 796–808. PMC 3376540. PMID 22521419. doi:10.1016/j.ajhg.2012.03.013.
- ↑ Jordan CT, Cao L, Roberson ED; et al. (abril de 2012). "PSORS2 is due to mutations in CARD14". The American Journal of Human Genetics 90 (5): 784–795. PMC 3376640. PMID 22521418. doi:10.1016/j.ajhg.2012.03.012.
- ↑ 34,0 34,1 Clarke P (xullo de 2011). "Psoriasis" (PDF). Aust Fam Physician 40 (7): 468–73. PMID 21743850. Arquivado dende o orixinal (PDF) o 27 de xuño de 2019. Consultado o 27 de xuño de 2019.
- ↑ 35,0 35,1 35,2 35,3 35,4 35,5 35,6 35,7 Richard MA, Barnetche T, Horreau C, Brenaut E, Pouplard C, Aractingi S, Aubin F, Cribier B, Joly P, Jullien D, Le Maître M, Misery L, Ortonne JP, Paul C (agosto de 2013). "Psoriasis, cardiovascular events, cancer risk and alcohol use: evidence-based recommendations based on systematic review and expert opinion". J Eur Acad Dermatol Venereol 27 (Supplement 3): 2–11. PMID 23845148. doi:10.1111/jdv.12162.
- ↑ 36,0 36,1 36,2 Cedeno-Laurent F, Gómez-Flores M, Mendez N, Ancer-Rodríguez J, Bryant JL, Gaspari AA, Trujillo JR (xaneiro de 2011). "New insights into HIV-1-primary skin disorders". J Int AIDS Soc 14 (5): 5. PMC 3037296. PMID 21261982. doi:10.1186/1758-2652-14-5.
- ↑ Fife DJ, Waller JM, Jeffes EW, Koo JY (maio de 2007). "Unraveling the Paradoxes of HIV-associated Psoriasis: A Review of T-cell Subsets and Cytokine Profiles". Dermatology Online Journal 13 (2). Arquivado dende o orixinal o 21 de abril de 2008. Consultado o 27 de xuño de 2019.
- ↑ 38,0 38,1 Wong T, Hsu L, Liao W (xaneiro-febreiro de 2013). "Phototherapy in psoriasis: a review of mechanisms of action". J Cutan Med Surg 17 (1): 6–12. PMC 3736829. PMID 23364144. doi:10.2310/7750.2012.11124.
- ↑ Martin DA, Towne JE, Kricorian G, Klekotka P, Gudjonsson JE, Krueger JG, Russell CB (xaneiro de 2013). "The emerging role of IL-17 in the pathogenesis of psoriasis: preclinical and clinical findings". J Invest Dermatol 133 (1): 17–26. PMC 3568997. PMID 22673731. doi:10.1038/jid.2012.194.
- ↑ Connexions (ed.). "Images of Memorable Cases: Case 34". Rice University.
This AIDS patient presented with a pruritic eruption over most of his body
- ↑ Fry, L; Baker, BS (2007). "Triggering psoriasis: the role of infections and medications.". Clinics in Dermatology 25 (6): 606–15. PMID 18021899. doi:10.1016/j.clindermatol.2007.08.015.
- ↑ 42,0 42,1 42,2 Guerra I, Gisbert JP (xaneiro de 2013). "Onset of psoriasis in patients with inflammatory bowel disease treated with anti-TNF agents". Expert Rev Gastroenterol Hepatol 7 (1): 41–8. PMID 23265148. doi:10.1586/egh.12.64.
- ↑ 43,0 43,1 43,2 43,3 43,4 Weller, Richard; John AA Hunter; John Savin; Mark Dahl (2008). Clinical dermatology (4ª ed.). Malden, MA: Blackwell. pp. 54–70. ISBN 978-1-4443-0009-3.
- ↑ 44,0 44,1 44,2 Ouyang W (decembro de 2010). "Distinct roles of IL-22 in human psoriasis and inflammatory bowel disease". Cytokine Growth Factor Rev 21 (6): 435–41. PMID 21106435. doi:10.1016/j.cytogfr.2010.10.007.
- ↑ 45,0 45,1 45,2 45,3 Parrish L. (2012). "Psoriasis: symptoms, treatments and its impact on quality of life". Br J Community Nurs 17 (11): 524–528. PMID 23124421. doi:10.12968/bjcn.2012.17.11.524.
- ↑ Baliwag, Jaymie; Barnes, Drew H.; Johnston, Andrew (1 de xuño de 2015). "Cytokines in psoriasis". Cytokine. Skin Disease, Immune Response and Cytokines 73 (2): 342–350. PMC 4437803. PMID 25585875. doi:10.1016/j.cyto.2014.12.014.
- ↑ Roberson ED, Bowcock AM (setembro de 2010). "Psoriasis genetics: breaking the barrier". Trends Genet 26 (9): 415–23. PMC 2957827. PMID 20692714. doi:10.1016/j.tig.2010.06.006.
- ↑ Ramos-e-Silva M; Jacques Cd (maio-xuño de 2012). "Epidermal barrier function and systemic diseases". Clin Dermatol 30 (3): 277–9. PMID 22507041. doi:10.1016/j.clindermatol.2011.08.025.
- ↑ 49,0 49,1 Dombrowski Y, Schauber J (maio de 2012). "Cathelicidin LL-37: a defense molecule with a potential role in psoriasis pathogenesis". Exp Dermatol 21 (5): 327–30. PMID 22509827. doi:10.1111/j.1600-0625.2012.01459.x.
- ↑ 50,0 50,1 50,2 Mudigonda P, Mudigonda T, Feneran AN, Alamdari HS, Sandoval L, Feldman SR (outubro de 2012). "Interleukin-23 and interleukin-17: importance in pathogenesis and therapy of psoriasis". Dermatol Online J 18 (10): 1. PMID 23122008. Arquivado dende o orixinal o 31 de marzo de 2016. Consultado o 27 de xuño de 2019.
- ↑ Johnson MA, Armstrong AW (2012). "Clinical and Histologic Diagnostic Guidelines for Psoriasis: A Critical Review". Clin Rev Allerg Immunol 44 (2): 166–72. PMID 22278173. doi:10.1007/s12016-012-8305-3.
- ↑ Kunz M, Ibrahim SM (2009). "Cytokines and cytokine profiles in human autoimmune diseases and animal models of autoimmunity". Mediators Inflamm 2009: 1–20. PMC 2768824. PMID 19884985. doi:10.1155/2009/979258.
- ↑ "Application to Dermatology of International Classification of Disease (ICD-10)". The International League of Dermatological Societies. Arquivado dende o orixinal o 09 de xullo de 2006. Consultado o 27 de xuño de 2019.
- ↑ Freedberg, Irwin M.; Fitzpatrick, Thomas B. (2003). Fitzpatrick's dermatology in general medicine (6th ed.). McGraw-Hill. p. 414. ISBN 978-0-07-138076-8.
- ↑ 55,0 55,1 Kupetsky EA, Keller M (novembro-decembro de 2013). "Psoriasis vulgaris: an evidence-based guide for primary care". J Am Board Fam Med 26 (6): 787–801. PMID 24204077. doi:10.3122/jabfm.2013.06.130055.
- ↑ Griffiths CE, Christophers E, Barker JN, Chalmers RJ, Chimenti S, Krueger GG, Leonardi C, Menter A, Ortonne JP, Fry L (febreiro de 2007). "A classification of psoriasis vulgaris according to phenotype". Br J Dermatol 156 (2): 258–62. PMID 17223864. doi:10.1111/j.1365-2133.2006.07675.x.
- ↑ 57,0 57,1 Weidemann AK, Crawshaw AA, Byrne E, Young HS (setembro de 2013). "Vascular endothelial growth factor inhibitors: investigational therapies for the treatment of psoriasis". Clin Cosmet Investig Dermatol 6: 233–44. PMC 3790838. PMID 24101875. doi:10.2147/CCID.S35312.
- ↑ Han R, Rostami-Yazdi M, Gerdes S, Mrowietz U (setembro de 2013). "Triptolide in the treatment of psoriasis and other immune-mediated inflammatory diseases". British Journal of Clinical Pharmacology 74 (3): 424–36. PMC 3477344. PMID 22348323. doi:10.1111/j.1365-2125.2012.04221.x.
- ↑ Quatresooz P, Hermanns-Lê T, Piérard GE, Humbert P, Delvenne P, Piérard-Franchimont C (xuño de 2012). "Ustekinumab in psoriasis immunopathology with emphasis on the Th17-IL23 axis: a primer". J Biomed Biotechnol 2012 (147413): 147413. PMC 3384985. PMID 22754278. doi:10.1155/2012/147413.
- ↑ 60,0 60,1 Mrowietz U, Kragballe K, Reich K, Spuls P, Griffiths CE, Nast A, Franke J, Antoniou C, Arenberger P, Balieva F, Bylaite M, Correia O, Daudén E, Gisondi P, Iversen L, Kemény L, Lahfa M, Nijsten T, Rantanen T, Reich A, Rosenbach T, Segaert S, Smith C, Talme T, Volc-Platzer B, Yawalkar N (xaneiro de 2011). "Definition of treatment goals for moderate to severe psoriasis: a European consensus". Arch Dermatol Res 303 (1): 1–10. PMC 3016217. PMID 20857129. doi:10.1007/s00403-010-1080-1.
- ↑ Mease PJ (novembro de 2011). "Measures of psoriatic arthritis: Tender and Swollen Joint Assessment, Psoriasis Area and Severity Index (PASI), Nail Psoriasis Severity Index (NAPSI), Modified Nail Psoriasis Severity Index (mNAPSI), Mander/Newcastle Enthesitis Index (MEI), Leeds Enthesitis Index (LEI), Spondyloarthritis Research Consortium of Canada (SPARCC), Maastricht Ankylosing Spondylitis Enthesis Score (MASES), Leeds Dactylitis Index (LDI), Patient Global for Psoriatic Arthritis, Dermatology Life Quality Index (DLQI), Psoriatic Arthritis Quality of Life (PsAQOL), Functional Assessment of Chronic Illness Therapy-Fatigue (FACIT-F), Psoriatic Arthritis Response Criteria (PsARC), Psoriatic Arthritis Joint Activity Index (PsAJAI), Disease Activity in Psoriatic Arthritis (DAPSA), and Composite Psoriatic Disease Activity Index (CPDAI)". Arthritis Care Res (Hoboken) 63 (Supplement 11): S64–85. PMID 22588772. doi:10.1002/acr.20577.
- ↑ "Psoriasis Update". Skin & Aging 14 (3): 46–50. 2006. Arquivado dende o orixinal o 02 de marzo de 2011. Consultado o 27 de xuño de 2019.
- ↑ Louden BA, Pearce DJ, Lang W, Feldman SR (2004). "A Simplified Psoriasis Area Severity Index (SPASI) for rating psoriasis severity in clinic patients". Dermatol. Online J. 10 (2): 7. PMID 15530297.
- ↑ 64,0 64,1 64,2 64,3 64,4 Menter A, Griffiths CE (xullo de 2007). "Current and future management of psoriasis". Lancet 370 (9583): 272–84. PMID 17658398. doi:10.1016/S0140-6736(07)61129-5.
- ↑ 65,0 65,1 Samarasekera EJ, Sawyer L, Wonderling D, Tucker R, Smith CH (2013). "Topical therapies for the treatment of plaque psoriasis: systematic review and network meta-analyses". Br J Dermatol 168 (5): 954–67. PMID 23413913. doi:10.1111/bjd.12276.
- ↑ Mason AR, Mason J, Cork M, Dooley G, Hancock H (2013). "Topical treatments for chronic plaque psoriasis". Cochrane Database Syst Rev 3 (CD005028): CD005028. PMID 23543539. doi:10.1002/14651858.CD005028.pub3.
- ↑ 67,0 67,1 Schlager, Justin Gabriel; Rosumeck, Stefanie; Werner, Ricardo Niklas; Jacobs, Anja; Schmitt, Jochen; Schlager, Christoph; Nast, Alexander (26 de febreiro de 2016). "Topical treatments for scalp psoriasis". The Cochrane Database of Systematic Reviews 2: CD009687. ISSN 1469-493X. PMID 26915340. doi:10.1002/14651858.CD009687.pub2.
- ↑ 68,0 68,1 Asztalos ML, Heller MM, Lee ES, Koo J (maio de 2013). "The impact of emollients on phototherapy: a review". J Am Acad Dermatol 68 (5): 817–24. PMID 23399460. doi:10.1016/j.jaad.2012.05.034.
- ↑ Menter A, Korman NJ, Elmets CA, Feldman SR, Gelfand JM, Gordon KB, Gottlieb A, Koo JY, Lebwohl M, Lim HW, Van Voorhees AS, Beutner KR, Bhushan R (2009). "Guidelines of care for the management of psoriasis and psoriatic arthritis: Section 3. Guidelines of care for the management and treatment of psoriasis with topical therapies". J Am Acad Dermatol 60 (4): 643–59. PMID 19217694. doi:10.1016/j.jaad.2008.12.032.
- ↑ Mason, AR; Mason, J; Cork, M; G; Hancock, H (28 de marzo de 2013). "Topical treatments for chronic plaque psoriasis.". The Cochrane Database of Systematic Reviews 3: CD005028. PMID 23543539. doi:10.1002/14651858.CD005028.pub3.
- ↑ Soleymani, T; Hung, T; Soung, J (abril de 2015). "The role of vitamin D in psoriasis: a review.". International Journal of Dermatology 54 (4): 383–92. PMID 25601579. doi:10.1111/ijd.12790.
- ↑ 72,0 72,1 72,2 Halverstam CP, Lebwohl M (setembro-outubro de 2008). "Nonstandard and off-label therapies for psoriasis". Clin Dermatol 26 (5): 546–53. PMID 18755374. doi:10.1016/j.clindermatol.2007.10.023.
- ↑ 73,0 73,1 73,2 Katz U, Shoenfeld Y, Zakin V, Sherer Y, Sukenik S (outubro de 2012). "Scientific evidence of the therapeutic effects of dead sea treatments: a systematic review". Semin Arthritis Rheum 42 (2): 186–200. PMID 22503590. doi:10.1016/j.semarthrit.2012.02.006.
- ↑ 74,0 74,1 74,2 Dogra S, De D (novembro-decembro de 2010). "Narrowband ultraviolet B in the treatment of psoriasis: the journey so far!". Indian J Dermatol Venereol Leprol 76 (6): 652–61. PMID 21079308. doi:10.4103/0378-6323.72461.
- ↑ Chen, Xiaomei; Yang, Ming; Cheng, Yan; Liu, Guan J; Zhang, Min (23 de outubro de 2013). "Narrow-band ultraviolet B phototherapy versus broad-band ultraviolet B or psoralen-ultraviolet A photochemotherapy for psoriasis". Cochrane Database of Systematic Reviews (en inglés) (10): CD009481. ISSN 1465-1858. PMID 24151011. doi:10.1002/14651858.CD009481.pub2.
- ↑ 76,0 76,1 Radack, KP; Farhangian, ME; Anderson, KL; Feldman, SR (marzo de 2015). "A review of the use of tanning beds as a dermatological treatment". Dermatology and Therapy 5 (1): 37–51. PMC 4374067. PMID 25735439. doi:10.1007/s13555-015-0071-8.
- ↑ Lapolla W, Yentzer BA, Bagel J, Halvorson CR, Feldman SR (maio de 2011). "A review of phototherapy protocols for psoriasis treatment". J Am Acad Dermatol 64 (5): 936–49. PMID 21429620. doi:10.1016/j.jaad.2009.12.054.
- ↑ Dunn LK, Gaar LR, Yentzer BA, O'Neill JL, Feldman SR (xullo de 2011). "Acitretin in dermatology: a review". J Drugs Dermatol 10 (7): 772–82. PMID 21720660.
- ↑ 79,0 79,1 Dogra S, Mahajan R (agosto de 2013). "Systemic methotrexate therapy for psoriasis: past, present and future". Clin Exp Dermatol 38 (6): 573–88. PMID 23837932. doi:10.1111/ced.12062.
- ↑ 80,0 80,1 80,2 80,3 80,4 80,5 80,6 Rustin, MH (novembro de 2012). "Long-term safety of biologics in the treatment of moderate-to-severe plaque psoriasis: review of current data". Br J Dermatol 167 (Suppl 3): 3–11. PMID 23082810. doi:10.1111/j.1365-2133.2012.11208.x.
- ↑ "Learning module: Psoriasis | American Academy of Dermatology". www.aad.org. Arquivado dende o orixinal o 27 de marzo de 2017. Consultado o 26 de marzo de 2017.
- ↑ 82,0 82,1 Griffiths, CE (novembro de 2012). "Biologics for psoriasis: current evidence and future use". Br J Dermatol 167 (Suppl 3): 1–2. PMID 23082809. doi:10.1111/j.1365-2133.2012.11207.x.
- ↑ Farahnik, B; Beroukhim, K; Zhu, TH; Abrouk, M; Nakamura, M; Singh, R; Lee, K; Bhutani, T; Koo, J (marzo de 2016). "Ixekizumab for the Treatment of Psoriasis: A Review of Phase III Trials.". Dermatology and Therapy 6 (1): 25–37. PMC 4799032. PMID 26910853. doi:10.1007/s13555-016-0102-0.
- ↑ Hueber W, Patel DD, Dryja T; et al. (outubro de 2010). "Effects of AIN457, a fully human antibody to interleukin-17A, on psoriasis, rheumatoid arthritis, and uveitis". Sci Transl Med 2 (52): 52ra72. PMID 20926833. doi:10.1126/scitranslmed.3001107.
- ↑ Novel Drug Approvals for 2017 Arquivado 2017-06-29 en Wayback Machine.
- ↑ Sanclemente, Gloria; Murphy, Ruth; Contreras, Javier; García, Hermenegildo; Bonfill Cosp, Xavier (24 de novembro de 2015). "Anti-TNF agents for paediatric psoriasis". Cochrane Database of Systematic Reviews (en inglés) (11): CD010017. ISSN 1465-1858. PMID 26598969. doi:10.1002/14651858.CD010017.pub2.
- ↑ Harding, FA; Stickler, MM; Razo, J; DuBridge, RB (2010). "The immunogenicity of humanized and fully human antibodies: residual immunogenicity resides in the CDR regions.". mAbs 2 (3): 256–65. PMC 2881252. PMID 20400861. doi:10.4161/mabs.2.3.11641.
- ↑ 88,0 88,1 Sbidian, Emilie; Chaimani, Anna; Garcia-Doval, Ignacio; Do, Giao; Hua, Camille; Mazaud, Canelle; Droitcourt, Catherine; Hughes, Carolyn; Ingram, John R (22 de decembro de 2017). "Systemic pharmacological treatments for chronic plaque psoriasis: a network meta-analysis". Cochrane Database of Systematic Reviews (en inglés) 12: CD011535. ISSN 1465-1858. PMID 29271481. doi:10.1002/14651858.CD011535.pub2.
- ↑ Memar, Omeed (16 de novembro de 2018). "Latest Therapeutics in Plaque Psoriasis: A Review". ARC Journal of Dermatology 3: 1–8. doi:10.20431/2456-0022.0303003 (inactivo 29 de maio de 2019).
- ↑ Atwan, Ausama; Ingram, John R; Abbott, Rachel; Kelson, Mark J; Pickles, Timothy; Bauer, Andrea; Piguet, Vincent (10 de agosto de 2015). "Oral fumaric acid esters for psoriasis". Cochrane Database of Systematic Reviews (en inglés) (8): CD010497. ISSN 1465-1858. PMID 26258748. doi:10.1002/14651858.CD010497.pub2.
- ↑ Wu W, Debbaneh M, Moslehi H, Koo J, Liao W (decembro de 2014). "Tonsillectomy as a treatment for psoriasis: a review". J Dermatol Treat 25 (6): 482–6. PMC 4620715. PMID 24283892. doi:10.3109/09546634.2013.848258.
- ↑ Sigurdardottir SL, Thorleifsdottir RH, Valdimarsson H, Johnston A (febreiro de 2013). "The role of the palatine tonsils in the pathogenesis and treatment of psoriasis". Br J Dermatol 168 (2): 237–42. PMID 22901242. doi:10.1111/j.1365-2133.2012.11215.x.
- ↑ 93,0 93,1 Kaimal S, Thappa DM (2010). "Diet in dermatology: revisited.". Indian J Dermatol Venereol Leprol 76 (2): 103–15. PMID 20228538. doi:10.4103/0378-6323.60540.
- ↑ 94,0 94,1 94,2 Barrea L, Nappi F, Di Somma C, Savanelli MC, Falco A, Balato A; et al. (2016). "Environmental Risk Factors in Psoriasis: The Point of View of the Nutritionist.". Int J Environ Res Public Health (Review) 13 (5): 743. PMC 4962284. PMID 27455297. doi:10.3390/ijerph13070743.
- ↑ Ni C, Chiu MW (2014). "Psoriasis and comorbidities: links and risks". Clin Cosmet Investig Dermatol (Review) 7: 119–32. PMC 4000177. PMID 24790463. doi:10.2147/CCID.S44843.
- ↑ Leffler DA, Green PH, Fasano A (outubro de 2015). "Extraintestinal manifestations of coeliac disease". Nat Rev Gastroenterol Hepatol (Review) 12 (10): 561–71. PMID 26260366. doi:10.1038/nrgastro.2015.131.
- ↑ 97,0 97,1 Bhatia BK, Millsop JW, Debbaneh M, Koo J, Linos E, Liao W (2014). "Diet and psoriasis, part II: celiac disease and role of a gluten-free diet". J Am Acad Dermatol 71 (2): 350–8. PMC 4104239. PMID 24780176. doi:10.1016/j.jaad.2014.03.017.
- ↑ Dessinioti C, Katsambas A (2013). "Seborrheic dermatitis: etiology, risk factors, and treatments: facts and controversies". Clin Dermatol 31 (4): 343–51. PMID 23806151. doi:10.1016/j.clindermatol.2013.01.001.
- ↑ Bhosle MJ, Kulkarni A, Feldman SR, Balkrishnan R (2006). "Quality of life in patients with psoriasis". Health Qual Life Outcomes 4: 35. PMC 1501000. PMID 16756666. doi:10.1186/1477-7525-4-35.
- ↑ Magin, P (xaneiro-febreiro de 2013). "Appearance-related bullying and skin disorders.". Clinics in Dermatology 31 (1): 66–71. PMID 23245976. doi:10.1016/j.clindermatol.2011.11.009.
- ↑ 101,0 101,1 101,2 Habif, Thomas P. (2010). "8". Clinical dermatology a color guide to diagnosis and therapy (5ª ed.). Edimburgo: Mosby Elsevier. ISBN 978-0-323-08037-8.
- ↑ 102,0 102,1 Shlyankevich J, Mehta NN, Krueger JG, Strober B, Gudjonsson JE, Qureshi AA, Tebbey PW, Kimball AB (decembro de 2014). "Accumulating Evidence for the Association and Shared Pathogenic Mechanisms Between Psoriasis and Cardiovascular-related Comorbidities". Am J Med 127 (12): 1148–53. PMC 4259841. PMID 25149424. doi:10.1016/j.amjmed.2014.08.008.
- ↑ 103,0 103,1 Armstrong AW, Harskamp CT, Armstrong EJ (xaneiro de 2013). "Psoriasis and the risk of diabetes mellitus: a systematic review and meta-analysis". JAMA Dermatol 149 (1): 84–91. PMID 23407990. doi:10.1001/2013.jamadermatol.406.
- ↑ Armstrong AW, Harskamp CT, Armstrong EJ (2013). "The association between psoriasis and hypertension: a systematic review and meta-analysis of observational studies". J Hypertens 31 (3): 433–42. PMID 23249828. doi:10.1097/HJH.0b013e32835bcce1.
- ↑ 105,0 105,1 Tablazon IL, Al-Dabagh A, Davis SA, Feldman SR (febreiro de 2013). "Risk of cardiovascular disorders in psoriasis patients: current and future". Am J Clin Dermatol 14 (1): 1–7. PMID 23329076. doi:10.1007/s40257-012-0005-5.
- ↑ "Psoriasis Linked to Stroke Risk". BBC. agosto de 2011. Arquivado dende o orixinal o 28 de agosto de 2011. Consultado o 27 de xuño de 2019.
- ↑ 107,0 107,1 Ghazizadeh R, Tosa M, Ghazizadeh M (2011). "Clinical Improvement in Psoriasis with Treatment of Associated Hyperlipidemia". Am J Med Sci 341 (5): 394–8. PMID 21233693. doi:10.1097/MAJ.0b013e3181ff8eeb.
- ↑ Hsu LN, Armstrong AW (novembro de 2012). "Psoriasis and autoimmune disorders: a review of the literature". J Am Acad Dermatol 67 (5): 1076–9. PMID 23062896. doi:10.1016/j.jaad.2012.01.029.
- ↑ Benoit S, Hamm H (2007). "Childhood Psoriasis". Clinics in Dermatology 25 (6): 555–562. PMID 18021892. doi:10.1016/j.clindermatol.2007.08.009.
- ↑ EuropaPress, ed. (10 de xuño de 2011). "Máis de 39.000 persoas padecen psoríase en Galicia, unha doenza autoinmune crónica que causa lesións na pel". Consultado o 15 de xullo de 2019.
- ↑ 111,0 111,1 111,2 111,3 111,4 111,5 Gruber F, Kastelan M, Brajac I (2004). "Psoriasis treatment—yesterday, today, and tomorrow". Acta Dermatovenereol Croat 12 (1): 30–4. PMID 15072746.
- ↑ Meenan FO (marzo de 1955). "A note on the history of psoriasis". Ir J Med Sci (351): 141–2. PMID 14353580.
- ↑ 113,0 113,1 Benedek TG (xuño de 2013). "Psoriasis and psoriatic arthropathy, historical aspects: part I". J Clin Rheumatol 19 (4): 193–8. PMID 23669809. doi:10.1097/RHU.0b013e318293eaeb.
- ↑ 114,0 114,1 Benedek TG (xuño de 2013). "Psoriasis and psoriatic arthropathy: historical aspects: part II". J Clin Rheumatol 19 (5): 267–71. PMID 23872545. doi:10.1097/RHU.0b013e31829d4ad4.
- ↑ Ritchlin, Christopher; Fitzgerald, Oliver (2007). Psoriatic and Reactive Arthritis: A Companion to Rheumatology (1ª ed.). Maryland Heights, MI: Mosby. p. 4. ISBN 978-0-323-03622-1. Arquivado dende o orixinal o 08 de xaneiro de 2017. Consultado o 27 de xuño de 2019.
- ↑ International Federation of Psoriasis Associations Arquivado 21 de novembro de 2008 en Wayback Machine.. Ifpa-pso.org. Consultado o 8 de xuño de 2013.
- ↑ Evans, C (xuño de 2016). "Managed care aspects of psoriasis and psoriatic arthritis". The American Journal of Managed Care 22 (8 Suppl): s238–243. PMID 27356195. Arquivado dende o orixinal o 02 de febreiro de 2017. Consultado o 27 de xuño de 2019.
- ↑ 118,0 118,1 118,2 Dubois Declercq S, Pouliot R (xullo de 2013). "Promising new treatments for psoriasis". ScientificWorldJournal 2013 (980419): 980419. PMC 3713318. PMID 23935446. doi:10.1155/2013/980419.
- ↑ 119,0 119,1 119,2 119,3 Patel M, Day A, Warren RB, Menter A (decembro de 2012). "Emerging Therapies for the Treatment of Psoriasis". Dermatol There (Heidelb) 2 (1): 16. PMC 3510410. PMID 23205338. doi:10.1007/s13555-012-0016-4.
Véxase tamén
editar| Wikimedia Commons ten máis contidos multimedia na categoría: Psoríase |
Bibliografía
editar- Baker, Barbara S. (2008). From Arsenic to Biologicals: A 200 Year History of Psoriasis. Beckenham UK: Garner. ISBN 978-0-9551603-2-5.
Ligazóns externas
editar- "Guidelines for the assessment and management of psoriasis". U.S. National Guideline Clearinghouse. Arquivado dende o orixinal o 27 de setembro de 2013. Consultado o 26 de xullo de 2013.
