Ciclo celular
O ciclo celular é un conxunto ordenado de fenómenos que se desenvolve durante toda a vida da célula, e que leva a esta a crecer e a dividirse en dúas células fillas. Todas as células orixínanse a partir doutra previamente existente.[2] O ciclo celular iníciase no momento en que aparece unha nova célula, descendente doutra que se divide, e remata no momento en que dita célula se divide e orixina dúas novas células fillas.
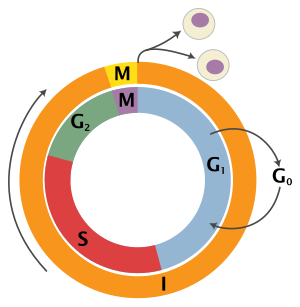
As células que se encontran no ciclo celular denomínanse proliferantes e as que se encontran en fase G0 chámanse células quiescentes.[3] As células quiescentes, que non están en división de forma permanente ou moi prolongada (neuronas por exemplo) non se considera que estean no ciclo celular e dise que están na fase G0.

Fases do ciclo celular
editarA célula pode encontrarse en dous estados claramente diferenciados:[4]
- O estado de non división ou interfase. A célula realiza as súas funcións específicas e, se está destinada a dividirse, comeza por realizar a duplicación do seu ADN.
- O estado de división, chamado fase M.
- Interfase
É o período comprendido entre dúas divisións celulares. É a fase máis longa do ciclo celular, e supón case o 95% do ciclo; transcorre entre dúas mitoses e comprende tres períodos:[5]
- Fase G1 (do inglés Gap 1, intervalo 1): É a primeira fase do ciclo celular, na que se produce crecemento celular con síntese de proteínas e de ARN. É o período que transcorre entre o fin dunha mitose e o inicio da síntese de ADN. Ten unha duración de entre 6 e 12 horas, e durante este tempo a célula duplica o seu tamaño e masa debido á continua síntese de todos os seus compoñentes, como resultado da expresión dos xenes que codifican as proteínas responsables do seu fenotipo particular. A carga xenética neste momento, en humanos é 2n 2c, é dicir, ten filamentos de cromatina repetidos ou homólogos (diploidía, 2n) e cada un ten unha cromátide (2c).
- Fase S (do inglés Synthesis): É a segunda fase do ciclo, na que se produce a replicación ou síntese do ADN. Como resultado cada filamento de cromatina se duplica e queda formado por dúas cromátides idénticas (cromátides irmás). O número de filamentos de cromatina non varía (2n), pero duplicouse o número de cromátides e a cantidade de ADN (4c cromátides), polo que a célula xa ten suficiente ADN para repartilo entre as súas dúas células fillas. O núcleo contén o dobre de proteínas nucleares e de ADN que ao principio. Cando máis tarde, no inicio da mitose, a cromatina se converta en cromosomas, estes aparecerán formados por dúas cromátides debido a esta duplicación. Ten unha duración dunhas 6-8 horas.
- Fase G2 (do inglés Gap 2): É a terceira fase de crecemento do ciclo celular na que continúa a síntese de proteínas e ARN. Ao final deste período aprécianse ao microscopio cambios na estrutura celular, que indican o comezo da división celular. Ten unha duración de entre 3 e 4 horas. Remata cando a cromatina empeza a condensarse ao inicio da mitose. A carga xenética en humanos é 2n 4c coma na fase S.
- Fase M (mitose e citocinese)
É a división celular na que unha célula proxenitora (célula somática eucariota) se divide en dúas células fillas idénticas. Esta fase inclúe a mitose (á súa vez dividida en: profase, metafase, anafase, telofase), e a citocinese, que se inicia xa na telofase mitótica ou ás veces na anafase. Se o ciclo completo durase 24 h, a fase M duraría arredor de media hora (30 minutos). Ao inicio da mitose os filamentos de cromatina condénsase e pasan ao estado de cromosomas.[3]
- Fase G0 de repouso
Algunhas células non proliferativas dos eucariotas multicelulares entran neste estado G0 desde o G1 e dise que son quiescentes, e pode considerarse que quedan fóra do ciclo celular. Poden permanecer quiescentes por longos períodos de tempo ou mesmo indefinidamente (como xeralmente sucede coas neuronas). Este estado dáse sobre todo en células que están totalmente diferenciadas, como un proceso normal do seu desenvolvemento. Durante esta fase desaparecen da célula as ciclinas e as quinases dependentes de ciclinas.
Ademais, cando unha célula chega á senescencia tamén pode entrar nesta fase. A senescencia é un estado que se produce en resposta a danos no ADN ou da súa degradación, o que faría inviables ás posibles células fillas. Nas células senescentes a fase G0 é unha alternativa bioquímica á autodestrución por apoptose. O termo "post-mitótico" úsase ás veces para referirse tanto ao estado de quiescencia coma ao de senescencia das células.
Regulación do ciclo celular
editarA regulación do ciclo celular en organismos eucariotas,[6] pode comprenderse como unha toma de decisións que fai a célula segundo as condicións nas que está en determinados puntos críticos, de proseguir ou non cara a seguintes fases da división.[7] Deste modo, a célula controla as seguintes cuestións:[3]
- Control da replicación do ADN. O ADN só debe replicarse unha vez para menter a euploidía celular. Na fase G1, a proteína ciclina-Cdk promove a adición ao complexo de recoñecemento da orixe de replicación do ADN duns reguladores chamados Cdc6, os cales recrutan a Mcm, formando o complexo prerreplicativo do ADN, que á súa vez recruta a maquinaria de replicación do ADN. Unha vez que se inicia a fase S, a Cdk-S causa a disociación de Cdc6 e a súa posterior proteólise, e a exportación ao citosol de Mcm, co que a orixe de replicación non pode, ata o ciclo seguinte, recrutar un complexo prerreplicativo (as degradacións proteolíticas sempre comportan irreversibilidade, ata que o ciclo inicie outra volta). Durante os períodos G2 e M mantense unida a estrutura de prerreplicación, ata que, tras a mitose, o nivel de actividade Cdk caia e isto permita a adición de Cdc6 e Mdm para o ciclo seguinte.
- Control do inicio da mitose. A ciclina B, típica na Cdk-M, está presente en todo o ciclo celular. A ciclina-Cdk está habitualmente inhibida por fosforilación por medio da proteína Wee, pero, ao final de G2, actívase unha fosfatase chamada Cdc25 que elimina o fosfato inhibidor e permite o aumento da súa actividade. Cdk-M inhibe a Wee e activa a Cdc25, o que produce unha retroalimentación positiva que permite a acumulación de Cdk-M.
- Control da separación das cromátides. Xa en mitose, tras a formación do fuso acromático e a superación do punto de restrición de unión a cinetocoros, as cromátides teñen que eliminar o seu esqueleto de cohesinas, que as une. Para isto, Cdk-M favorece a activación do APC (complexo promotor da anafase), unha ligase de ubiquitina, por unión a Cdc20. Este encima ubiquitiniza e favorece a ulterior degradación no proteasoma da segurina, inhibidor do encima separase que debe escindir as cohesinas. Se a separase (unha protease) está activa, rompe as cohesinas e separa as cromátides.
- Control da saída da mitose. Unha vez que os niveis de Cdk-M son altos, parece difícil deter a dinámica da mitose e entrar na citocinese, pero isto ocorre porque o APC activado pola Cdk-M, tras un lapso cuxo mecanismo de control é aínda descoñecido, ubiquitiniza a ciclina B, producindo o cesamento absoluto de actividade Cdk-M.
- Control do mantemento do estado G1. No período G1, a actividade Cdk está moi diminuída porque: APC-Hct1 (Cdc20 só actúa en mitose) elimina toda a ciclina B; acumúlanse inhibidores de Cdk; e a transcrición de ciclinas vai diminuír. Para saír deste repouso, débense acumular ciclinas de G1. Isto contrólase por medio de factores de proliferación celular, que son sinais externos. Os mecanismos moleculares de activación de transcrición de xenes das fases S e G2 necesarios para continuar o ciclo son os seguintes: estes xenes están regulados pola proteína reguladora E2F, a cal se une aos promotores dos xenes das ciclinas de G1/S e S. E2F está controlada pola proteína do retinoblastoma (Rb), a cal, en ausencia de factores de crecemento, inhibe a actividade promotora da transcrición de E2F. Cando existen sinais de proliferación, Cdk-G1 fosforila Rb, que perde afinidade por E2F, disóciase desta e permite que se expresen os xenes da fase S. Ademais, como E2F acelera a transcrición do seu propio xene, as Cdk-S e G1/S fosforilan tamén a Rb e a Hct1 (activador de APC, que degradaría estas ciclinas), prodúcese unha retroalimentación positiva.
Compoñentes reguladores
editar- Véxase tamén: Ciclina.
O ciclo celular está controlado por un sistema que vixía cada paso. En momentos concretos do ciclo, a célula comproba que se cumpran as condicións para pasar á fase seguinte. Deste modo, se no se cumpren estas condicións, o ciclo para.[3] Existen catro transicións principais:
- Paso de G0 a G1: comezo da proliferación.
- Transición de G1 a S: inicio da replicación.
- Paso de G2 a M: inicio da mitose.
- Avance de metafase a anafase.
Os xenes que regulan o ciclo celular divídense en tres grandes grupos:[8]
- Xenes que codifican proteínas para o ciclo. Encimas e precursores da síntese do ADN, encimas para a síntese e ensamblaxe de tubulina etc.
- Xenes que codifican proteínas que regulan positivamente o ciclo. Tamén chamados protooncoxenes, porque o seu mal funcionamento pode ocasionar un descontrol do ciclo e a formación dun tumor.[9] As proteínas que codifican estes xenes activan a proliferación celular, para que células quiescentes pasen á fase S e entren en división. Algúns destes xenes codifican as proteínas do sistema de ciclinas e quinases dependentes de ciclina. Poden ser:
- Xenes de resposta temperá, inducidos aos 15 minutos do tratamento con factores de crecemento, sen necesidade de síntese proteica.
- Xenes de resposta tardía, inducidos máis dunha hora despois do tratamento con factores de crecemento. A súa indución parece estar causada polas proteínas producidas polos xenes de resposta temperá.
- Xenes que codifican proteínas que regulan negativamente o ciclo. Tamén chamados xenes supresores tumorais.
As ciclinas e as quinases dependentes de ciclinas (CDK), sintetízanse a partir de protooncoxenes e traballan en cooperación para regular o ciclo positivamente. Fosforilan serinas e treoninas de proteínas diana para desencadear procesos celulares.
Os protooncoxenes son xenes cuxa presenza ou activación a oncoxenes pode estimular o desenvolvemento de cáncer. Cando se activan esaxeradamente nas células normais provocan que estas perdan o control da división e se manteñan proliferando sen control.
As ciclinas son un grupo heteroxéneo de proteínas cunha masa de 36 a 87 kDa. Distínguense segundo o momento do ciclo no que actúan.[3] As ciclinas son proteínas de vida moi curta: tras disociarse das súas quinases asociadas, degrádanse con extrema rapidez.
As quinases dependentes de ciclina (CDK) son moléculas de peso molecular medio que presentan unha estrutura proteica característica, consistente en dous lóbulos entre os cales está o centro catalítico, onde se insire o ATP (que será o doador de grupos fosfato).[10] Na canle de entrada ao centro catalítico ou activo do encima existe unha treonina que debe estar fosforilada para que a quinase actúe. Non obstante, no propio centro hai dúas treoninas que, ao seren fosforiladas, inhiben á quinase e unha rexión de unión á ciclina chamada PSTAIRE.[5] Existe unha terceira rexión nas CDK, afastada do centro catalítico, á que se une a proteína CKS, que regula a actividade quinase da CDK.
| Vertebrados | Vertebrados | Lévedos | Lévedos | |
| Complexo Cdk/ciclina | Ciclina | Cdk asociada | Ciclina | Cdk asociada |
| Cdk-G1 | ciclina D | Cdk 4,6 | Cln3 | Cdk1 |
| Cdk-G1/S | ciclina E | Cdk2 | Cln1,2 | Cdk1 |
| Cdk-S | ciclina A | Cdk2 | Clb5,6 | Cdk1 |
| Cdk-M | ciclina B | Cdk1 | Clb1,2,3,4 | Cdk1 |
Regulación dos complexos ciclina/CDK
editarExisten multitude de proteínas que modulan a actividade do complexo ciclina/CDK.[5] Sábese que o complexo ciclina A/CDK2 activa a proteína CAK, quinase activadora de CDK, e a proteína CAK fosforila a CDK, activándoa. Polo contrario, a fosfatase PP2a desfosforila a CDK, inactivándoa. Á súa vez, coñécense outros complexos inhibidores CKI como a p27 e p21 que se unen á ciclina e á CDK ao mesmo tempo bloqueando o sitio activo.
As ligases de ubiquitina causan a ubiquitinación das ciclinas, o que as marca para a súa degradación no proteasoma e, por tanto, destrúe a funcionalidade do complexo coa CDK. Un encima ligase de ubiquitina implicado neste proceso de regulación do ciclo celular é o complexo SCF, que actúa sobre as ciclinas G1/S. Outro complexo denominado APC (do inglés anaphase promoting complex) actúa sobre ciclinas M.[3]
- Ciclinas G1 e G1/S: Durante o período G1, a proteína Rb (retinoblastoma) está unida á proteína E2F, que á súa vez está unida á rexión do ADN promotora dos xenes necesarios para a entrada en S. Ao acumulárense as ciclinas de G1, os complexos ciclina G1/CDK fosforilan a Rb, que se inactiva e deixa de inactivar a E2F. A actividade de E2F permite a transcrición de xenes para a fase S. Fórmanse entón complexos ciclina G1S/CDK e ciclina S/CDK, que inactivan máis unidades de Rb, favorecendo aínda máis a actividade de E2F.
- Ciclinas S: O complexo ciclina S/CDK promove a actividade da ADN polimerase e doutras proteínas da replicación. O complexo multiproteico ORC (do inglés origin recognition complex) está asociado á orixe de replicación do ADN. No período G1 forma o complexo prerreplicativo ao se asociar á proteína CDC6 e ao anel proteico MCM. As MCM actúan como helicases promovendo a replicación. O complexo ciclina S/CDK tamén fosforila a CDC6, deixándoa accesible para a ubiquitinación por SCF. Así evita unha nova replicación.
- Ciclinas M: O complexo ciclina M/CDK activado por CAK está presente en todo o ciclo, pero está inhibido pola quinase WEE1, que a fosforila. Ao final do período G2 a fosfatase CDC25 desfosforila a CDK e activa o complexo ciclina M/CDK. O complexo ciclina M/CDK fosforila varias proteínas durante a mitose, como son:
- proteína lamina nuclear ao final da profase para desestruturar a envoltura nuclear
- proteína condensina que condensa os cromosomas
- proteínas reguladoras do fuso mitótico
- complexo promotor da anafase (APC) que separa as cromátides irmás.
- O complexo CDC20/APC realiza a ubiquitinación das ciclinas M para saír da fase M.
- Xenes supresores de tumores: Os xenes supresores de tumores regulan negativamente o ciclo. Encárganse de que a mitose non continúe se se produciu unha alteración do proceso normal. Entre estes xenes, tamén chamados "de verificación", se encontran os que codifican:
- produtos que evitan mutacións de xenes reguladores do ciclo.
- proteínas que inactivan as CDK por fosforilación/desfosforilación (por exemplo quinase WEE1, fosfatase CDC25).
- proteínas CKI inhibidoras do ciclo (por exemplo, p53,[11] p21, p16).
- proteína Rb (proteína do retinoblastoma), cuxa alteración xénica recesiva causa o cáncer de retina que ten ese mesmo nome.
- proteínas que inducen a saída do ciclo cara a un estado celular diferenciado ou cara á apoptose (por exemplo, as proteínas Bad, Bax, Bak, receptor de ligando Fas).
- A verificación lévase a cabo nos puntos de control e asegura a fidelidade da replicación e segregación do xenoma. Algúns compoñentes, ademais de detectaren fallos, poden poñer en marcha a reparación.
O proceso de síntese e ensamblaxe de ciclinas/CDK está regulado por tres tipos de factores: mitóxenos, que estimulan a división celular; factores de crecemento (GFs), que producen un aumento de tamaño da célula ao estimularen a síntese proteica; e factores de supervivencia, que suprimen a apoptose.
Puntos de control
editarExisten uns puntos de control (checkpoints) no ciclo que aseguran a progresión sen fallos deste, avaliando o correcto avance de procesos críticos no ciclo, como son a replicación do ADN ou a segregación de cromosomas.[12] Estas vías de verificación presentan dúas características: son transitorias (desaparecen unha vez resolto o problema que as puxo en marcha), e poden caducar se o problema non se resolveu ao cabo dun tempo. Ditos puntos de control son:[3]
- Punto de control de ADN non replicado, colocado ao final de G1 antes de iniciar a fase S. Actúa inhibindo a Cdc25, o cal é un activador da Ciclina A/B Cdk1.
- Punto de control de ensamblaxe do fuso (punto de conrol da mitose), antes da anafase. Actívase unha proteína Mad2 que impide a degradación da segurina, o que impide a segregación das cromátides irmás ata que todas están unidas ao fuso. É este o punto de control da separación de cromosomas, ao final da mitose. En caso de que fose incorrecto, impediríase a degradación da ciclina B por parte do complexo promotor da anafase (APC).
- Punto de control do dano do ADN, en G1, S ou G2. O dano celular activa a p53, proteína que favorece a reparación do ADN, detén o ciclo promovendo a transcrición de p21, inhibidor de Cdk, e, no caso de que todo falle, estimula a apoptose.[11]
Ciclo celular e cáncer
editarCrese que moitos tumores son resultado dunha multitude de pasos, dos cales unha alteración mutaxénica non reparada do ADN podería ser o primeiro paso. As alteracións resultantes fan que as células inicien un proceso de proliferación descontrolada e invadan tecidos normais. O desenvolvemento dun tumor maligno require de moitas transformacións xenéticas. A alteración xenética progresa, reducindo cada vez máis a capacidade de resposta das células ao mecanismo normal regulador do ciclo.[9]
Os xenes que participan na carcinoxénese orixínanse pola transformación dos xenes normalmente implicados no control do ciclo celular, a reparación de danos no ADN e a adherencia entre células veciñas. Para que a célula se transforme en neoplásica requírense polo menos dúas mutacións: unha nun xene supresor de tumores e outra nun protooncoxene, que dea lugar, entón, a un oncoxene.
Ciclo celular en plantas
editarA diferenza do que ocorre en animais, nas plantas os programas de desenvolvemento suceden tras a embrioxénese. A proliferación e división celular nas plantas sucede só nos meristemas, zonas nas cales se producen abundantes divisións celulares que dan lugar á aparición de novos órganos. As follas e as flores derivan do meristema apical do talo e do meristema floral, respectivamente, entanto que o meristema radicular dá lugar á raíz. A regulación, por tanto, dos programas de desenvolvemento baséase en grande medida na expresión xénica particular dos meristemas e da pauta de división celular; en plantas non existe a migración celular como mecanismo de desenvolvemento. A interacción antagonística entre as hormonas auxina e citoquinina parece ser o mecanismo clave para o establecemento de identidades e pautas de proliferación durante a embrioxénese[13] e durante o desenvolvemento dos meristemas caulinar e radicular.[14]
O ciclo celular nas plantas comparte elementos comúns co de animais, mais tamén ten certas particularidades. As quinases dependentes de ciclina (CDK) regulan a maioría dos aspectos do ciclo celular. Deste modo, CDKA (un equivalente a PSTAIRE CDK de animais), intervén nas transicións G1/S e G2/M. Non obstante, existen unhas CDKB, únicas de plantas, que se acumulan nas fases G2 e M e interveñen na transición G2/M.
As plantas posúen unha diversidade maior de ciclinas cós animais. Arabidopsis thaliana contén como mínimo 32 ciclinas, quizais debido aos eventos de duplicación do seu xenoma (é tetraploide).[15] A expresión das diferentes ciclinas parece estar regulada por diversas fitohormonas.[16]
- Ciclinas D: regulan a transición G1/S
- Ciclinas A: interveñen no control das fases S e M
- Ciclinas B: iimplicadas nas transicións G2/M e no control dentro da fase M
- Ciclina H: parte da quinase activadora de CDKs.
Existe un complexo proteín ligase de ubiquitina semellante ao APC/C (o complexo promotor da anafase animal)[17] e algunhas ciclinas, como as de tipo B, posúen na súa estrutura secuencias de destrución mediadas por ubiquitina: é dicir, o proceso de proteólise é tamén unha peza chave na regulación do ciclo celular no mundo vexetal.
A fosforilación de complexos ciclina/CDK no extremo N-terminal do elemento CDK inhibe a actividade do complexo; a diferenza do que acontece en animais, onde esta modificación postranscripcional sucede en residuos Tyr ou Thr, en plantas só se dá nos Tyr. En animais, o encima que cataliza esta reacción é unha WEE1 quinase, e a fosfatase CDC25; en plantas existe un homólogo da WEE1, pero non da CDC25, que si se atopou en algas unicelulares.[18]
En canto ás proteínas inhibidoras dos complexos CDK/ciclina, describíronse elementos similares á familia Kip/Cip de mamíferos; concretamente, en plantas estes elementos inhibidores están modulados pola presenza de hormonas como a auxina ou o ácido abscísico.[19] Estes e outros fitorreguladores desempeñan un papel chave no mantemento da capacidade meristemática e outros caracteres do desenvolvemento, procesos que dependen da súa concentración nunha determinada zona e do programa de expresión xénica presente naquel lugar. Por exemplo, as áreas que expresan a proteína relacionada co transporte de auxinas PINFORMED1 posúen unha alta concentración desta fitohormona o que se traduce na localización especial do que será o primordio da futura folla; ao mesmo tempo, isto exclúe a expresión do xene SHOOTMERISTEMLESS, implicado no mantemento dun estado indiferenciado de células meristemáticas nai (de lenta división).[20]
A vía do retinoblastoma (vía RB/E2F/DP) non só se encontra en animais e plantas, senón que aparece tamén en flaxelados como Chlamydomonas.[21] Un homólogo do supresor de tumores humano, denominado RETINBLASTOMA RELATED1, descrito en Arabidopsis thaliana, regula a proliferación celular nos meristemas, e está regulado por medio de fosforilación por parte de quinases dependentes de ciclina.[22]
Unha característica das células vexetais é a súa permisibilidade fronte a duplicacións da súa dotación cromosómica (cambios de ploidía), as cales se deben á replicación do contido xenético sen que medie unha citocinese. Este mecanismo é usual en determinados tecidos e organismos pero tamén pode suceder en plantas completas. Debido a que adoita ir asociado a un maior tamaño celular, foi obxecto de selección na mellora vexetal. Este feito explícase debido ao carácter sésil dos organismos vexetais e, xa que logo, a imposibilidade de executar comportamentos que eviten o estrés ambiental; deste xeito, as plantas estresadas cun maior número de copias do xenoma poderían ser máis resistentes. Porén, os datos experimentais non sempre apoian esta hipótese.[23]
Inhibidores do ciclo celular
editarExisten dúas familias de xenes que impiden a progresión do ciclo celular, que son a familia cip/kip (CDK interacting protein/Kinase inhibitory protein) e a INK4a/ARF (Inhibitor of Kinase 4/Alternative Reading Frame). Como estes xenes son importantes na prevención de tumores, coñécense como supresores de tumores.
A familia cip/kip inclúe os xenes p21, p27 e p57, que deteñen o ciclo celular na fase G1 ao orixinaren produtos que se unen e inactivan os complexos ciclina-CDK. p21 é activado por p53 (o cal, á súa vez, actívase cando hai danos no ADN, por exemplo debido a radiación). p27 é activado polo factor TGF β, un inhibidor do crecemento.
A familia INK4a/ARF inclúe p16INK4a, cuxo produto se une a CDK4 e para o ciclo na fase G1, e p14arf, que impide a degradación de p53.
Tamén son útiles para parar o ciclo os inhibidores sintéticos de Cdc25 e poderían usarse como axentes antineoplásicos e anticanceríxenos.[24]
Sincronización de cultivos celulares
editarPoden usarse varios métodos para sincronizar os cultivos celulares detendo o ciclo celular nunha fase determinada. Por exemplo, a inanición sérica (ou serum starvation, que é unha privación de nutrientes)[25] e o tratamento con timidina ou afidicolina[26] paran o ciclo celular na fase G1, o mitotic shake-off, o tratamento con colchicina[27] e o tratamento con nocodazole[28] paran o ciclo na fase M, e o tratamento con 5-fluorodesoxiuridina detén o ciclo na fase S.
Notas
editar- ↑ Cooper GM (2000). "Chapter 14: The Eukaryotic Cell Cycle". The cell: a molecular approach (2ª ed.). Washington, D.C: ASM Press. ISBN 0-87893-106-6.[1]
- ↑ Tavassoli (1980). The cell theory: a foundation to the edifice of biology. American Journal of Patholology January; 98(1): 44.[2]
- ↑ 3,0 3,1 3,2 3,3 3,4 3,5 3,6 3,7 Lodish, Harvey; et al. (2005). Biología celular y molecular. Buenos Aires: Médica Panamericana. ISBN 9789500613743.
- ↑ Paniagua, R.; Nistal, M.; Sesma, P.; Álvarez-Uría, M.; Fraile, B.; Anadón, R. y José Sáez, F. (2002). Citología e histología vegetal y animal. McGraw-Hill Interamericana de España, S.A.U. ISBN 84-486-0436-9.
- ↑ 5,0 5,1 5,2 Alberts; et al. (2004). Biología molecular de la célula. Barcelona: Omega. ISBN 978-84-282-1507-7.
- ↑ "Tim Hunt". NobelPrize.org (en inglés). Consultado o 2020-05-03.
- ↑ L. H. Hartwell Twenty-Five Years of Cell Cycle Genetics Genetics, 1991
- ↑ Graña X, Reddy EP. Cell cycle control in mammalian cells: role of cyclins, cyclin dependent kinases (CDKs), growth suppressor genes and cyclin-dependent kinase inhibitors (CKIs). Oncogene. 1995 Jul 20;11(2):211-9.
- ↑ 9,0 9,1 Bartek J., Lukas J., Bartkova J. (1999). Perspective: Defects in cell cycle control and cancer. Journal of pathology 187. pp. 95–99. doi:10.1002/(SICI)1096-9896(199901)187:1<95::AID-PATH249>3.0.CO;2-#. Arquivado dende o orixinal o 21 de novembro de 2018. Consultado o 26 de xuño de 2011.[3] Arquivado 24 de abril de 2010 en Wayback Machine.
- ↑ Mathews, C. K.; et al. (2003). "6". Bioquímica (en castelán). José Manuel González de Buitrago, tr. (3 ed.). Addison-Wesley. pp. 204 e ss. ISBN 9788478290536.
- ↑ 11,0 11,1 Soussi T., Legros Y., Lubin R., Ory K., Schlichtholz B. (1994). Multifactorial analysis of p53 alteration in human cancer: a review. Int J Cancer 57. pp. 1–9. doi:10.1002/ijc.2910570102.
- ↑ Stephen J. Elledge Cell Cycle Checkpoints: Preventing an Identity Crisis Science 6 December 1996: Vol. 274. no. 5293, pp. 1664 - 1672; DOI: 10.1126/science.274.5293.1664
- ↑ Bruno, Sheen Jen (2008). Cytokinin and auxin interaction in root stem-cell specification during early embryogenesis. Nature 453. p. 1094. doi:10.1038/nature06943.[4]
- ↑ Dinneny J.R., Benfey P.N. (2008). Plant Stem Cell Niches: Standing the Test of Time. Cell 132. pp. 553–557. doi:10.1016/j.cell.2008.02.001.[5]
- ↑ Simillion Cedric, Vandepoele Klaas, Van Montagu Marc C. E., Zabeau Marc, Van De Peer Yves (2002). The hidden duplication past of Arabidopsisthaliana (w). Proceedings of the National Academy of Sciences of the United States of America 99. p. 13627. PMID 12374856. doi:10.1073/pnas.212522399.[6]
- ↑ Stals H., Inzé D. (2001). When plant cells decide to divide (PDF). Trends in Plant Science 6. p. 359–364. doi:10.1016/S1360-1385(01)02016-7. Arquivado dende o orixinal (w) o 17 de setembro de 2004. Consultado o 26 de xuño de 2011.
- ↑ Criqui M.C., Parmentier Y., Derevier A., Shen W.H., Dong A., Genschik P. (2000). Cell cycle-dependent proteolysis and ectopic overexpression of cyclin B1 in tobacco BY2 cells. The Plant Journal 24. pp. 763–773. doi:10.1111/j.1365-313X.2000.t01-1-.x.
- ↑ Khadaroo B., Robbens S., Ferraz C., Derelle E., Eychenie S., Cooke R., Peaucellier G., Delseny M., Demaille J., Van De Peer Y., Others (2004). The first green lineage cdc25 dual-specificity phosphatase (w). Cell Cycle 3. pp. 513–8.[7]
- ↑ De Veylder, Lieven; Beeckman, Tom; Beemster, Gerrit T.S.; Krols, Luc; Terras, Franky; Landrieu, Isabelle; Van Der Schueren, Els; Maes, Sara; Naudts, Mirande (2001-07). "Functional Analysis of Cyclin-Dependent Kinase Inhibitors of Arabidopsis". The Plant Cell (en inglés) 13 (7): 1653–1668. ISSN 1040-4651. PMC 139548. PMID 11449057. doi:10.1105/TPC.010087.
- ↑ Heisler M.G., Ohno C., Das P., Sieber P., Reddy G.V., Long J.A., Meyerowitz E.M. (2005). Patterns of Auxin Transport and Gene Expression during Primordium Development Revealed by Live … (PDF). Current Biology 15. pp. 1899–1911. doi:10.1016/j.cub.2005.09.052. Arquivado dende o orixinal (PDF) o 09 de setembro de 2006. Consultado o 26 de xuño de 2011.
- ↑ Umen J.G., Goodenough U.W. (2001). Control of cell division by a retinoblastoma protein homolog in Chlamydomonas (w). Genes & Development 15. pp. 1652–1661. doi:10.1101/gad.892101.[8]
- ↑ Dewitte Walter, Scofield Simon, Alcasabas Annette A., Maughan Spencer C., Menges Margit, Braun Nils, Collins Carl, Nieuwland Jeroen, Prinsen Els, Sundaresan Venkatesan, Murray James A. H. (2007). Arabidopsis CYCD3 D-type cyclins link cell proliferation and endocycles and are rate-limiting for cytokinin responses (w). Proceedings of the National Academy of Sciences 104. p. 14537. PMID 17726100. doi:10.1073/pnas.0704166104.[9]
- ↑ Leiva-Neto, João T.; Grafi, Gideon; Sabelli, Paolo A.; Dante, Ricardo A.; Woo, Young-min; Maddock, Sheila; Gordon-Kamm, William J.; Larkins, Brian A. (2004-07). "A Dominant Negative Mutant of Cyclin-Dependent Kinase A Reduces Endoreduplication but Not Cell Size or Gene Expression in Maize Endosperm". The Plant Cell (en inglés) 16 (7): 1854–1869. ISSN 1040-4651. PMC 514166. PMID 15208390. doi:10.1105/tpc.022178.
- ↑ "Presentation on CDC25 PHOSPHATASES: A Potential Target for Novel Anticancer Agents". Arquivado dende o orixinal o 03 de marzo de 2016. Consultado o 27 de xuño de 2011.
- ↑ Kues WA, Anger M, Carnwath JW, Paul D, Motlik J, Niemann H (2000). "Cell cycle synchronization of porcine fetal fibroblasts: effects of serum deprivation and reversible cell cycle inhibitors". Biol. Reprod. 62 (2): 412–9. PMID 10642581. doi:10.1095/biolreprod62.2.412.
- ↑ Pedrali-Noy G, Spadari S, Miller-Faurès A, Miller AO, Kruppa J, Koch G (1980). "Synchronization of HeLa cell cultures by inhibition of DNA polymerase alpha with aphidicolin". Nucleic Acids Res. 8 (2): 377–87. PMC 327273. PMID 6775308. doi:10.1093/nar/8.2.377.
- ↑ Prather RS, Boquest AC, Day BN (1999). "Cell cycle analysis of cultured porcine mammary cells". Cloning 1 (1): 17–24. PMID 16218827. doi:10.1089/15204559950020067.
- ↑ Samaké S, Smith LC (1997). "Synchronization of cell division in eight-cell bovine embryos produced in vitro: effects of aphidicolin". Theriogenology 48 (6): 969–76. PMID 16728186. doi:10.1016/S0093-691X(97)00323-3.
Véxase tamén
editarOutros artigos
editarBibliografía
editar- Lodish; et al. (2005). Biología celular y molecular (en castelán). Buenos Aires: Médica Panamericana. ISBN 9789500613743.
- Alberts; et al. (2004). Biología molecular de la célula (en castelán). Barcelona: Omega. ISBN 978-84-282-1507-7.