Treonina
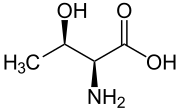
A treonina (abreviadamente Thr ou T)[2] é un α-aminoácido que forma parte das proteínas coa fórmula HO2CCH(NH2)CH(OH)CH3. A súa cadea lateral leva un grupo OH alcohólico, polo que se clasifica como aminoácido polar. Os outros únicos aminoácidos con OH na cadea lateral son a serina (alcohol) e a tirosina (fenol). Xunto coa isoleucina presenta quiralidade na súa cadea lateral, porque o OH pode ter dúas orientacións.
| Treonina | |
|---|---|
 | |
 | |
Treonina | |
Outros nomes Ácido 2-amino-3-hidroxibutanoico | |
| Identificadores | |
| Número CAS | 80-68-2, 72-19-5 (L-isomer) |
| PubChem | 6288 |
| ChemSpider | 6051 |
| Número CE | 201-300-6 |
| DrugBank | DB00156 |
| ChEBI | CHEBI:57926 |
| ChEMBL | CHEMBL291747 |
| Imaxes 3D Jmol | Image 1 |
| |
| |
| Propiedades | |
| Fórmula molecular | C4H9NO3 |
| Masa molar | 119,12 g mol−1 |
| Solubilidade en auga | (H2O, g/dl) 10,6(30°), 14,1(52°), 19,0(61°) |
| Acidez (pKa) | 2,63 (carboxilo), 10,43 (amino)[1] |
Se non se indica outra cousa, os datos están tomados en condicións estándar de 25 °C e 100 kPa. | |

Os seus codóns son ACU, ACA, ACC, e ACG. É un aminoácido esencial, polo que non pode sintetizarse no noso metabolismo e debe estar incluído na composición dos nosos alimentos.
Os residuos de treonina son susceptibles de numerosas modificacións postraducionais. O grupo hidroxilo da súa cadea lateral pode sufrir O-glicosilación. Ademais, pode sufrir fosforilación pola acción de treonina quinases, e na súa forma fosforilada denomínase fosfotreonina.
Foi o último dos 20 aminoácidos proteicos comúns en ser descuberto, na década de 1930 por William Cumming Rose.
Estereoisómeros
editar| |
| L-Treonina (2S,3R) e D-Treonina (2R,3S) |
| |
| L-allo-Treonina (2S,3S) e D-allo-Treonina (2R,3R) |
A treonina, xunto coa isoleucina, ten dous centros quirais na súa molécula, un no carbono alfa e outro na cadea lateral. A treonina pode presentarse en forma de catro posibles estereoisómeros coas seguintes configuracións: (2S,3R), (2R,3S), (2S,3S) e (2R,3R). Porén, o nome L-treonina úsase para o enantiómero ácido (2S,3R)-2-amino-3-hidroxibutanoico. O segundo estereoisómero (2S,3S), que raramente aparece na natureza, denomínase L-allo-treonina. Os dous estereoisómeros restantes, ácidos (2R,3S)- e (2R,3R)-2-amino-3-hidroxibutanoico teñen escasa importancia.
Biosíntese
editarComo é un aminoácido esencial, os humanos non podemos sintetizar treonina; por tanto, debe ser inxerida como parte das proteínas dos alimentos. Nas plantas e microorganismos a treonina sintetízase a partir do ácido aspártico vía α-aspartil-semialdehido e homoserina. A homoserina sofre unha O-fosforilación; este éster fosfórico sofre despois hidrólise e unha recolocación do seu grupo OH.[3] Os encimas implicados nunha biosíntese típica de treonina son:
- aspartoquinase
- ß-aspartato semialdehide deshidroxenase
- homoserina deshidroxenase
- homoserina quinase
- treonina sintase.
Metabolismo
editarA treonina metabolízase de dúas maneiras:
- Covértese en piruvato por acción da treonina deshidroxenase. Un intermediato desta vía pode sufrir tiólise co coencima A (CoA) e producir acetil-CoA e glicina. Esta produción de acetil-CoA fai que poida considerarse un aminoácido cetoxénico (tamén é glicoxénico).
- Nos humanos convértese en alfa-cetobutirato seguindo unha vía pouco común na que intervén a serina deshidratase, e dese modo entra na vía que orixina succinil-CoA, polo que no metabolismo humano é un aminoácido glicoxénico.
Fontes
editarAlimentos ricos en treonina son: queixo fresco, aves, peixe, carne, lentellas, e sementes de sésamo.
A treonina racémica pode obterse do ácido crotónico por alfa-funcionalización usando acetato de mercurio (II).[4]
Notas
editar- ↑ Dawson, R.M.C., et al., Data for Biochemical Research, Oxford, Clarendon Press, 1959.
- ↑ "Nomenclature and symbolism for amino acids and peptides (IUPAC-IUB Recommendations 1983)", Pure Appl. Chem. 56 (5): 595–624, 1984, doi:10.1351/pac198456050595. [1]
- ↑ Lehninger (2008). Principles of Biochemistry 3rd..
- ↑ Carter Herbert E.; West, Harold D. (1940). "dl-Threonine". OrgSynth 20 (3): 101. cv3p0813..