Éster
En química, os ésteres son compostos orgánicos derivados da reacción dun ácido osixenado orgánico ou inorgánico cun grupo OH (hidroxilo) doutra substancia, que pode ser un alcohol ou un fenol[1]. Nos ésteres un grupo alquilo (simbolizado por R' e procedente do alcohol) substitúe a un átomo de hidróxeno do ácido osixenado. Etimoloxicamente, a palabra éster provén da voz do idioma alemán Essig-Äther (éter de vinagre), como se chamaba antigamente ao acetato de etilo, e o termo foi acuñado en química polo alemán Leopold Gmelin[2].

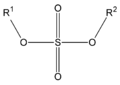
Nos ésteres máis comúns o ácido en cuestión é un ácido carboxílico (co grupo -COOH). Por exemplo, se o ácido é o ácido acético, o éster denomínase acetato. Os ésteres tamén se poden formar con ácidos inorgánicos, como o ácido carbónico (orixina ésteres carbónicos), o ácido fosfórico (ésteres fosfóricos) ou o ácido sulfúrico. Por exemplo, o sulfato de dimetilo é un éster, ás veces chamado "éster dimetílico do ácido sulfúrico".
| Éster (éster de ácido carboxílico) |
Éster carbónico (éster de ácido carbónico) |
Éster fosfórico (triéster de ácido fosfórico) |
Éster sulfúrico (diéster de ácido sulfúrico) |
|---|---|---|---|

|

|

|
|
Un ensaio moi usado para detectar ésteres é a formación de hidroxamatos férricos, doados de recoñecer xa que son moi coloreados: Ensaio do ácido hidroxámico: a primeira fase da reacción é a conversión do éster nun ácido hidroxámico (catalizado por base). No seguinte paso este reacciona con cloruro férrico producindo un hidroxamato de intensa cor vermella-violeta.
Enlace éster. Os ésteres son moi importantes, xa que o fosfato dos ácidos nucleicos está unido por enlace éster. Tamén as graxas do tecido adiposo (triacilglicéridos) e outros lípidos conteñen enlace éster. Moitos aromas naturais son ésteres. A nitroglicerina é un éster de nitrato. O poliéster é un plástico formado por monómeros unidos por enlace éster.
Esterificación en química orgánica
editarA síntese clásica é a esterificación de Fischer, que consiste en tratar un ácido carboxílico cun alcohol en presenza dun axente deshidratante:
En bioquímica é frecuente que os ésteres sexan o produto da reacción entre un ácido graxo e un alcohol. Na formación destes ésteres, o grupo OH (hidroxilo) do alcohol reacciona co grupo -COOH (carboxilo) do ácido graxo, quedando ambos enlazados formando o éster e liberándose unha molécula de auga. Esta reacción denomínase esterificación. Os ésteres máis comunmente atopados na natureza son as graxas, que son ésteres de glicerina e ácidos graxos. A glicerina é un alcohol con tres grupos -OH, polo que se están todos esterificados con ácidos graxos, orixínase un triacilglicérido.
En química orgánica e bioquímica os ésteres son un grupo funcional composto dun radical orgánico unido ao residuo de calquera ácido osixenado, orgánico ou inorgánico.
Un éster cíclico chámase lactona tanto se procede dun ácido orgánico coma inorgánico.
Nomenclatura
editarA nomenclatura dos ésteres deriva dos nomes do ácido carboxílico e do alcohol dos que procede. Así, no etanoato (acetato) de metilo encontramos dúas partes no seu nome:
- A primeira parte do nome, etanoato (acetato), provén do ácido etanoico (acético)
- A outra metade, de metilo, provén do alcohol metílico (metanol).
No debuxo da dereita observamos a parte que procede do ácido (en vermello; etanoato) e a parte que procede do alcohol (en azul, de etilo).
O nome xeral dun éster de ácido carboxílico será "alcanoato de alquilo", onde:
- alcan-: Raíz da cadea carbonada principal (se é un alcano), que se nomea a partir do número de átomos de carbono. Exemplo: Propan- significa cadea de 3 átomos de carbono unidos por enlaces sinxelos.
- oato: Sufixo que indica que é derivado dun ácido carboxílico. Exemplo: propanoato: CH3-CH2-CO- significa "derivado do ácido propanoico".
- de alquilo: Indica o alcohol de procedencia. Por exemplo: -O-CH2-CH3 é "de etilo"
En conxunto CH3-CH2-CO-O-CH2-CH3 noméase propanoato de etilo.
Propiedades físicas
editarOs ésteres poden participar nos enlaces de hidróxeno como aceptores, pero non poden participar como dadores neste tipo de enlaces, a diferenza dos alcohois dos que derivan. Esta capacidade de participaren nos enlaces de hidróxeno fainos máis hidrosolubles cós hidrocarburos dos que derivan. Pero as limitaciones dos seus enlaces de hidróxeno fainos máis hidrofóbicos cós alcohois ou ácidos dos que derivan. Esta falta de capacidade de actuar como dador de enlace de hidróxeno orixina que non se poidan formar enlaces de hidróxeno entre moléculas de ésteres, o que os fai máis volátiles ca un ácido ou alcohol de similar peso molecular[3].
Moitos ésteres teñen un aroma característico, o que fai que se utilicen amplamente como sabores e arrecendos artificiais. Por exemplo:
- Acetato de 2 Etil Hexilo: cheiro doce suave.
- butanoato de metilo: olor a piña.
- salicilato de metilo (aceite de menta): olor dalgunhas pomadas.
- octanoato de heptilo: olor a framboesa.
- etanoato de isopentilo: olor a plátano.
- pentanoato de pentilo: olor a mazá.
- butanoato de pentilo: olor a pera ou a albaricoque.
- etanoato de octilo: olor a laranxa.
Os ésteres tamén participan na hidrólise esterárica ou rotura dun éster pola auga. Os ésteres tamén poden ser descompostos por ácidos ou bases fortes. Como resultado, descompóñense nun alcohol e un ácido carboxílico, ou un sal dun ácido carboxílico:
Propiedades químicas
editarNas reaccións dos ésteres, a cadea rompe sempre nun enlace sinxelo, que se establecera entre o osíxeno e o alcohol ou R, ou ben entre o osíxeno e o grupo R-CO-, liberando así o alcohol ou un dos seus derivados. A saponificación dos ésteres, chamada así pola súa analoxía coa formación de xabóns, é a reacción inversa á esterificación: Os ésteres hidroxénanse máis doadamente cós ácidos, empregándose xeralmente o éster etílico tratado cunha mestura de sodio e alcohol, e condensan entre si en presenza de sodio e coas cetonas
Notas
editar- ↑ IUPAC Compendium of Chemical Terminology - The Gold Book 2nd edition (1997). esters.[1]
- ↑ Leopold Gmelin, Handbuch der Chemie, vol. 4: Handbuch der organischen Chemie (vol. 1) (Heidelberg, Baden (Germany): Karl Winter, 1848), page 182.
- ↑ March, J. “Advanced Organic Chemistry” 4th Ed. J. Wiley and Sons, 1992: New York. ISBN 0-471-60180-2.
Véxase tamén
editarOutros artigos
editarLigazóns externas
editar- Nomenclatura de ésteres. Arquivado 21 de novembro de 2011 en Wayback Machine. Academia Minas.