Aminoácido
Un aminoácido é unha molécula orgánica difuncional, contén simultaneamente grupos funcionais amino (-NH2) e ácido carboxílico (-COOH), e diferéncianse entre si grazas á cadea lateral (R) específica para cada aminoácido. Os elementos básicos que os conforman son carbono (C), hidróxeno (H), osíxeno (O) e nitróxeno (N), mais pódense atopar outros elementos como o xofre (S) nas cadeas lateriais. Os aminoácidos clasifícanse en grandes grupos en función das posicións relativas entre os grupos amino e ácido, sendo alpha- (α-), beta- (β-), gamma- (γ-) ou delta- (δ-), mais dado que os α-aminoácidos son os proteinoxénicos, en bioquímica, o termo aminoácido úsase como termo curto e xeral para referirnos a estes.
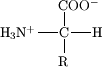
Os aminoácidos proteinoxénicos son aqueles que unidos entre si en cadea por medio de enlaces peptídicos forman as proteínas, estes caracterízanse por teren na maioría estereoquímica S, agás a cisteína que ten R[1].
Estrutura
editarNa estrutura amosada ao inicio da páxina, R representa unha cadea lateral específica a cada aminoácido, a cal que lle confire certas propiedades químicas. O carbono inmediatamente seguinte ao grupo carboxílico, recibe o nome de carbono alpha e os aminoácidos que teñen o grupo amino nese mesmo carbono reciben o nome de alpha-aminoácidos.[2]
Propiedades ópticas
editarOs aminoácidos máis comúns na natureza son os α-aminoácidos e á súa vez os isómeros L. Nestes compostos, o carbono alpha é quiral (salvo se o grupo R é un H coma no caso da glicina), o que implica a coexistencia de dous isómeros ópticos (enantiómeros), L e D aminoácidos, as cales son imaxes especulares unha da outra. Nos aminoácidos proteinoxénicos, a configuración óptica maioritaria é a S, mais a cisteína sitúase como excepción, posuíndo a contraria, a R[1].
Nos aminoácidos con cadea ramificada, a propia cadea pode presentar á súa vez rotación óptica, como no caso da Treonina e da Isoleucina.
Cadea lateral
editarNos α-aminoácidos, as cadeas laterais sitúanse no carbono alpha.
As cadeas axudan á súa clasificación pois confírenlles propiedades físico-químicas que permiten establecer subgrupos. A cadea lateral pode converter un aminoácido nun ácido ou base débil, se presenta grupos de ácido carboxílico ou amino respectivamente; ou en hidrófobo se a cadea é apolar (cadeas hidrocarbonadas e aromáticas) ou hidrófilo se é polar (cadeas con grupos polares como un tiol, alcol, ácido ou amino).
Punto isoeléctrico
editarO punto isoeléctrico dun aminoácido é o pH no cal a suma de cargas dun aminoácido é neutra, ou doutra forma, é o pH no cal a especie maioritaria é a forma zwitteriónica. En estado sólido, a forma na que se presentar é en forma de sal interna (zwitterión), presentando altos puntos de fusión e ebulición e insolubilidade en auga.
Presenza e organización
editarOs aminoácidos alfa (preto de vinte) son constituíntes de todas as proteínas e péptidos e, polo tanto, de toda a materia viva. Estes son monómenos e como monómeros pódense unir mediante enlaces peptídicos formando unidades variantes en tamaño: dímeros (dipéptido, dous péptidos), trímeros e así sucesivamente. Cada aminoácido que forma un polímero é denominado residuo. Para que unha agrupación de aminoácidos sexa considerada unha proteína, algúns autores apuntan a que deben de haber mínimo 70 aminoácidos unidos.
Obtención e síntese
editarSíntese de α-aminoácidos
editarOs aminoácidos son sintetizados naturalmente por animais e plantas mediante enzimas especializados. No sistemas vivos, en función da capacidade, ou non, de sintetizar os aminoácidos de forma natural, podémolos englobar en dous grandes grupos:
- Aminoácidos non esenciais son aqueles que, a partir do alimento inxerido, o organismo dun animal consegue sintetizar.
- Aminoácidos esenciais ou indispensables son aqueles que o organismo animal non consegue sintetizar (mais poden ser sintetizados por outro animal ou por un vexetal). Os aminoácidos esenciais deben formar parte da dieta alimentaria deste animal, para evitar a desnutrición. Os aminoácidos esenciais para unha especie animal poden non selo para outra especie.
Por outra banda, estes tamén poden ser sintetizados no laboratorio mediante técnicas de síntese orgánica. Existen diversos métodos sintéticos como a aplicación da reacción de Hell-Volhard-Zelinsky, a síntese de Gabriel ou a de Strecker[1], mais todas coinciden no mesmo problema, a obtención de mesturas enantioméricas. Este problema solvéntanse aplicando á mesturas técnicas de resolución enantiomérica: reaccións químicas específicas, aplicación de enzimas naturais, catalizadores químicos selectivos, cromatografía quiral...
Obtención
editarA parte da síntese dos mesmos, pódense obter mediante a fragmentación das proteínas, moléculas formadas por ata millares de aminoácidos unidos por enlaces peptídicos (entre o grupo carboxilo dun aminoácido e o grupo amino doutro). Esas ligazóns poden ser quebradas por hidrólise producindo unha mestura complexa de aminoácidos. Este proceso actualmente lévase a cabo de forma automatizada mais existen métodos químicos manuais como pode ser o método de Edmann[1].
Outros aminoácidos
editar- Aminoácidos beta
- Ácido β-aminopropiónico (β-alanina): aminoácido natural compoñente do ácido pantoténico (unha vitamina do grupo B).
- Aminoácidos omega
- Ácido ω-aminocaproico: aminoácido sintético usado na fabricación de fibras sintéticas e de plásticos.
- "Aminoácidos" nocivos
- Son moléculas estruturalmente semellantes a algúns dos aminoácidos esenciais e non esenciais citados máis enriba, producidos por plantas da familia Fabaceae. Eses aminoácidos son absorbidos no acto da inxestión de follas destas plantas, e son asimilados polo corpo, entrando na constitución de proteínas. As proteínas con estes aminoácidos teñen a súa función comprometida, o que pode causar serios danos ao organismo.
Determinación
editar- Os aminoácidos reaccionan co ácido nitroso producindo nitróxeno e un hidroxiácido. A aplicación desta reacción é a determinación da concentración de aminoácidos no sangue, medíndose o volume de nitróxeno producido (método de Slyke). Na putrefación dos organismos, certas enzimas reducen os aminoácidos a poliaminas, como a putrescina e a cadaverina.
Véxase tamén
editarOutros artigos
editarLigazóns externas
editar- ↑ 1,0 1,1 1,2 1,3 Vollhardt, Peter (2006). Química Orgánicaa- Estructura y Función. Omega. ISBN 842821431X.
- ↑ Bertran Prieto, Pol. "Los aminoácidos (esenciales y no esenciales): características y funciones". MédicoPlus. Consultado o 28 de xuño de 2020.