Macrófago
Os macrófagos (do grego makros "grande" + fagein "comer") son células orixinadas pola diferenciación dos monocitos sanguíneos nos tecidos. Os macrófagos son fagocitos duns 21 microns de diámetro.[1] Interveñen na defensa inmunitaria inespecífica ou innata e colaboran no inicio dos mecanismos de defensa específicos ou adaptativos nos animais vertebrados. O seu papel é realizar a fagocitose (englobar e dixerir) restos celulares e patóxenos, xa sexa como células estacionarias nos tecidos ou como células móbiles, que se desprazan por movemento ameboide. Tamén estimulan aos linfocitos e a outras células inmunes para que respondan aos patóxenos, funcionando como células presentadoras de antíxenos. Son células fagocíticas especializadas que atacan ás substancias estrañas, microbios infecciosos e mesmo a células cancerosas, inxeríndoas e destruíndoas.
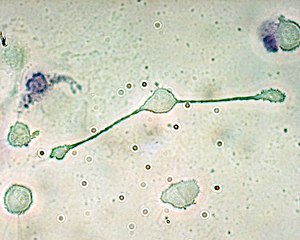

Os macrófagos poden identificarse pola expresión específica de determinadas proteínas como CD14, CD11b, F4/80 (ratos)/EMR1 (humanos), lisozima M, MAC-1/MAC-3 e CD68 detectada por citometría de fluxo ou tinguidura inmunohistoquímica.[2].
Orixe
editarOs macrófagos proceden dos monocitos. Estes fórmanse na medula ósea a partir de células pluripotenciais da serie granulocítico-monocítica, estimulados polo factor estimulante das colonias de granulocitos-macrófagos (GM-CSF) e outras citocinas como a interleucina 3 (IL-3).
Cando estes factores de crecemento están presentes na medula ósea, a célula proxenitora prolifera e diferénciase en promonocito, célula que en divisións celulares posteriores producirá o monocito. A diferenciación celular da célula nai está asociada coa expresión de receptores de membrana para citocinas específicas. Os monocitos permanecen na medula ósea menos de 24 horas, despois pasan á circulación sanguínea e son distribuídos por todo o corpo. Nesta fase, vense ao microscopio nos frotis de sangre periférico como células de maior tamaño, cuxo diámetro varía entre 15 e 30 μm e posúen unha alta relación núcleo/citoplasma. En adultos sans normais, a vida media dun monocito circulante estímase en 70 horas e están nunha proporción do 1 ao 6% do total de leucocitos nun reconto normal en sangre periférico. Unha vez os monocitos saen dos capilares sanguíneos e se sitúan nos tecidos, transfórmanse en macrófagos. Esta diferenciación de monocito a macrófago afecta a gran cantidade de cambios como que a célula aumenta o seu tamaño de 5 a 10 veces, os seus orgánulos incrementan tanto o seu número como a súa complexidade, adquire capacidade fagocítica, produce altas concentracións de encimas líticas e empeza a secretar gran variedade de substancias solubles que realizan diferentes funcións. Os macrófagos son activados por gran variedade de estímulos durante a respuesta inmune. A fagocitose de antíxenos serve como estímulo inicial; porén, os macrófagos e a súa actividade poden aumentarse por citocinas secretadas por linfocitos T colaboradores e produtos bacterianos. Un dos máis potentes activadores de macrófagos é o interferón gamma.
Nalgunhas partes do corpo, como os testículos, observouse que os macrófagos proliferan no órgano por división. A diferenza dos neutrófilos (outros fagocitos), que teñen vida curta, os macrófagos poden vivir moito máis no corpo ata un máximo de varios meses.
Poboacións de macrófagos
editarActualmente, unha opinión moi compartida é que existen varias formas activadas de macrófagos.[3] A pesar das diferentes formas que hai de activar aos macrófagos, historicamente foron clasificados en dous grupos principais denominados M1 e M2. Os macrófagos M1 son células efectoras inmunitarias que son agresivas contra os microbios e poden fagocitar e dixerir as células moi rapidamente, e producen ademais moitas linfocinas.[4] A medida que se foron descubrindo varias novas formas de activación dos macrófagos, o tipo dos macrofagos M2 utilizouse para describir a todos os outros tipos, incluíndo os que funcionan na curación de feridas e na reparación de tecidos, e aqueles que desactivan a resposta inmunitaria producindo citocinas antiinflamatorias como a IL-10.
Funcións
editara. Inxestión por medio de fagocitose na que se forma un fagosoma
b. A fusión dos lisosomas co fagosoma orixina un fagolisosoma, no que o patóxeno é dixerido encimaticamente
c. O material residual é expulsado ou asimilado (isto último non se mostra na imaxe)
Partes:
1. Patóxenos
2. Fagosoma
3. Lisosomas
4. Material residual
5. Citoplasma
6. Membrana plasmática.
Os macrófagos están entre as principais células fagocíticas do corpo, interveñen na reacción inflamatoria, na presentación dos antíxenos aos linfocitos, na rexeneración de tecidos e na hemostasia.
Fagocitose
editar- Artigo principal: Fagocitose.
Unha importante función exercicda polos macrófagos é a eliminación de residuos celulares necróticos nos pulmóns. A eliminación do material das células mortas é importante nas inflamacións crónicas, xa que as fases iniciais da inflamación están dominados polos granulocitos neutrófilos, os cales son inxeridos polos macrófagos cando se fan vellos.
A eliminación do tecido necrótico é en gran medida realizado polos macrófagos residentes ou fixos, que están situados en sitios estratéxicos como os pulmóns, fígado, tecido nervioso, ósos, bazo e tecidos conectivos, e que inxiren os materiais estraños como os patóxenos, e recrutan a máis macrófagos se é preciso.
Cando un macrófago inxire un patóxeno, o patóxeno queda no interior dun fagosoma (vacúolo fagocítico), o cal despois se fusiona cun lisosoma. Isto orixina un fagolisosoma (ou lisosoma secundario ou vacúolo dixestivo), no que o patóxeno é destruído e dixerido por encimas e peróxidos tóxicos. Porén, algunhas bacterias, como Mycobacterium tuberculosis, desenvolveron unha resistencia a este proceso de dixestión. Os macrófagos poden dixerir máis de 100 bacterias antes de que finalmente morran debido aos compostos resultantes da dixestión.
Os macrófagos teñen a capacidade de quimiotaxe, é dicir, a de seren atraídos e desprazarse cara a unha determinada localización pola presenza de determinados factores quimiotácticos para monocitos como interleucina-I, trombina, factor de crecemento derivado das plaquetas, factor do complemento C5a, fragmentos de coláxeno, elastina, fibronectina, calicreína, activador do plasminóxeno, inmunoglobulinas e leucotrienos.
Inflamación
editarOs macrófagos forman parte da inmunidade celular innata (a inflamación), é dicir, inician unha resposta natural contra os microorganismos, porque os macrófagos expresan receptores de membrana para numerosas moléculas bacterianas, por exemplo: receptor para lipopolisacárido (CD14), receptores CD11b/CD18, receptores para manosas, e receptor para glícidos entre outros. Por tanto, os seus receptores que posúen unha especificidade a ligandos moi ampla como: lipoproteínas, proteínas, poli e oligonucleótidos, polisacáridos aniónicos, fosfolípidos e outras moléculas.
Presentación de antíxenos
editar- Artigo principal: Presentación de antíxenos.
conidios de forma cooperativa. As células J774 foron tratadas con 5 ng/mL de interferón-γ unha noite antes da gravación das imaxes. A observación fíxose nun período de 2,5 horas tomando unha imaxe cada 30s.
Os macrófagos son células versátiles que desempeñan moitas funcións ademais de funcionaren como limpadores que eliminan as células mortas e outros refugallos. Xunto coas células dendríticas, son as principais células que funcionan como célula presentadora do antíxeno. A "presentación" do antíxeno, é básica para iniciar a resposta inmunitaria. Ademais, como células secretoras, os monocitos e os macrófagos son vitais para a regulación das respostas inmunes e o desenvolvemento da inflamación; producen un amplo conxunto de substancias químicas potentes (monocinas ou monoquinas) como encimas, proteínas do sistema do complemento, e factores regulatorios como a interleucina-1. Ao mesmo tempo, levan na súa superficie receptores para linfocinas que lles permiten ser "activadas" como células dedicadas exclusivamente a perseguir microbios ou células tumorais.
Despois de dixerir un patóxeno, un macrófago debe presentar o antíxeno aos linfocitos Th. Os antíxenos son moléculas, xeralmente proteínas situadas na superficie dos patóxenos, que o sistema inmunitario utiliza para a súa identificación e que fan que se active a resposta inmunitaria. O macrófago dixire o antíxeno durante a fagocitose, fragmentándoo en cachos, que son os que serán presentados. Estes fragmentos de antíxeno son integrados na membrana plasmática do macrófago e mostrados na súa superficie unidos ás proteínas da membrana do complexo maior de histocompatibilidade de clase II (CMH ou en inglés e máis usado MHC), o que indica ás outras células que o macrófago non é un patóxeno a pesar de ter os antíxenos estraños sobe a súa superficie.
A presentación do antíxeno na superficie dos macrófagos unidos ao MHC de clase II nos ganglios linfáticos estimula os linfocitos TH1 (linfocitos T axudantes de tipo 1) a proliferar (principalmente debido á secreción de IL-12 por parte do macrófago). Estas células Th activan os demais linfocitos iniciando a resposta inmunitaria.
Cando os linfocitos B se activan, empezan a producir anticorpos que se unirán aos antíxenos do patóxeno, ou respostas celulares. A unión dos anticorpos cos antíxenos facilita que os patóxenos sexan fagocitados polos macrófagos, xa que estes teñen receptores para a porción Fc dos anticorpos, que facilitan a adhesión. Nalgúns casos, os patóxenos son moi resistentes á adhesión polos macrófagos.
Os macrófagos son responsables tamén doutra liña de defensa contra as células tumorais e células infectadas por fungos ou parasitos, que ten que ver tamén coa súa relación coas células T. Unha vez que a célula T recoñeceu o seu particular antíxeno na superficie de células aberrantes, a célula T actívase, e empeza a producir mediadores químicos coñecidos como linfocinas que estimulan aos macrófagos a ser máis agresivos.
Rexeneración muscular e doutros tecidos
editarCando comeza a utilizarse un músculo de forma potencialmente daniña, chegan a el sucesivamente dúas subpoboacións de macrófagos que van intevir na súa reparación. A primeira subpoboación chega cando se incrementa o uso dun músculo dabondo como para producir a lise da membrana muscular e inflamación, e é unha subpoboación fagocítica, que pode degradar os contidos das fibras musculares danadas.[5][6][7] Esta primeira invasión de macrófagos fagocíticos chega á súa máxima concentración arredor de 24 horas despois da aparición de danos no músculo ou sobrecarga,[8] pero a súa concentración declina rapidamente despois de 48 horas.[6]
O segundo grupo de macrófagos en chegar non é fagocítico, e distribúese preto das fibras rexenerativas. Chegan á súa máxima concentración entre dous e catro días despois e esta permanece elevada durante varios días mentres ten lugar a reconstrución muscular.[6] A primeira subpoboación non ten beneficio directo na reparación do músculo, pero a segunda si.
Pénsase que os macrófagos liberan substancias solubles que inflúen na proliferación, diferenciación, crecemento, reparación, e rexeneración do músculo, pero neste momento o factor liberado non se coñece.[8] Un estudo realizado en 2006 demostrou a influencia dos macrófagos na rexeneración muscular do músculo sóleo de ratos. A depleción da poboación de macrófagos facía que non se puidese rexenerar o músculo.[9]
A implicación dos macrófagos na reparación de tecidos non é específica do músculo; poden acumularse en numerosos tecidos durante a fase de curación que segue a un dano.[10]
Hemostasia
editarO macrófago intervén na hemostasia porque produce unha serie de substancias que participan na coagulación como son: proteína C, trombomodulina, factor tisular, factor VII, factor XIII e o inhibidor do activador do plasminóxeno.
Macrófagos dos tecidos
editarA maioría dos macrófagos están estacionados nos tecidos nos puntos estratéxicos nos que é probable que ocorra unha invasión microbiana ou acumulación de po. Este conxunto de macrófagos residentes nos tecidos denomínase sistema de macrófagos tisulares ou sistema fagocítico mononuclear, que funciona como unha primeira liña de defensa contra a infección. Cando se produce unha infección, primeiro actúan estes, e despois chegan máis macrófagos procedentes da transformación de monocitos sanguíneos extravasados. Cada tipo de macrófago, segundo a súa localización, ten un nome específico:
| Nome da célula | Localización |
| Macrófagos alveolares | alvéolos dos pulmóns |
| Histiocitos | tecido conectivo |
| Células de Kupffer | fígado |
| Microglía | tecido nervioso |
| Célula epitelioide | granulomas |
| Osteoclastos | óso |
| Células do revestimento dos sinusoides | bazo |
| Células intraglomerulares mesanxiais | riles |
| Células xigantes | Tecido conectivo |
O estudo dalgúns tipos de macrófagos é complicado. As investigacións sobre as células de Kupffer son difíciles de facer, porque só son accesibles á análise histioquímica por biopsia ou autopsia. Nas ratas e ratos son difíciles de illar e despois da purificación só se poden obter dun rato aproximadamente 5 millóns de células.
Os macrófagos poden ter funcións parácrinas nos órganos, que son específicas para cada órgano. Nos testículos, por exemplo, os macrófagos viuse que poden interaccionar coas células de Leydig secretando 25-hidroxicolesterol, un oxiesterol que pode ser convertido en testosterona pola célula de Leydig veciña.[11] Ademais, os macrófagos testiculares poden participar na creación dun ambiente inmunoloxicamente privilexiado (illado) no testículo, e na mediación da infertilidade durante a inflamación do testículo.
Enfermidades
editarDebido ao seu papel na fagocitose, os macrófagos están implicados en moitas enfermidades do sistema inmunitario. Por exemplo, participan na formación de granulomas, danos inflamatorios que poden ser causados por diversas enfermidades. Foron descritos algúns trastornos, principalmente raros, nos que hai unha fagocitose e función dos macrófagos ineficaz.
Tuberculose
editarUnha vez englobado por un macrófago o axente causante da tuberculose, o Mycobacterium tuberculosis,[12] este evita as defensas celulares e mesmo utiliza o macrófago para replicarse.
Enfermidades cardíacas
editarOs macrófagos son as células predominantes na creación de placas progresivas de aterosclerose.[13]
Infección por VIH
editarOs macrófagos tamén xogan un papel na infección por VIH/SIDA (causada polo virus da inmunodeficiencia humana). Igual ca as células T, os macrófagos poden ser infectados polo VIH, e mesmo funcionan como reservorio para que continúe a replicación do virus por todo o corpo. O VIH pode entrar no macrófago ao ligarse a proteína gp120 da superficie do virus co receptor de membrana CD4 do macrófago e cun segundo receptor de membrana, o CCR5 (un receptor de quimiocina). Serven como reservorio para o virus tanto os macrófagos coma os monocitos circulantes.[14]
Cáncer
editarCrese que nalgúns casos os macrófagos axudan a proliferar ás células cancerosas. Son atraídos por células tumorais faltas de osíxeno (en estado de hipoxia) e promoven a inflamación crónica. Os compostos inflamatorios como o factor de necrose tumoral (TNF) liberados polos macrófagos activan o intrruptor xénico factor nuclear kapa B (NF-κB). O NF-κB despois entra no núcleo dunha célula tumoral e activa a produción de proteínas que deteñen a apoptose e promoven a proliferación celular e a inflamación.[15]
Historia
editarO ruso Elie Metchnikoff recibiu o Premio Nobel de Fisioloxía e Medicina polos seus traballos sobre a inmunidade no ano 1908. Descubriu que certas células illadas dixerían partículas que el introducira no tubo dixestivo das larvas de peixes coas que estudaba. A estas células chamounas fagocitos e máis tarde identificounos como glóbulos brancos e viu que formaban a primeira liña de defensa contra as infeccións nos seres vivos.
O termo macrófago foi asignado por Aschoff en 1924 a un conxunto de células compoñentes do sistema retículo-endotelial que está formado non só por monocitos, macrófagos e histiocitos, mais tamén por fibroblastos, células endoteliais e células reticulares. Despois de 1969, definiuse o concepto de sistema fagocítico mononuclear, formado por unha variedade de macrófagos, derivados de monocitos procedentes da medula ósea, abandonándose o concepto de sistema retículo-endotelial, que está constituído por células distintas funcional e inmunoloxicamente.
Notas
editar- ↑ Krombach, F., Münzing, S., Allmeling, A. M., Gerlach, J. T., Behr, J., Dörger, M. (1 September 1997). "Cell size of alveolar macrophages: an interspecies comparison". Environ. Health Perspect. 105 Suppl 5 (Suppl 5): 1261–3. JSTOR 3433544. PMC 1470168. PMID 9400735. doi:10.2307/3433544.
- ↑ Khazen, W., M'bika, J. P., Tomkiewicz, C.; et al. (October 2005). "Expression of macrophage-selective markers in human and rodent adipocytes". FEBS Lett. 579 (25): 5631–4. PMID 16213494. doi:10.1016/j.febslet.2005.09.032.
- ↑ David M. Mosser and Justin P. Edwards (December 2008). "Exploring the full spectrum of macrophage activation". Nature Reviews Immunology 8 (12): 958–969. PMC 2724991. PMID 19029990. doi:10.1038/nri2448.
- ↑ "The human immune system: The lymphocyte story". New Scientist (1605): 1. March 1988. Consultado o 2007-09-13.
- ↑ Krippendorf, BB; Riley, DA (January 1993). "Distinguishing unloading-versus reloading-induced changes in rat soleus muscle". Muscle Nerve 16 (1): 99–108. PMID 8423838. doi:10.1002/mus.880160116.
- ↑ 6,0 6,1 6,2 St Pierre BA, JG Tidball (1994). "Differential response of macrophage subpopulations to soleus muscle reloading following rat hindlimb suspension". Journal of Applied Physiology 77 (1): 290–297. PMID 7961247.
- ↑ Tidball JG, Berchenko E, Frenette J (1999). "Macrophage invasion does not contribute to muscle membrane injury during inflammation". Journal of Leukocyte Biology 65 (4): 492–498. PMID 10204578.
- ↑ 8,0 8,1 Schiaffino S, Partridge T (2008). Skeletal Muscle Repair and Regeneration - Advances in Muscle Research 3. p. 380.
- ↑ Tidball JG, Wehling-Henricks M (2007). "Macrophages promote muscle membrane repair and muscle fibre growth and regeneration during modified muscle loading in mice in vivo". The Journal of Physiology 578 (Pt 1): 327–336. PMC 2075127. PMID 17038433. doi:10.1113/jphysiol.2006.118265.
- ↑ Brechot; Gomez, Elisa; Bignon, Marine; Khallou-Laschet, Jamila; Dussiot, Michael; Cazes, Aurélie; Alanio-Bréchot, Cécile; Durand, Mélanie; Philippe, Josette; et al. (2008). Cao, Yihai, ed. "Modulation of Macrophage Activation State Protects Tissue from Necrosis during Critical Limb Ischemia in Thrombospondin-1-Deficient Mice". PLoS One 3 (12): e3950. PMC 2597179. PMID 19079608. doi:10.1371/journal.pone.0003950.
- ↑ "Copia arquivada". Arquivado dende o orixinal o 27 de febreiro de 2006. Consultado o 30 de decembro de 2011.
- ↑ Ryan KJ, Ray CG (editors) (2004). McGraw Hill, ed. Sherris Medical Microbiology (4th ed.). ISBN 0-8385-8529-9.
- ↑ Lucas AD, Greaves DR (November 2001). "Atherosclerosis: role of chemokines and macrophages". Expert Rev Mol Med 3 (25): 1–18. PMID 14585150. doi:10.1017/S1462399401003696.
- ↑ Sebastiaan Bol, Viviana Cobos-Jiménez, Neeltje Kootstra and Angélique van ’t Wout, Future Virology, February 2011,Dr.Andy Pozo Vol. 6, No. 2, Pages 187–208. http://www.futuremedicine.com/toc/fvl/6/2 Arquivado 12 de setembro de 2019 en Wayback Machine.
- ↑ Gary Stix (2007). "A Malignant Flame". Scientific American: 46–9.
Véxase tamén
editarOutros artigos
editar- Célula escumosa
- Célula xigante do corpo estraño
- Célula xigante de Langhans
- Célula xigante de Touton
- M-CSF
Ligazóns externas
editar- HIV and the Macrophage Arquivado 02 de decembro de 2007 en Wayback Machine. Un libro sobre o papel dos macrófagos na patoxénese da SIDA
- The role of macrophages in HIV pathogenesis
- Macrophages News Macrophages News provided by insciences organisation
- www.macrophages.com The Macrophage Community Website