Osteoclasto
Un osteoclasto, do grego "óso" (Οστό) e "roto" (κλαστός), é un tipo de célula do tecido óseo que destrúe o tecido óseo durante a súa remodelación, eliminando a súa matriz mineralizada e degradando a parte orgánica da matriz (fundamentalmente coláxeno). Este proceso denomínase reabsorción ósea ou resorción ósea. Os osteoclastos foron descubertos por Kolliker en 1873.[1] Os osteoclastos e osteoblastos controlan a cantidade de tecido óseo: os osteoblastos forman óso, e os osteoclastos reabsórbeno. Os osteoclastos están formados pola fusión de células da liña celular monocito-macrófago.[2] Os osteoclastos caracterízanse pola intensa expresión das proteínas fosfatase ácida tartarato resistente (TRAP) e catepsina K.
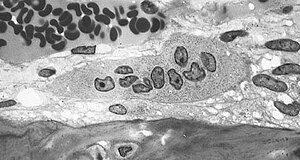
Morfoloxía
editarOs osteoclastos son células grandes de ata 40 micrómetros de diámetro. Conteñen de 15 a 20 núcleos ovais estreitamente empaquetados. Atópanse en cavidades da superficie do óso denominadas lagoas de Howship. Caracterízanse por ter un citoplasma cunha aparencia "escumosa" homoxénea. Este aspecto débese á alta concentración de vesículas e vacúolos. Estes vacúolos son lisosomas cheos de fosfatase ácida. O seu retículo endoplasmático rugoso está disperso, e o aparato de Golgi é extenso.[3][4][5]
Nos lugares de reabsorción activa de óso, os osteoclastos forman unha membrana plasmática especializada, chamada o "bordo con volantes," que toma contacto coa superficie do tecido óseo.[2] Este bordo tan peculiar, que facilita a eliminación da matriz do óso, é característico dos osteoclastos que están realizando unha activa reabsorción ósea. O bordo incrementa a área superficial en contacto co óso para realizar a reabsorción. A porción mineral da matriz (chamada hidroxiapatito) contén ións calcio e fosfato. Estes ións son absorbidos en pequenas vesículas durante a endocitose, as cales se moven a través da célula e finalmente son liberadas no fluído extracelular, facendo que se incrementen os niveis destes ións no sangue.
Orixe
editarDesde que se descubriron en 1873 houbo un considerable debate sobre a súa orixe. As teorías dominantes eran tres: de 1949 a 1970 a máis aceptada era que tiñan unha orixe no tecido conectivo, o que significaba que os osteoblastos e os osteoclastos eran da mesma liñaxe celular, e que os osteoblastos se fusionaban para formar osteoclastos. En certos momentos os osteoclastos disociábanse e orixinaban osteoblastos, os cales á súa vez orixinaban osteocitos. Na década de 1970 fíxose predominante a teoría bifilética; que supoñía que osteoblastos e osteoclastos eran de diferente liñaxe. Foi a comezos de 1980 cando se recoñeceu finalmente que o sistema fagocítico dos monocitos era o precursor dos osteoclastos.[6] A formación dos osteoclastos require a presenza do ligando RANK (receptor activador do factor nuclear κβ) e o factor estimulante das colonias de macrófagos (M-CSF). Estas proteínas unidas a membrana son producidas polas células estromáticas veciñas e polos osteoblastos, o que require un contacto directo entre estas células e os precursores dos osteoclastos.
O factor estimulante das colonias de macrófagos (M-CSF) actúa por medio do seu receptor sobre os osteoclastos, e o receptor 1 do factor estimulante das colonias (c-fms), un receptor tirosina quinase transmembrana, orixina a activación dun segundo mensaxeiro da tirosina quinase Src. Ambas as moléculas son necesarias para a osteoclastoxénese e están moi implicadas na diferenciación celular das células derivadas da liña monocito/macrófago.
O RANKL é membro da familia do factor de necrose tumoral (TNF), e é esencial na osteoclastoxénese. Os ratos que teñen eliminada (knockout) a expresión do RANKL mostran un fenotipo de osteopetrose e defectos na erupción dos dentes, xunto coa ausencia ou deficiencia de osteoclastos. O RANKL activa o NF-κβ (factor nuclear κβ) e o NFATc1 (factor nuclear de células T activadas citoplásmico calcineurina-dependente 1) por medio do RANK. A activación do NF-κβ é estimulada case inmediatamente despois de que ocorra a interacción RANKL-RANK. A estimulación do NFATc1, polo contrario, empeza ~24–48 horas despois de que ocorra a interacción e a súa expresión é dependente do RANKL.
A diferenciación dos osteoclastos é inhibida pola osteoprotexerina (OPG), que é producida polos osteoblastos e que se une ao RANKL impedindo así a súa interacción co RANK.
Funcións
editarUnha vez activados, os osteoclastos móvense por quimiotaxe a áreas onde hai microfracturas no óso. O osteoclasto sitúase nunha pequena cavidade chamada lagoa de Howship, orixinada pola dixestión do material óseo que hai debaixo. A chamada zona de selaxe é a zona onde a membrana plasmática do osteoclasto se aplica sobre o tecido óseo. As zonas de selaxe están limitadas por bandas de estruturas de adhesión especializadas chamadas podosomas. A adhesión á matriz do óso está facilitada por receptores de integrinas, como αvβ3, e por medio de secuencias de aminoácidos específicas con motivos arxinina-glicina-aspartato que se encontran nas proteínas da matriz ósea, como a osteopontina. Grazas á acción da anhidrase carbónica, que cataliza a reacción H2O + CO2 → HCO3- + H+, o osteoclasto libera H+, que pasa a través do bordo de volantes á cavidade de reabsorción, acidificando e axudando á disolución da matriz mineralizada do óso, que se disolve formando Ca2+, H3PO4, H2CO3, auga e outras substancias. Está documentado que as disfuncións no funcionamento da anhidrase carbónica causan algunhas formas de osteopetrose. Os H+ son bombeados en contra dun forte gradiente de concentración por bombas de protóns, especificamente unha ATPase vacuolar. Este encima foi estudado como unha posible vía de prevención da osteoporose. Ademais, libéranse varios encimas hidrolíticos, como os membros dos grupos das catepsinas e das metaloproteases da matriz (MMP), para dixerir os compoñentes orgánicos da matriz. Estes encimas son liberados no compartimento por lisosomas. Destes encimas hidrolíticos o máis importante é a catepsina K.
Catepsina K e outras catepsinas
editarA catepsina K é unha cisteína protease similar á papaína colaxenolítica que se expresa principalmente nos osteoclastos, e secrétase na cavidade de reabsorción. As mutacións no xene da catepsina K están asociadas con picnodisostose, unha osteopetrose hereditaria, caracterizada pola perda da expresión de catepsina K funcional. Experimentos coa técnica knockout coa catepsina K en ratos orixináronlles un fenotipo osteopetrótico, o cal é compensado parcialmente por un incremento na expresión douras proteases distintas da catepsina K e un aumento da osteoclastoxénese.
A catepsina K ten unha actividadde encimática óptima en condicións ácidas. Sintetízase como un proencima cun peso molecular de 37 kDa, e actívase por activación por escisión autocatalítica, transformándose na forma madura activa cun peso molecular de ~27kDa.
Nos osteoclastos a catepsina K funciona no proceso de reabsorción ósea. O osteoclasto polarízase no lugar de reabsorción e secrétase a catepsina K desde o bordo de volantes á cavidade de reabsorción. Alí, é a principal protease implicada na degradación do coláxeno de tipo I e outras proteínas non colaxénicas, as cales foran desmineralizadas polo ambiente ácido creado na cavidade de reabsorción. Desde a cavidade de reabsorción a catepsina K migra a través do bordo de volantes, ao osteoclasto por medio de vesículas intercelulares e é despois liberada polo dominio secretor funcional. Dentro destas vesículas intercelulares, a catepsina K, xunto coa xeración de especies reactivas do osíxeno pola fosfatase ácida tartarato resistente, degrada os produtos da reabsorción do óso.
Os osteoclastos expresan moitas outras catepsinas. Entre elas están a catepsina B, C, D, E, G, e L. As funcións destas cisteína proteases e aspártico proteases xeralmente se descoñecen no óso, e exprésanse a niveis moito máis baixos ca a catepsina K.
Metaloproteinases da matriz
editarAs metaloproteinases da matriz (MMPs) son unha familia de máis de 20 endopeptidases dependentes de cinc. O papel das metaloproteinases da matriz (MMPs) na bioloxía dos osteoclastos está mal definido, pero noutros tecidos foron asociadas con actividades que promoven tumores, como a activación de factores de crecemento e requírense para a formación de metástases tumorais e a anxioxénese.
A MMP-9 está asociada co microambiente do óso. Exprésase polos osteoclastos, e é necesaria para a migración dos osteoclastos, e é unha poderosa xelatinase. Os ratos transxénicos aos que lles falta a MMP-9 presentan defectos no desenvolvemento óseo, a anxioxénese intraósea, e a reparación de fracturas.
A MMP-13 crese que está implicada na reabsorción do óso e na diferenciación dos osteoclastos, xa que os ratos knockout mostran cantidades diminuídas de osteoclastos, osteopetrose, e menor reabsorción ósea.
As MMPs expresadas polos osteoclastos inclúen a MMP-9, -10, -12, e -14. Excepto da MMP-9, pouco se sabe da súa relevancia para o osteoclasto, aínda que se atoparon altos niveis de MMP-14 na zona de selaxe.
Regulación
editarOs osteoclastos están regulados por varias hormonas, entre as que están a hormona paratiroide (PTH) da glándula paratiroide, a calcitonina da glándula tiroide, e o factor de crecemento interleucina 6 (IL-6). Esta última hormona, a IL-6, é un dos factores que interveñen na osteoporose, que consiste nun desequilibrio entre a reabsorción ósea e a formación de óso. A actividade dos osteoclastos está tamén mediada pola interacción de dúas moléculas producidas polos osteoblastos, a osteoprotexerina e o ligando RANK. Estas moléculas tamén regulan a diferenciación dos osteoclastos.[7]
Outros usos do termo
editarUn osteoclasto é tamén un instrumento cirúrxico utilizado para fracturar e reaxustar ósos. Para non confundila con este instrumento a célula foi denominada orixinalmente ostoclasto. Pero cando este instrumento cirúrxico caeu en desuso, a célula adquiriu o seu nome actual de osteoclasto.
Notas
editar- ↑ Nijweidi Peter J., JEAN H. M. FEYEN (1986). "Cells of Bone: Proliferation, Differentiation, and Hormonal Regulation". Physiological Reviews 66 (4): 855–886. PMID 3532144.
- ↑ 2,0 2,1 Netter, Frank H. (1987), Musculoskeletal system: anatomy, physiology, and metabolic disorders. Summit, New Jersey: Ciba-Geigy Corporation ISBN 0-914168-88-6, p. 169
- ↑ Standring S., Ed. Gray's Anatomy. 39th ed. 2005, Elsevier
- ↑ Holtrop, M. E. and G. J. King (1977) (1977). "The ultrastructure of the osteoclast and its functional implications". Clin Orthop Relat Res 123 (123): 177–196. PMID 856515.
- ↑ Väänänen H, Zhao H, Mulari M, Halleen J (2000). "The cell biology of osteoclast function". J Cell Sci. 113 ( Pt 3): 377–81. PMID 10639325. p. 378
- ↑ Peter J. Nijweide Ehb And Jean H. M. Feyen. Cells of Bone: Proliferation, Differentiation, and Hormonal Regulation. Physiological Reviews 1986;66(4):855-886.
- ↑ Schoppet M, Preissner K, Hofbauer L (2002). "RANK ligand and osteoprotegerin: paracrine regulators of bone metabolism and vascular function". Arterioscler Thromb Vasc Biol 22 (4): 549–53. PMID 11950689. doi:10.1161/01.ATV.0000012303.37971.DA.
Véxase tamén
editarOutros artigos
editarLigazóns externas
editar- MedicineNet Arquivado 25 de maio de 2013 en Wayback Machine.
- The Life of Osteoclast