Capilar
Os capilares son os vasos sanguíneos (e linfáticos) máis pequenos do corpo, que constitúen a rede de vasos da microcirculación. A súa parede está formada por un endotelio dunha soa célula de grosor. Estes microvasos, que miden de 5 a 10 micrómetros (µm) de diámetro, conectan as arteríolas e vénulas, e posibilitan o intercambio de auga, oxíxeno, dióxido de carbono, e moitos nutrientes e substancias residuais entre o sangue e as células dos tecidos[3] que os rodean. Os capilares linfáticos conectan cos grandes vasos linfáticos para drenar a linfa recollida na microcirculación.
| Capilar Vaso capilar | |
|---|---|
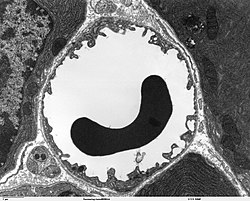 | |
| Imaxe de microscopio electrónico de varrido dun capilar cun glóbulo vermello no seu interior no tecido pancreático. A parede do capilar consta de células endoteliais delgadas e longas, conectadas por unións herméticas. | |
 | |
| Ilustración simplificada dunha rede capilar (carece de esfínteres precapilares, que non están presentes en todos os capilares.[1]). | |
| Latín | vas capillare (Terminologia Histologica 3 09 02.0.02001)[2] |
Durante as etapas iniciais da embrioxénese[4] fórmanse novos capilares por un proceso chamado vasculoxénese, que é o proceso da formación de vasos sanguíneos que ten lugar por medio da produción de novo de células endoteliais que despois forman os tubos vasculares.[5] O termo anxioxénese refírese á formación de novos capilares a partir de vasos sanguíneos preexistentes e endotelio xa presente, que se divide.[6]
Estrutura
editarO sangue sae desde o corazón, flúe polas arterias, que se ramifican e se fan cada vez máis estreitas ata convertérense en arteriolas, e estas ramifícanse en finos capilares, nos cales se produce o intercambio de nutrientes e residuos. Os capilares despois xúntanse formando vénulas, que se van ensanchando e converxendo para formar veas, que levan o sangue de volta ao corazón a través das grandes veas.
Un capilar non funciona por separado, senón que o fai formando parte de redes de capilares, que subministran rego sanguíneo a tecidos e órganos. Canto máis metabolicamente activa é unha célula ou o ambiente nun tecido, máis capilares son necesarios para fornecer os nutrientes e transportar os produtos residuais. As redes de capilares poden constar de dous tipos de vasos sanguíneos: os verdadeiros capilares, que se ramifican das arteriolas e realizan o intercambio entre as células e o sangue, e vasos curtos que conectan directamente as arteriolas e as vénulas polos extremos das redes, chamadas metarteriolas, que só se encontran na circulación mesentérica.
As metarteriolas son características da microcirculación mesentérica[1] pero antes pensábase erradamente que estaban presentes na maioría das redes de capilares.[1] O mecanismo fisiolóxico que subxace na resistencia precapilar xa non se considera que sexa o resultado da acción de esfínteres precapilares situados fóra do órgano mesentérico.[1]
Os capilares linfáticos son lixeiramente máis longos en diámetro que os capilares sanguíneos, e teñen extremos pechados (a diferenza dos capilares sanguíneos que están abertos polos dous extremos, por un ábrense ás arteriolas e por outro ás vénulas). Esta estrutura permite que o fluído intersticial flúa ao interior delas pero non saia. Os capilares linfáticos teñen unha presión oncótica interna maior que os capilares sanguíneos, debido á gran concentración de proteínas plasmáticas na linfa.[7]
Tipos
editarHai tres tipos principais de capilares sanguíneos:
Continuos
editarOs capilares continuos chámanse así porque as células endoteliais que contitúen as súas paredes forman un recubrimento ininterrompido. Estes capilares continuos (ou de tipo músculo) están presentes no músculo, sistema nervioso e tecidos conxuntivos. A súa parede está formada por unha soa capa de células, moi planas (co seu núcleo avultado e sobresaíndo un pouco na luz do vaso e a parte periférica moi fina) e unha lámina basal e fibras reticulares. Nos capilares pequenos unha soa célula endotelial esténdese circularmente e abrangue todo o seu diámetro, pero nos capilares máis grandes a parede pode estar formada por parte de dúas ou tres células unidas por unións herméticas. Por fóra da parede pode haber outras células chamadas pericitos. As células endoteliais presentan numerosas vesículas duns 70 nm de diámetro preto das membranas, que se abren tanto á superficie luminal coma á dos tecidos e interveñen no transporte por pinocitose. Nos capilares da barreira hematoencefálica estas vesículas son menos numerosas. Este endotelio só permite o paso de pequenas moléculas.[8]
Fenestrados
editarOs capilares fenestrados (do latín fenestra, que significa fiestra, ventá) teñen poros nas células do revestimento endotelial de 60 a 80 nm de diámetro, que están pechados por un diafragma filtrador de fibrilas orientadas radialmente, están distribuídos moi uniformemente, e permiten que difundan pequenas moléculas e cantidades limitadas de proteínas.[9][10] Á parte destas fenestracións, o resto do endotelio é similar ao dos capilares continuos. Nos capilares do glomérulo renal as células endoteliais non teñen este diafragma e a súa lámina basal é ata tres veces máis grosa. No glomérulo renal hai células chamadas podocitos con prolongacións chamadas pedicelos, que teñen poros fendidos cunha función análoga á do diafragma dos capilares. Os capilares fenestrados atópanse principalmente nas glándulas endócrinas, intestinos, páncreas, e os glomérulos dos riles.[8]
Sinusoidais
editar- Artigo principal: Capilar sinusoidal.
Os capilares sinusoidais son un tipo especial de capilares de poros abertos tamén chamados capilares descontinuos, que teñen longas aberturas (de ata 30-40 µm de diámetro) no endotelio. Estes tipos de vasos sanguíneos permiten nalgúns casos o paso de glóbulos vermellos e brancos (de 7,5 µm a 25 µm de diámetro) e diversas proteínas do plasma sanguíneo, ao que contribúe a súa lámina basal descontinua. Estes capilares carecen de vesículas pinocíticas, e utilizan os ocos que hai nas unións celulares para permitir a transferencia entre as células endoteliais, e así cruzar a membrana. Os vasos sanguíneos sinusoidais están localizados principalmente na medula ósea, ganglios linfáticos, e glándulas adrenais. Algúns sinusoides distínguense por non ter unións herméticas entre as células, e denomínanse capilares sinusoidais descontinuos, e están presentes no fígado e no bazo, órganos nos que é necesario un gran movemento de células e materiais.
Función
editarA parede do capilar realiza unha importante función ao permitir aos nutrientes e substancia residuais pasar a través dela. As moléculas maiores de 3 nm como a proteína albumina e outras grandes proteínas pasan por medio do transporte transcelular transportados dentro de vesículas (transcitose), un proceso que require que estas vaian e veñan a través do citoplasma das células endoteliais. As moléculas menores de 3 nm, como a auga, ións e gases cruzan a parede do capilar a través do espazo entre as células nun proceso chamado transporte paracelular.[11] Estes mecanismos de transporte permiten un intercambio bidireccional de substancias dependendo de gradientes osmóticos e poden ser cuantificados pola ecuación de Starling.[12] Porén, os capilares que forman parte da barreira hematoencefálica só permiten o tranporte transcelular, xa que as unións herméticas entre as células endoteliais selan o espazo paracelular.[13]
As redes capilares poden controlar o seu fluxo sanguíneo por medio de autorregulación. Isto permite que un órgano manteña un fluxo constante a pesar do cambio na presión arterial central. Isto conséguese por medio da resposta mioxénica, e no ril por medio da retroalimentación tubuloglomerular. Cando aumenta a presión arterial as arteriolas expanden o seu diámetro e despois constrínxense (un fenómeno chamado efecto Bayliss) para contrarrestaren o aumento da tendencia da alta presión de aumentar o fluxo sanguíneo.
Nos pulmóns adaptáronse mecanismos especiais para satisfacer as necesidades dun maior fluxo sanguíneo durante o exercicio. Cando o frecuencia cardíaca se incrementa e ten que entrar máis sangue nos pulmóns, os capilares disténdense para poder conducir o fluxo incrementado, á vez que a resistencia diminúe.
A permeabilidade dos capilares pode ser aumentada pola liberación de certas citocinas, anafilatoxinas, ou outros mediadores (como leucotrienos, prostaglandinas, histamina, bradicinina etc.) moi influenciadas polo sistema inmunitario.
A ecuación de Starling relaciona as forzas que actúan a través dunha membrana semipermeable e permite o cálculo do fluxo neto:
onde:
- é a forza neta impulsora,
- é a constante de proporcionalidade, e
- é o movemento neto de fluído entre compartimentos.
Por convención, a forza cara a fóra defínese como positiva, e a forza cara a dentro como negativa. A solución á ecuación é a filtración neta ou movemento de fluído neto (Jv). Se é positivo, o fluído tenderá a saír do capilar (filtración). Se é de negativa, o fluído tenderá a entrar no capilar (absorción). Esta ecuación ten varias implicacións fisiolóxicas importantes, especialmente cando os procesos fisiolóxicos alteran moito unha ou máis das variables.
Variables
editarSegundo a ecuación de Starling, o movemento de fluídos depende de seis variables:
- Presión hidrostática capilar ( Pc )
- Presión hidrostática intersticial ( Pi )
- Presión oncótica capilar ( πz )
- Presión oncótica intersticial ( πi )
- Coeficiente de filtración ( Kf )
- Coeficiente de reflexión ( σ )
Importancia clínica
editarOs trastornos na formación dos capilares como resultado dun defecto conxénito no desenvolvemento ou dun trastorno adquirido son característicos en moitos trastornos graves comúns. Dentro dun amplo rango de factores celulares e citocinas, parece que xogan un importante papel en moitas desordes os problemas na expresión xenética normal e bioactividade do factor que afecta ao crecemento e permeabilidade vascular chamado factor de crecemento endotelial vascular (VEGF). Entre os factores celulares están a cantidade e función reducida das células proxenitoras endoteliais derivadas da medula ósea[14] e a redución da capacidade desas células de formar vasos sanguíneos.[15]
- A formación de capilares adicionais e de grandes vasos sanguíneos (anxioxénese) é un mecanismo principal polo que o cancro pode favorecer o seu propio crecemento. Os trastornos dos capilares retinianos contribúen á patoxénese da dexeneración macular relacionada coa idade.
- Unha redución da densidade de capilares (rarefacción de capilares) pode aparecer en asociación con factores de risco vasculares[16] e en pacientes con enfermidade coronaria.[15]
Terapéutica
editarNo tratamento dalgunhas enfermidades pode ser útil alterar a formación de capilares. Entre elas están doenzas nas que hai unha excesiva ou anormal formación de capilares como o cancro ou certos trastornos da visión. Outras veces as doenzas producen unha redución da formación de capilares por razóns xenéticas familiares, ou por un problema adquirido.
- En pacientes co trastorno retinal dexeneración macular relacionada coa idade neovascular, o tratamento anti VEGF local para limitar a bioactividade de dito factor protexe a visión ao limitar a progresión da doenza.[17]
- En moitos tipos de cancros estudáronse tratamentos deste tipo ou están en desenvolvemento, que pretenden diminuír o crecemento do tumor ao reducir a anxioxénese.[18]
Mostras de sangue
editarAs mostras de sangue capilar poden usarse para facer probas para, por exemplo, medir a glicosa sanguínea, a hemoglobina, o pH e o lactato (estes dous últimos poden ser cuantificados en probas de sangue de coiro cabeludo fetal para comprobar o estado ácido-base dun feto durante a infancia).
A mostra de sangue capilar realízase xeralmente facendo un pequeno corte cunha lanceta, tomando unha mostra por acción capilar no corte cunha tira de papel de proba ou un pequeno tubo.
Historia
editarA pesar da crenza popular William Harvey, descubridor da circulación sanguínea, non predixo explicitamente a existencia de capilares, pero viu claramente a necesidade dalgún tipo de conexión entre os sistemas arterial e venoso. Escribiu: "…o sangue entra en cada membro a través das arterias, e retorna polas veas, e que as veas son os vasos e vías polas cales o sangue volve ao propio corazón; e que o sangue nos membros e extremidades pasa desde as arterias ás veas (ou mediante unha anastomose, ou directamente por porosidades da carne, ou polas dúas vías) como antes fixo no corazón e no tórax saíndo fóra das veas cara ao interior das arterias…" [On the Motion of the Heart and Blood in Animals," Capítulo XI, páx. 59–60 na edición de 1653.][19]
Marcello Malpighi foi o primeiro que observou directamente e describiu correctamente os capilares no pulmón de ras en 1661.[20]
Notas
editar- ↑ 1,0 1,1 1,2 1,3 Sakai et. al (2013). "Are the precapillary sphincters and metarterioles universal components of the microcirculation? An historical review". J Physiol Sci. 2013; 63: 319–331. 63 (5): 319–31. PMC 3751330. PMID 23824465. doi:10.1007/s12576-013-0274-7.
- ↑ "THH:3.09 The cardiovascular system". Arquivado dende o orixinal o 29 de xuño de 2020. Consultado o June 3, 2014.
- ↑ Maton, Anthea; Jean Hopkins; Charles William McLaughlin; Susan Johnson; Maryanna Quon Warner; David LaHart; Jill D. Wright (1993). Human Biology and Health. Englewood Cliffs, New Jersey: Prentice Hall. ISBN 0-13-981176-1.
- ↑ http://www.wormbook.org/chapters/www_embryovariationdevelop/embryovariationdevelop.html
- ↑ John S. Penn (11 March 2008). Retinal and Choroidal Angiogenesis. Springer. pp. 119–. ISBN 978-1-4020-6779-2. Consultado o 26 June 2010.
- ↑ "Endoderm -- Developmental Biology -- NCBI Bookshelf". Consultado o 2010-04-07.
- ↑ Guyton, Arthur; Hall, John (2006). "Chapter 16: The Microcirculation and the Lymphatic System". In Gruliow, Rebecca. Textbook of Medical Physiology (Book) (11th ed.). Philadelphia, Pennsylvania: Elsevier Inc. pp. 187–188. ISBN 0-7216-0240-1
- ↑ 8,0 8,1 D. W. Fawcett. Tratado de Histología. Bloom-Fawcet. Interamericana-McGraw-Hill. 11ª edición. Páxinas 384-392. ISBN 84-7605-361-4.
- ↑ Imaxe de Histoloxía:22401lba de Vaughan, Deborah (2002). A Learning System in Histology: CD-ROM and Guide. Oxford University Press. ISBN 978-0195151732.
- ↑ Pavelka, Margit; Jürgen Roth (2005). Functional Ultrastructure: An Atlas of Tissue Biology and Pathology. Springer. p. 232.
- ↑ Sukriti, S; Tauseef, M; Yazbeck, P; Mehta, D (2014). "Mechanisms regulating endothelial permeability.". Pulmonary circulation 4 (4): 535–551. PMC 4278616. PMID 25610592. doi:10.1086/677356.
- ↑ Nagy, JA; Benjamin, L; Zeng, H; Dvorak, AM; Dvorak, HF (2008). "Vascular permeability, vascular hyperpermeability and angiogenesis.". Angiogenesis 11 (2): 109–119. PMC 2480489. PMID 18293091. doi:10.1007/s10456-008-9099-z.
- ↑ Bauer, HC; Krizbai, IA; Bauer, H; Traweger, A (2014). ""You Shall Not Pass"-tight junctions of the blood brain barrier.". Frontiers in Neuroscience 8. PMC 4253952. PMID 25520612. doi:10.3389/fnins.2014.00392.
- ↑ Gittenberger-De Groot, Adriana C.; Winter, Elizabeth M.; Poelmann, Robert E (2010). "Epicardium derived cells (EPDCs) in development, cardiac disease and repair of ischemia". Journal of Cellular and Molecular Medicine 14 (5): 1056–60. PMID 20646126. doi:10.1111/j.1582-4934.2010.01077.x.
- ↑ 15,0 15,1 Lambiase, P. D.; Edwards, RJ; Anthopoulos, P; Rahman, S; Meng, YG; Bucknall, CA; Redwood, SR; Pearson, JD; Marber, MS (2004). "Circulating Humoral Factors and Endothelial Progenitor Cells in Patients with Differing Coronary Collateral Support". Circulation 109 (24): 2986–92. PMID 15184289. doi:10.1161/01.CIR.0000130639.97284.EC.
- ↑ Noon, J P; Walker, B R; Webb, D J; Shore, A C; Holton, D W; Edwards, H V; Watt, G C (1997). "Impaired microvascular dilatation and capillary rarefaction in young adults with a predisposition to high blood pressure". Journal of Clinical Investigation 99 (8): 1873–9. PMC 508011. PMID 9109431. doi:10.1172/JCI119354.
- ↑ Bird, Alan C. (2010). "Therapeutic targets in age-related macular disease". Journal of Clinical Investigation 120 (9): 3033–41. PMC 2929720. PMID 20811159. doi:10.1172/JCI42437.
- ↑ Cao, Yihai (2009). "Tumor angiogenesis and molecular targets for therapy". Frontiers in Bioscience 14 (14): 3962–73. PMID 19273326. doi:10.2741/3504.
- ↑ Harvey, William (1653). On the motion of the Heart and Blood in Animals. pp. 59–60. Arquivado dende o orixinal o 14 de agosto de 2020. Consultado o 30 de maio de 2016. Orixinal: "…the blood doth enter into every member through the arteries, and does return by the veins, and that the veins are the vessels and ways by which the blood is returned to the heart itself; and that the blood in the members and extremities does pass from the arteries into the veins (either mediately by an anastomosis, or immediately through the porosities of the flesh, or both ways) as before it did in the heart and thorax out of the veins, into the arteries…"
- ↑ John Cliff, Walter (1976). Blood Vessels. CUP Archives. p. 14.
Véxase tamén
editarOutros artigos
editarLigazóns externas
editar| Commons ten máis contidos multimedia sobre: Capilar |
- Imaxe de Histoloxía: 00903loa – Histology Learning System na Universidade de Boston
- The Microcirculatory Society, Inc.
- The Histology Guide - Capillaries