Glicocorticoide
Os glicocorticoides (GCs) son unha clase de corticosteroides, un tipo de hormonas esteroides entre as que a máis salientable é o cortisol. Un sinónimo menos común que se utiliza ás veces para eles é glicocorticosteroide. Os glicocorticoides son corticosteroides que se unen ao receptor de glicocorticoides,[1] o cal está presente practicamente en todas as células de vertebrados. O nome glicocorticoide (de glicosa + córtex + esteroide) deriva do seu papel na regulación do metabolismo da glicosa, a súa síntese no córtex adrenal, e a súa estrutura química de esteroide (ver estrutura na imaxe á dereita).

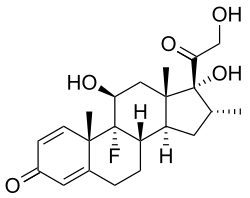
Os glicocorticoides forman parte do mecanismo de retroalimentación do sistema inmunitario, que reduce certos aspectos da función inmunitaria, como a redución da inflamación. Por esa razón, utilízanse tamén en medicina para tratar doenzas causadas por un sistema inmunitario sobreactivado, como as alerxias, asma, enfermidades autoinmunes, e sepse. Os glicocorticoides teñen moitos e diversos efectos (pleiotrópicos), entre eles algúns efectos secundarios potencialmente nocivos, e como resultado adoitan venderse só con receita médica.[2] Tamén interfiren con algúns dos mecanismos anormais que presentan as células cancerosas, polo que se usan en altas doses para tratar certos cancros. Isto inclúe principalmente efectos inhibidores sobre a proliferación de linfocitos (tratamento de linfomas e leucemias) e a mitigación dos efectos secundarios dos fármacos anticancro.
Os glicocorticoides causan os seus efectos uníndose ao receptor de glicocorticoides. O complexo do receptor de glicocorticoides activado, á súa vez, regula á alza a expresión de proteínas antiinflamatorias no núcleo celular (un proceso chamado transactivación) e reprime a expresión de proteínas proinflamatorias no citosol ao impedir a translocación doutros factores de transcrición do citosol ao núcleo (transrepresión).[2]
Os glicocorticoides distínguense dos mineralocorticoides e dos esteroides sexuais polos seus receptores específicos, células diana, e efectos. En termos técnicos, "corticosteroide" refírese tanto aos glicocorticoides coma aos mineralocorticoides (xa que ambos os dous son hormonas similares producidas polo córtex adrenal), aínda que ás veces se usa como sinónimo de "glicocorticoide". Os glicocorticoides prodúcense principalmente na zona fasciculada do córtex adrenal, mentres que os mineralocorticoides sintetízanse na zona glomerulosa.
O cortisol (ou hidrocortisona) é o glicocorticoide humano máis importante. É esencial para a vida, e regula ou mantén unha variedade de importantes funcións cardiovasculares, metabólicas, inmunolóxicas, e homeostáticas. Disponse ademais de varios glicocorticoides sintéticos, que se usan como terapia de substitución nas deficiencias de glicocorticoides ou para suprimir o sistema inmunitario.
Efectos editar
Os efectos dos glicocorticoides poden ser grosso modo clasificados en dúas grandes categorías: inmunolóxicos e metabólicos. Ademais, os glicocorticoides xogan un importante papel no desenvolvemento fetal e na homeostase dos fluídos corporais.
Inmunitarios editar
Como se discute con máis detalle máis adiante, os glicocorticoides funcionan por medio da interacción co receptor de glicocorticoides orixinando:
- unha regulación á alza da expresión de proteínas antiinflamatorias;
- unha regulación á baixa da expresión de proteínas proinflamatorias.
Os glicocorticoides tamén desempeñan un papel no desenvolvemento e homeostase dos linfocitos T. Isto observouse en ratos transxénicos que tiñan a sensibilidade da liñaxe de células T para os glicocorticoides incrementada ou diminuída.[3]
Metabólicos editar
O nome "glicocorticoide" deriva das observacións iniciais de que estas hormonas estaban implicadas no metabolismo da glicosa. En estado de xexún, o cortisol estimula varios procesos que serven en conxunto para incrementar e manter as concentracións normais de glicosa no sangue.
Efectos metabólicos:
- Estimulación da gliconeoxénese, en especial, no fígado: Esta vía ten como resultado a síntese de glicosa a partir de substratos non hexosas, como aminoácidos e glicerol procedentes da degradación de triglicéridos, e é especialmente importante nos carnívoros e en certos herbívoros. Probalemente, a potenciación da expresión de encimas implicados na gliconeoxénese é a función metabólica mellor coñecida dos glicocorticoides.
- Mobilización de aminoácidos en tecidos extrahepáticos: Estes serven como substratos para a gliconeoxénese.
- Inhibición da captación de glicosa no músculo e tecido adiposo: Un mecanismo para conservar glicosa.
- Estimulación da degradación das graxas no tecido adiposo: Os ácidos graxos liberados por lipólise utilízanse para a produción de enerxía en tecidos como o muscular, e a liberación de glicerol proporciona outro substrato para a gliconeoxénese.
Os niveis excesivos de glicocorticoides orixinados pola administración de fármacos ou polo hiperadrenocorticismo teñen efectos en moitos sistemas. Algúns exemplos son a inhibición da formación do óso, a supresión da absorción do calcio (ambas as cousas poden orixinar osteoporose), retardo da curación de feridas, debilidade muscular, e un incremento do risco de infección. Estas observacións suxiren que os glicocorticoides exercen outra multitude de funcións fisiolóxicas menos relevantes.[3]
No desenvolvemento editar
Os glicocorticoides teñen múltiples efectos sobre o desenvolvemento fetal. Un importante exemplo é o seu papel na promoción da maduración do pulmón e a produción do surfactante pulmonar necesario para a función pulmonar extrauterina. Os ratos con alteracións homocigotas no xene da hormona liberadora da corticotropina (véxase máis abaixo) morren ao nacer debido á súa inmadureza pulmonar. Ademais, os glicocorticoides son necesarios para o desenvolvemento normal do cerebro, ao iniciaren a maduración terminal, remodelaren os axóns e dendritas, e afectaren á supervivencia celular,[4] e poden xogar tamén un papel no desenvolvemento do hipocampo.
Na excitación e cognición editar
Os glicocorticoides actúan sobre o hipocampo, amígdala, e lobos frontais. Xunto coa adrenalina, favorecen a formación de memorias flash de aconecementos asociados con fortes emocións, tanto positivas coma negativas.[5] Isto foi confirmado en varios estudos, nos que o bloqueo da actividade dos glicocorticoides ou da noradrenalina diminuía a lembranza de información emocionalmente relevante. Fontes adicionais atoparon que suxeitos cuxa memoria de episodios de medo estaba acompañada por altos niveis de cortisol tiñan unha mellor consolidación desta memoria (este efecto era máis importante en homes). O efecto que teñen os glicocorticoides sobre a memoria pode deberse a danos que afectan especificamente á área CA1 do hipocampo. En moitos estudos en animais, o estrés prolongado (que causa un incremento prolongado dos niveis de glicocorticoides) causaba a destrución de neuronas nesa área do cerebro, a cal foi conectada co desempeño da memoria.[6][7][8]
Os glicocorticoides teñen tamén un significativo impacto sobre a vixilancia (trastorno de déficit de atención) e a cognición (memoria). Isto parece seguir a curva de Yerkes-Dodson, xa que se detectou que na gráfica os "niveis circulantes de glicocorticoides" fronte a "desempeño da memoria" seguían un patrón de U invertido, moi similar á curva de Yerkes-Dodson. Por exemplo, a potenciación a longo prazo (o proceso de formación de recordos a longo prazo) é óptima cando os niveis de glicocorticoides están lixeiramente elevados, mentres que hai unha diminución significativa desta potenciación despois dunha adrenalectomía (estado baixo en glicocorticoides) ou despois da administración exóxena de glicocorticoides (estado de alto nivel de glicocorticoides). Os niveis elevados de glicocorticoides potencian a memoria de acontecementos que excitan as emocións, pero levan máis a miúdo a unha mala memoria de material non relacionado coa fonte da excitación emocional/estrés.[9] A diferenza dos efectos de potenciación dependentes da dose dos glicocorticoides sobre a cosolidación da memoria, estas hormonas do estrés inhiben a recuperación de información xa almacenada.[10] A exposición a longo prazo a medicacións con glicocorticoides, como as medicacións contra o asma e antiinflamatorias xera déficits de memoria e atención tanto durante coma, en menor medida, despois do tratamento,[11][12] unha condición coñecida como "demencia de esteroides."[13]
Na homeostase dos fluídos corporais editar
Os glicocorticoides poderían actuar centralmente, e tamén perifericamente, para axudar na normalización do volume de fluído extracelular ao regular a acción do péptido natriurético auricular (ANP), actuando centralmente (no hipotálamo) e perifericamente (nos riles).[14][15]
No decrecemento do rceptor CB1 de cannabinoides editar
Un tratamento prolongado con glicocorticoides fai decrecer a densidade de receptores CB1 de cannabinoides CB1 no hipocampo.[16]
Mecanismo de acción editar
Transactivación editar
Os glicocorticoides únense ao receptor de glicocorticoides citosólico, un tipo de receptor nuclear que é activado pola unión dun ligando. Unha vez que unha hormona se une ao correspondente receptor, o complexo acabado de formar translócase ao núcleo celular, onde se une aos elementos de resposta aos glicocorticoides (GRE) situados na rexión promotora dos xenes diana, o que ten como resultado a regulación da expresión xénica. Este proceso denomínase xeralmente activación transcricional ou transactivación.[17][18]
As proteínas codificadas por estes xenes regulados á alza teñen unha gran variedade de efectos, incluíndo, por exemplo:[18]
- antiinflamatoria: lipocortina I, proteína de uníón á p11/calpactina, inhibidor da leucoprotease secretora 1 (SLPI), e fosfatase da proteína quinase activada por mitóxeno (MAPK fosfatase)
- aumento da gliconeoxénese: glicosa-6-fosfatase e tirosina aminotransferase.
Transrepresión editar
O mecanismo oposto denomínase represión transcricional ou transrepresión. A idea clásica sobre o funcionamento deste mecanismo é que o receptor de glicocorticoideds activado se une ao ADN no mesmo sitio onde se uniría outro factor de transcrición, o cal impide a transcrición de xenes que se transcriben grazas á actividade dese factor.[17][18] Aínda que esta interferencia ocorre, os resultados non son consistentes para todos os tipos celulares e condicións, e non hai ningún mecanismo xeral aceptado comunmente para explicar esta transrepresión.[18]
Estanse a descubrir novos mecanismos nos que a transcrición é reprimida, pero o receptor de glicocorticoides activado non interacciona co ADN, senón que interacciona directamente con outro factor de transcrición, interferindo con el, ou interacciona con outras proteínas que interfiren á súa vez coa función doutros factores de transcrición. Este último mecanismo parece ser o modo máis probable no que o receptor de glicoproteínas activado interfire co NF-κB, concretamente recrutando a histona deacetilase, a cal desacetila o ADN na rexión do promotor, o que produce o peche da estrutura da cromatina no lugar onde o NF-κB ten que unirse.[17][18]
Efectos non xenómicos editar
O receptor de glicocorticoides activado ten efectos que se demostrou experimentalmente que eran independentes de calquera efecto sobre a súa transcrición e só poden deberse á unión directa do receptor de glicocorticoides activado con outras proteínas ou co ARNm.[17][18]
Por exemplo, a Src quinase que se une ao receptor de glicocorticoides inactivo, libérase cando un glicocorticoide se une ao receptor de glicocorticoides, e fosforila unha proteína que á súa vez despraza do receptor unha proteína adaptadora, que é importante na inflamación e que é o factor de crecemento epidérmico (EGF), reducindo a súa actividade, o cal á súa vez ten como resultado a redución da formación de ácido araquidónico, unha molécula proinflamatoria clave. Este é un mecanismo polo cal os glicocorticoides teñen un efecto antiinflamatorio.[17]
Farmacoloxía editar
Para usos terapéuticos creáronse diversos glicocorticoides sintéticos, algúns moito máis potentes que o cortisol. Diferéncianse tanto na farmacocinética (factor de absorción, vida media, volume de distribución, aclaramento) coma na farmacodinámica (por exemplo a capacidade de actividade de mineralocorticoide: retención de sodio (Na+) e auga; fisioloxía renal). Como poden permear o intestino doadamente, adminístranse principalmente por vía oral, pero tamén por outros métodos, como de forma tópica sobre a pel. Máis do 90% deles únense a diferentes proteínas plasmáticas, aínda que cunha diferente especificiadde de unión. Os glicocorticoides endóxenos e algúns corticoides sintéticos teñen alta afinidade coa proteína transcortina (tamén chamada glubulina ligadora de corticosteroides), mentres que todos eles se unen á albumina sérica. No fígado, metabolízanse rapidamente por conxugación cun sulfato ou ácido glicurónico, e son segregados á urina.
A potencia, duración dos efectos e a potencia de mineralocorticoide solapada dos glicocorticoides varía. O cortisol (hidrocortisona) é o estándar para a comparación para a potencia de glicocorticoides. A hidrocortisona é o nome que se usa para as preparacións farmacéuticas do cortisol.
Os datos da táboa refírense a doses orais, excepto cando se indica outra cousa. A potencia oral pode ser menor que a parenteral porque cantidades significativas (de ata o 50% nalgúns casos) pode non ser absorbido no intestino. A fludrocortisona, DOCA (Desoxicorticosterona acetato), e a aldosterona non son, por definición, considerados glicocorticoides, aínda que poden ter unha potencia menor de glicocorticoide, e incluíronse nesta táboa para proporcionar perspectiva sobre a potencia de mineralocorticoide.
| Nome | Potencia de glicocorticoide | Potencia de mineralocorticoide | Duración da acción (t1/2 en horas) |
|---|---|---|---|
| Cortisol (hidrocortisona) | 1 | 1 | 8 |
| Cortisona | 0,8 | 0,8 | oral 8, intramuscular 18+ |
| Prednisona | 3,5-5 | 0,8 | 16-36 |
| Prednisolona | 4 | 0,8 | 16-36 |
| Metilprednisolona | 5-7,5 | 0,5 | 18-40 |
| Dexametasona | 25-80 | 0 | 36-54 |
| Betametasona | 25-30 | 0 | 36-54 |
| Triamcinolona | 5 | 0 | 12-36 |
| Beclometasona | - | - | - |
| Fludrocortisona acetato (non glicocorticoide) | 15 | 200 | 24 |
| Desoxicorticosterona acetato (DOCA) (non glicocorticoide) | 0 | 20 | - |
| Aldosterona (non glicocorticoide) | 0,3 | 200-1000 | - |
Uso terapéutico editar
Os glicocorticoides poden usarse en baixas doses na insuficiencia adrenal. A doses moito máis altas, os glicocorticoides orais ou inhalados son utilizados para suprimir varios trastornos inflamatorios, alérxicos, e autoinmunes. Os glicocorticoides inhalados son o tratamento de segunda liña para o asma. Tamén se administran como inmunosupresores postransplante para impedir o rexeitamento de transplantes agudo e a enfermidade de enxerto contra hóspede. Non obstante, non impiden unha infección e ademais inhiben o posterior proceso reparativo. Novas evidencias indican que os glicocorticoides poderían utilizarse no tratamento da insuficiencia cardíaca para incrementar a resposta renal aos péptidos diuréticos e natreiuréticos.
Substitución fisiolóxica editar
Todos os glicocorticoides poden administrarse nunha dose que proporciona aproxiadamente o mesmo efecto de glicocorticoide que a produción normal de cortisol; isto refírese a unha dose fisiolóxica, de substtución, ou de mantemento. Esta é de aproximadamente de 6–12 mg/m²/día de hidrocortisona (m² refírese aquí á área superficial corporal, e é unha medida do tamaño do corpo; esta área nun home medio é de 1,9 m²).
Inmunosupresión terapéutica editar
Ver a sección sobre "Inmunodeficiencia" máis abaixo para os efectos adversos.
Os glicocorticoides causan inmunosupresión, e o compoñente terapéutico deste efecto é principalmente o decrecemento na función e número de linfocitos, incluíndo tanto as células B coma as T.
O principal mecanismo para esta inmunosupresión é por medio da inhibición do factor nuclear amplificador da cadea lixeira kappa de células B activadas (NF-κB). O NF-κB é un factor de transcrición crítico implicado na síntese de moitos mediadores (é dicir, citocinas) e proteínas (é dicir, proteínas de adhesión) que promoven a resposta inmune. A inhibición deste factor de transcrición, por tanto, mitiga a capacidade do sistema inmunitario de realizar unha resposta.[2]
Os glicocorticoides suprimen a inmunidade celular ao inhibiren xenes que codifican as citocinas IL-1, IL-2, IL-3, IL-4, IL-5, IL-6, IL-8 e IFN-γ, a máis importante das cales é IL-2. Unha menor produción de citocinas reduce a proliferación de células T.[21]
Porén, os glicocorticoides non só reducen a proliferación de células T, senón que tamén producen outro efecto ben coñecido: a apoptose inducida por glicocorticoides. O efecto é máis acusado en células T inmaturas que aínda están no timo, pero as células T periféricas tamén son afectadas. O mecanismo exacto que regula esta sensibilidade de glicocorticoides depende do xene Bcl-2.[22]
Os glicocorticoides tamén suprimen a inmunidade humoral, o que causa unha deficiencia inmunitaria humoral. Os glicocorticoides causan que as células B expresen cantidades menores de IL-2 e de receptores de IL-2. Isto diminúe tanto a expansión clonal de células B coma a síntese de anticorpos. A diminución da cantidade de IL-2 tamén causa que se activen menos linfocitos T.
O efecto dos glicocorticoides sobre a expresión do receptor Fc en células inmunitarias é complicado. A dexametasona fai decrecer a expresión de Fc gamma RI simulado por IFN-gamma en neutrófilos mentres inversamente causa o seu incremento nos monocitos.[23] Os glicocorticoides poden tamén facer decrecer a expresión de receptores Fc en macrófagos,[24] pero as probas que apoiaban esta regulación en estudos anteriores foron cuestionadas.[25] O efecto da expresión do receptor Fc en macrófagos é importante xa que cómpre para a fagocitose das células opsonizadas. Isto é así porque os receptores Fc se unen a anticorpos unidos a células marcadas para ser destruídas por macrófagos.
Antiinflamatorio editar
Os glicocorticoides son potentes antiinflamatorios, sen importar cal sexa a causa da inflamación. O seu principal mecanismo antiinflamatorio é a síntese de lipocortina-1 (anexina-1). A lipocortina-1 suprme por un lado a fosfolipase A2, o que bloquea a produción de eicosanoides, e por outro inhibe varios eventos inflamatorios dos leucocitos (adhesión epìtelial), emigración, quimiotaxe, fagocitose, explosión respiratoria, etc). Noutras palabras, os glicocorticoides non só suprimen a resposta inmune senón que tamén inhiben os dous principais produtos da inflamación, que son as prostaglandinas e os leucotrienos. Inhiben a síntese de prostaglandinas a nivel da fosfolipase A2 e da ciclooxixenase/PGE isomerase (COX-1 e COX-2);[26] este último efecto é moisimilar ao dos AINEs, potenciando o efecto antiinflamatorio.
Os glicocorticoides comercializados como antiinflamatorios son xeralmente formulacións de uso tópico, como sprais nasais para a rinite ou inhaladores (de dose medida ou de po seco) para a asma. Estas preparacións teñen a vantaxe de que afectan só á zona onde se aplican, reducindo así os efectos laterais ou as interaccións potenciais. Neste caso, os principais compostos usados son a beclometasona, budesonide, fluticasona, mometasona e ciclesonide.[27]
Hiperaldosteronismo editar
Os glicocorticoides poden utilizarse no mantemento do hiperaldosteronismo familiar de tipo 1, aínda que non son efectivos para o tipo 2.
Resistencia editar
A resistencia do organismo ao uso terapéutico dos glicocorticoides pode presentar dificultades; por exemplo, o 25% dos casos graves de asma poden non responder aos esteroides. Isto pode ser o resultado da predisposición xenética, exposición a un produto que causa inflamación (como un alérxeno), fenómenos inmunolóxicos que sortean o efecto dos glicocorticoides, e alteracións farmacocinéticas (absorción incompleta ou excreción ou metabolismo acelerados).[21]
Insuficiencia cardíaca editar
Os glicocorticoides poderían usarse no tratamento da insuficiencia cardíaca descompensada para potenciar a sensibilidade renal aos diuréticos, especialmente en pacientes con insuficiencia cardíaca e resistencia diurética refractaria con grandes doses de diuréticos bucle.[28][29][30][31][32][33][34]
Efectos secundarios editar
Os fármacos glicocorticoides que se usan actualmente actúan de forma non selectiva, polo que a longo prazo poden alterar moitos procesos anabólicos saudables. Para impediren isto, moitas das investigacións actuais están enfocadas a elaborar fármacos glicocorticoides de acción selectiva. Os seus efectos secundarios inclúen:
- Inmunodeficiencia (ver a sección de máis abaixo).
- Hiperglicemia debida ao incremento da gliconeoxénese, resistencia á insulina, e alteración da tolerancia á glicosa ("diabete esteroidea"); deben ter precaución os pacientes de diabetes mellitus.
- Incremento da fraxilidade da pel, facilidade de sufrir negróns.
- Balance do calcio negativo debido á redución da absorción intestinal de calcio.[35]
- Osteoporose inducida por esteroides: densidade ósea reducida (osteoporose, osteonecrose, maior risco de fractura ósea, reparación das fracturas máis lenta).
- Aumento de peso debido ao incremento da deposición de graxas visceral e troncal (obesidade central) e estimulación do apetito.
- Hipercortisolemia cun uso prolongado ou excesivo (tamén chamada síndrome de Cushing exóxena).
- Alteración da memoria e déficits de atención.[36]
- Insuficiencia adrenal (se se usan durante longo tempo e se para de golpe de tomalos sen facer unha redución progresiva).
- Degradación do tecido muscular (proteólise), debilidade muscular, redución da masa muscular e da reparación muscular.
- Expansión das bolsas de graxa malares e dilatación dos pequenos vasos sanguíneos cutáneos.
- Lipomatose no espazo epidural.[37]
- Efecto excitatorio no sistema nervioso central (euforia, psicose).
- Anovulación, irregularidade nos períodos menstruais.
- Crecemento insuficiente e atraso da puberdade.
- Aumento dos aminoácidos no plasma, incremento da formación de urea, balance do nitróxeno negativo.
- Glaucoma debido a un incremento da presión intraocular.
- Cataratas
- Adición a esteroides tópicos
A altas doses, a hidrocortisona (cortisol) e os glicocorticoides con potencia apreciable de mineralocorticoide poden exercer tamén un efecto de mineralocorticoide, aínda que en doses fisiolóxicas isto é impedido pola rápida degradación do cortisol pola 11β-hidroxiesteroide deshidroxenase isoencima 2 (11β-HSD2) en tecidos diana dos mineralocorticoides. Os efectos de mineralocorticoide poden ser os seguintes: retención de auga e sales, aumento do volume do fluído extracelular, hipertensión, depleción do potasio, e alcalose metabólica.
Inmunodeficiencia editar
Os glicocorticoides causan inmunosupresión, diminuíndo a función e/ou o número de neutrófilos, linfocitos (tanto os B coma os T), monocitos, macrófagos, e a funión de barreira anatómica da pel.[38] Esta supresión, se é grande dabondo, pode causar manifestacións de inmunodeficiencia, incluíndo a deficiencia de células T, a deficiencia inmune humoral e a neutropenia.
| Bacterias | |
|---|---|
| Fungos | |
| Virus | |
| Outros |
Retirada da medicación editar
Ademais dos efectos mencionados antes, o uso de altas doses de esteroides durante máis dunha semana empeza a producir unha supresión das glándulas adrenais do paciente, porque os glicocorticoides exóxenos suprimen a hormona liberadora de corticotropina hipotalámica e a hormona adrenocorticotrópica hipofisaria. Cunha supresión prolongada, as glándulas adrenais atrófianse (encollen fisicamente), e pode tardarse meses en recuperar o seu funcionamento pleno despois de cesar a administración de glicocorticoides exóxenos.
Durante este tempo de recuperación, o paciente é vulnerable á insuficiencia adrenal durante os momentos de estrés, como pode ser unha doenza. Aínda que a dose supresiva e o tempo de recuperación adrenal varían amplamente, as directrices clínicas foron pensadas para estimar a potencial supresión e recuperación adrenais, para reducir así o risco para o paciente. Un exemplo é o seguinte:
- Se os pacientes recibiron altas doses diarias durante cinco días ou menos, a medicación pode ser parada abruptamente (ou reducida ao nivel da substitución fisiolóxica se os pacientes son adreno-deficientes). Pode asumirse que se producirá unha recuperación adrenal total unha semana despois.
- Se as altas doses se utilizaron durante de seis a dez días, unha redución á dose de substitución inmediatamente e unha maior redución progresiva durante catro ou máis días. A recuperación adrenal adoita producirse en de dúas a catro semanas desde a terminación do uso de esteroides.
- Se as doses altas se utilizaron durante de 11 a 30 días, córtanse inmediatamente ata unha dose dobre á de substitución, e despois redúcese un 25% cada catro días. Césase completamente a administración cando a dose é menos da metade que a dose de substitución fisiolóxica. A recuperación adrenal completa debería producirse en dun a tres meses de rematada a retirada da medicación.
- Se as doses altas se administraron durante máis de 30 días, córtase a dose inmediatamente ata dúas veces a dose de substitución, e redúcese un 25% cada semana ata que se chega á dose de substitución. Despois cámbiase a unha soa dose matinal de hidrocortisona ou cortisona orais, e diminúese gradualmente en 2,5 mg cada semana. Cando a dose matinal é menor que a dose de substitución, o retorno á función adrenal basal normal pode documentarse comprobando os niveis de cortisol 0800 antes da dose matinal; césase a administración cando o cortisol 0800 é de 10 μg/dL. É difícil predicir o tempo en que tarda en producirse a recuperación adrenal total despois dunha supresión prolongada exóxena por esteroides; algunhas persoas poden tardar case un ano.
- Unha reaparición da condición subxacente pola cal se administraron os esteroides pode requirir unha diminución progresiva máis gradual que a indicada antes.
Notas editar
- ↑ Pelt AC (2011). Glucocorticoids: effects, action mechanisms, and therapeutic uses. Hauppauge, N.Y.: Nova Science. ISBN 978-1617287589.
- ↑ 2,0 2,1 2,2 Rhen T, Cidlowski JA (Oct 2005). "Antiinflammatory action of glucocorticoids--new mechanisms for old drugs". The New England Journal of Medicine 353 (16): 1711–23. PMID 16236742. doi:10.1056/NEJMra050541.
- ↑ 3,0 3,1 Pazirandeh A, Xue Y, Prestegaard T, Jondal M, Okret S (May 2002). "Effects of altered glucocorticoid sensitivity in the T cell lineage on thymocyte and T cell homeostasis". FASEB Journal 16 (7): 727–9. PMID 11923224. doi:10.1096/fj.01-0891fje.
- ↑ Lupien SJ, McEwen BS, Gunnar MR, Heim C (Jun 2009). "Effects of stress throughout the lifespan on the brain, behaviour and cognition". Nature Reviews. Neuroscience 10 (6): 434–45. PMID 19401723. doi:10.1038/nrn2639.
- ↑ Cahill L, McGaugh JL (Jul 1998). "Mechanisms of emotional arousal and lasting declarative memory". Trends in Neurosciences 21 (7): 294–9. PMID 9683321. doi:10.1016/s0166-2236(97)01214-9.
- ↑ Carlson NR (2010). Physiology of Behavior (11th ed.). New York: Allyn & Bacon. pp. 605. ISBN 978-0-205-23939-9.
- ↑ Belanoff JK, Gross K, Yager A, Schatzberg AF (2001). "Corticosteroids and cognition". Journal of Psychiatric Research 35 (3): 127–45. PMID 11461709. doi:10.1016/S0022-3956(01)00018-8.
- ↑ Sapolsky RM (October 1994). "Glucocorticoids, stress and exacerbation of excitotoxic neuron death". Seminars in Neuroscience 6 (5): 323–331. doi:10.1006/smns.1994.1041.
- ↑ Lupien SJ, Maheu F, Tu M, Fiocco A, Schramek TE (Dec 2007). "The effects of stress and stress hormones on human cognition: Implications for the field of brain and cognition". Brain and Cognition 65 (3): 209–37. PMID 17466428. doi:10.1016/j.bandc.2007.02.007.
- ↑ de Quervain DJ, Roozendaal B, McGaugh JL (Aug 1998). "Stress and glucocorticoids impair retrieval of long-term spatial memory". Nature 394 (6695): 787–90. PMID 9723618. doi:10.1038/29542.
- ↑ Wolkowitz OM, Lupien SJ, Bigler ED (Jun 2007). "The "steroid dementia syndrome": a possible model of human glucocorticoid neurotoxicity". Neurocase 13 (3): 189–200. PMID 17786779. doi:10.1080/13554790701475468.
- ↑ Norra C, Arndt M, Kunert HJ (Jan 2006). "Steroid dementia: an overlooked diagnosis?". Neurology 66 (1): 155; author reply 155. PMID 16401879. doi:10.1212/01.wnl.0000203713.04232.82.
- ↑ Varney NR, Alexander B, MacIndoe JH (Mar 1984). "Reversible steroid dementia in patients without steroid psychosis". The American Journal of Psychiatry 141 (3): 369–72. PMID 6703100. doi:10.1176/ajp.141.3.369.
- ↑ Liu C, Guan J, Kang Y, Xiu H, Chen Y, Deng B, Liu K (2010). "Inhibition of dehydration-induced water intake by glucocorticoids is associated with activation of hypothalamic natriuretic peptide receptor-A in rat". PloS One 5 (12): e15607. PMC 3004933. PMID 21187974. doi:10.1371/journal.pone.0015607.
- ↑ Liu C, Chen Y, Kang Y, Ni Z, Xiu H, Guan J, Liu K (Oct 2011). "Glucocorticoids improve renal responsiveness to atrial natriuretic peptide by up-regulating natriuretic peptide receptor-A expression in the renal inner medullary collecting duct in decompensated heart failure". The Journal of Pharmacology and Experimental Therapeutics 339 (1): 203–9. PMID 21737535. doi:10.1124/jpet.111.184796.
- ↑ Hill MN, Carrier EJ, Ho WS, Shi L, Patel S, Gorzalka BB, Hillard CJ (2008). "Prolonged glucocorticoid treatment decreases cannabinoid CB1 receptor density in the hippocampus". Hippocampus 18 (2): 221–6. PMID 18058925. doi:10.1002/hipo.20386.
- ↑ 17,0 17,1 17,2 17,3 17,4 Revollo JR, Cidlowski JA (Oct 2009). "Mechanisms generating diversity in glucocorticoid receptor signaling". Annals of the New York Academy of Sciences 1179: 167–78. PMID 19906239. doi:10.1111/j.1749-6632.2009.04986.x.
- ↑ 18,0 18,1 18,2 18,3 18,4 18,5 Newton R, Holden NS (Oct 2007). "Separating transrepression and transactivation: a distressing divorce for the glucocorticoid receptor?". Molecular Pharmacology 72 (4): 799–809. PMID 17622575. doi:10.1124/mol.107.038794.
- ↑ De Liapi e Chrousos (ref. 2); Chapter 14. Glucocorticoid Therapy and Adrenal Suppression; http://www.endotext.org/adrenal/adrenal14/adrenalframe14.htm Arquivado 05 de maio de 2013 en Wayback Machine.
- ↑ Leung DY, Hanifin JM, Charlesworth EN, Li JT, Bernstein IL, Berger WE, Blessing-Moore J, Fineman S, Lee FE, Nicklas RA, Spector SL (Sep 1997). "Disease management of atopic dermatitis: a practice parameter. Joint Task Force on Practice Parameters, representing the American Academy of Allergy, Asthma and Immunology, the American College of Allergy, Asthma and Immunology, and the Joint Council of Allergy, Asthma and Immunology. Work Group on Atopic Dermatitis" (PDF). Annals of Allergy, Asthma & Immunology 79 (3): 197–211. PMID 9305225. doi:10.1016/S1081-1206(10)63003-7.
- ↑ 21,0 21,1 Leung DY, Bloom JW (Jan 2003). "Update on glucocorticoid action and resistance". The Journal of Allergy and Clinical Immunology 111 (1): 3–22; quiz 23. PMID 12532089. doi:10.1067/mai.2003.97.
- ↑ Banuelos J, Shin S, Cao Y, Bochner BS, Morales-Nebreda L, Budinger GR, Zhou L, Li S, Xin J, Lingen MW, Dong C, Schleimer RP, Lu NZ (Jan 2016). "BCL-2 protects human and mouse Th17 cells from glucocorticoid-induced apoptosis". Allergy. PMID 26752231. doi:10.1111/all.12840.
- ↑ Pan LY, Mendel DB, Zurlo J, Guyre PM (1990). "Regulation of the steady state level of Fc gamma RI mRNA by IFN-gamma and dexamethasone in human monocytes, neutrophils, and U-937 cells". Journal of Immunology (Baltimore, Md. : 1950) 145 (1): 267–75. PMID 2141616.
- ↑ Ruiz P, Gomez F, King M, Lopez R, Darby C, Schreiber AD (1991). "In vivo glucocorticoid modulation of guinea pig splenic macrophage Fc gamma receptors". The Journal of Clinical Investigation 88 (1): 149–57. PMC 296015. PMID 1829095. doi:10.1172/JCI115271.
- ↑ Werb Z (1980). "Hormone receptors and normal regulation of macrophage physiological function". En van Furth R. Mononuclear phagocytes functional aspects. The Hague: M. Nijhoff. p. 825. ISBN 978-94-009-8793-7.
Os glicocorticoides poden tamén facer decrecer o número de receptores Fc nos macrófagos, pero esta función inmunosupresora é controvertida debido á falta de sensibilidade das técnicas do receptor Fc e a alta concentración de glicocorticoides usados en experimentos previos.
- ↑ Goppelt-Struebe M, Wolter D, Resch K (Dec 1989). "Glucocorticoids inhibit prostaglandin synthesis not only at the level of phospholipase A2 but also at the level of cyclo-oxygenase/PGE isomerase". British Journal of Pharmacology 98 (4): 1287–95. PMC 1854794. PMID 2514948. doi:10.1111/j.1476-5381.1989.tb12676.x.
- ↑ Flower R, Rang HP, Dale MM, Ritter JM (2007). Rang & Dale's pharmacology. Edinburgh: Churchill Livingstone. ISBN 0-443-06911-5.
- ↑ Rado JP, Blumenfeld G, Hammer S (Nov 1959). "The effect of prednisone and 6-methylprednisolone on mercurial diuresis in patients with refractory cardiac edema". The American Journal of the Medical Sciences 238: 542–51. PMID 14435747.
- ↑ Riemer AD (Apr 1958). "Application of the newer corticosteroids to augment diuresis in congestive heart failure". The American Journal of Cardiology 1 (4): 488–96. PMID 13520608. doi:10.1016/0002-9149(58)90120-6.
- ↑ Newman DA (Feb 1959). "Reversal of intractable cardiac edema with prednisone". New York State Journal of Medicine 59 (4): 625–33. PMID 13632954.
- ↑ Zhang H, Liu C, Ji Z, Liu G, Zhao Q, Ao YG, Wang L, Deng B, Zhen Y, Tian L, Ji L, Liu K (Sep 2008). "Prednisone adding to usual care treatment for refractory decompensated congestive heart failure". International Heart Journal 49 (5): 587–95. PMID 18971570. doi:10.1536/ihj.49.587.
- ↑ Liu C, Liu G, Zhou C, Ji Z, Zhen Y, Liu K (Sep 2007). "Potent diuretic effects of prednisone in heart failure patients with refractory diuretic resistance". The Canadian Journal of Cardiology 23 (11): 865–8. PMC 2651362. PMID 17876376. doi:10.1016/s0828-282x(07)70840-1.
- ↑ Liu C, Chen H, Zhou C, Ji Z, Liu G, Gao Y, Tian L, Yao L, Zheng Y, Zhao Q, Liu K (Oct 2006). "Potent potentiating diuretic effects of prednisone in congestive heart failure". Journal of Cardiovascular Pharmacology 48 (4): 173–6. PMID 17086096. doi:10.1097/01.fjc.0000245242.57088.5b.
- ↑ Massari F, Mastropasqua F, Iacoviello M, Nuzzolese V, Torres D, Parrinello G (Mar 2012). "The glucocorticoid in acute decompensated heart failure: Dr Jekyll or Mr Hyde?". The American Journal of Emergency Medicine 30 (3): 517.e5–10. PMID 21406321. doi:10.1016/j.ajem.2011.01.023.
- ↑ Gennari C (May 1993). "Differential effect of glucocorticoids on calcium absorption and bone mass". British Journal of Rheumatology. 32 Suppl 2: 11–4. PMID 8495275. doi:10.1093/rheumatology/32.suppl_2.11.
- ↑ Keenan PA, Jacobson MW, Soleymani RM, Mayes MD, Stress ME, Yaldoo DT (Dec 1996). "The effect on memory of chronic prednisone treatment in patients with systemic disease". Neurology 47 (6): 1396–402. PMID 8960717. doi:10.1212/WNL.47.6.1396.
- ↑ Koch CA, Doppman JL, Patronas NJ, Nieman LK, Chrousos GP (Apr 2000). "Do glucocorticoids cause spinal epidural lipomatosis? When endocrinology and spinal surgery meet". Trends in Endocrinology and Metabolism 11 (3): 86–90. PMID 10707048. doi:10.1016/S1043-2760(00)00236-8.
- ↑ 38,0 38,1 Klein NC, Go CH, Cunha BA (Jun 2001). "Infections associated with steroid use". Infectious Disease Clinics of North America 15 (2): 423–32, viii. PMID 11447704. doi:10.1016/s0891-5520(05)70154-9.
Véxase tamén editar
Outros artigos editar
- Mineralocorticoide
- Receptor de glicocorticoides
- Receptor de glicocorticoides de membrana
- Antiinflamatorios non esteroideos (AINE)
Ligazóns externas editar
- Glucocorticoids Medical Subject Headings (MeSH) na Biblioteca Nacional de Medicina dos EUA.
- Bowen R (2006-05-26). "Glucocorticoids". Colorado State University. Consultado o 2008-05-11.
- Wolkowitz OM, Burke H, Epel ES, Reus VI (Oct 2009). "Glucocorticoids. Mood, memory, and mechanisms". Annals of the New York Academy of Sciences 1179: 19–40. PMID 19906230. doi:10.1111/j.1749-6632.2009.04980.x.