Replicación do ADN
A replicación do ADN é o proceso de producir dúas réplicas idénticas a partir dunha molécula orixinal de ADN. Este proceso biolóxico ocorre en todos os organismos vivos e é a base da herdanza biolóxica. Na replicación interveñen moitos encimas. O ADN está constituído por dúas febras e cada febra da molécula de ADN orixinal serve como molde para a produción da febra complementaria, un proceso denominado replicación semiconservadora (ou semiconservativa), polo cal cada molécula replicada conserva unha febra orixinal e leva unha febra sintetizada nova. Os mecanismos celulares de corrección de probas e de comprobación de erros aseguran que a replicación se realice cunha fidelidade case perfecta. Unha replicación imperfecta do ADN dá lugar a mutacións.[1][2]
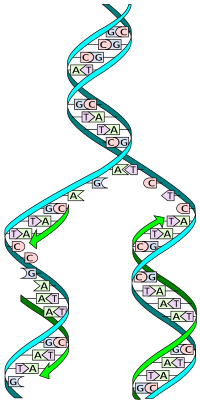
Na célula, a replicación do ADN empeza en lugares específicos do xenoma chamados orixes de replicación.[3] O desenrolamento do ADN nas orixes de replicación e a síntese de novas febras forma dúas forquitas de replicación que crecen de forma bidireccional desde a orixe. Diversas proteínas que están asociadas á forquita de replicación axudan na iniciación e continuación da síntese do ADN. A máis salientable delas é a ADN polimerase, que sintetiza o novo ADN engadindo nucleótidos complementarios aos da febra molde.
A replicación do ADN pode tamén realizarse in vitro (artificialmente, fóra da célula). Poden utilizarse as ADN polimerases illadas das células e os cebadores (primers) de ADN artificiais para iniciar a síntese de ADN en secuencias coñecidas dunha molécula de ADN molde. A reacción en cadea da polimerase (PCR), que é unha técnica de laboratorio moi común, aplica ciclicamente a síntese artificial para amplificar a cantidade de copias dun fragmento de ADN diana específico entre un conxunto de ADNs.
Estruturas do ADN
editar- Artigo principal: ADN.
O ADN normalmente ten unha estrutura bicatenaria na que as dúas cadeas ou febras se trenzan entre si formando a característica dobre hélice. Cada febra do ADN é unha cadea formada por catro tipos de nucleótidos, cada un dos cales contén o azucre desoxirribosa, un fosfato, e unha base nitroxenada ou nucleobase (hai catro: adenina, citosina, guanina, e timina, abreviadas como A, C, G e T). A adenina e guanina do ADN son purinas, mentres que a citosina e a timina son pirimidinas. Estes nucleótidos forman enlaces fosfodiéster, creando o esqueleto desoxirribosa-fosfato da dobre hélice do ADN, mentres que as nucleobases están situadas na parte interior da hélice. As bases dos nucleótidos son complementarias coas da febra oposta e enlázanse coas de enfronte por pontes de hidróxeno para formar pares de bases. Os pares son A=T (con dúas pontes de hidróxeno), e C≡G (con tres pontes de hidróxeno).
As febras de ADN teñen unha direccionalidade, e os dous extremos dunha febra monocatenaria denomínanse "extremo 3' (tres prima)" e "extremo 5' (cinco prima)". Por convención, se se dá a secuencia de bases dunha febra monocatenaria do ADN, o extremo esquerdo da secuencia é o 5', e á dereita estará o extremo 3'. As febras dunha dobre hélice son antiparalelas, e unha delas vai de 5' a 3' mentres que a febra oposta vai de 3' a 5'. Os números destes termos refírense ao átomo de carbono da desoxirribosa ao cal se une o seguinte fosfato da cadea. A direccionalidade ten consecuencias na síntese de ADN, porque a ADN polimerase só pode sintetizar o ADN nunha dirección engadindo nucleótidos ao extremo 3' dunha febra de ADN (a síntese do ADN é en dirección 5'-3').
O apareamento de bases complementarias no ADN por medio de pontes de hidróxeno significa que a información contida en cada febra é redundante. Os nucleótidos dunha febra sinxela poden utilizarse para reconstruír nucleótidos sobre a febra de nova síntese complementaria.[4]
ADN polimerase
editar- Artigo principal: ADN polimerase.
As ADN polimerases son unha familia de encimas que levan a cabo todas as formas de replicación do ADN.[6] As ADN polimerases en xeral non poden iniciar a síntese de novas febras partindo de cero, senón que só poden estender unha febra de ADN ou ARN xa existente apareada cunha febra molde. Para empezar a síntese, debe crearse un curto fragmento de ARN, chamado cebador ou primer, que se aparea coa febra molde do ADN.
A ADN polimerase engade unha nova febra de ADN estendendo o extremo 3' dunha cadea de nucleótidos existente, engadindo a ela un a un novos nucleótidos que son complementarios cos da febra molde por medio da creación de enlaces fosfodiéster. Os nucleótidos necesarios chegan á zona de síntese do ADN en forma de nucleósidos trifosfato, pero incorpóranse ao ADN en forma de nucleótidos (monofosfato). Precisamente, a enerxía para este proceso de polimerización do ADN procede da hidrólise dos enlaces fosfoanhidro de fosfato de alta enerxía entre os tres fosfatos dos nucleósidos trifosfato. (propiamente falando os nucleótidos teñen un só fosfato, e se teñen máis denomínanse nucleósidos difosfato ou trifosfato). Cando se engade un nucleótido a unha febra de ADN en crecemento, a formación dun enlace fosfodiéster entre o fosfato proximal do nucleótido á cadea en crecemento vai acompañado da hidrólise dun enlace de alta enerxía coa liberción dos dous fosfatos distais en forma de pirofosfato. A hidrólise encimática do pirofosfato resultante en dous fosfatos inorgánicos separados consome un segundo enlace fosfato de alta enerxía e fai que a reacción sexa irreversible.[7]
En xeral, as ADN polimerases son moi exactas na súa actividade de replicación, e teñen unha taxa de erro intrínseca de menos dun erro por cada 107 nucleótidos engadidos.[8] Ademais, algunhas ADN polimerases teñen tamén unha capacidade de corrección de probas, polo que poden quitar nucleótidos do extremo dunha febra en crecemento para corrixir as bases mal apareadas. Finalmente, os mecanismos de reparación de erros de apareamento post-replicación revisan os erros que poida ter o ADN, e son quen de distinguir erros de apareamento que hai na febra de nova síntese con respecto á secuencia da febra orixinal. En conxunto, estes tres pasos de discriminación permiten unha fidelidade de replicación de menos dun erro por cada 109 nucleótidos engadidos.[8]
A taxa de replicación do ADN nunha célula viva foi medido como a taxa de elongación do ADN do fago T4 na bacteria Escherichia coli infectada polo fago.[9] Durante o período de incremento de ADN exponencial a 37 °C, a velocidade é de 749 nucleótidos por segundo. A taxa de mutación por par de bases por replicación durante a síntese do ADN do fago T4 é de 1,7 por 108.[10] Esta replicación é, pois, abraiantemente rápida e exacta.
Replicación semiconservadora
editar- Artigo principal: Experimento de Meselson e Stahl.
a) Conservadora
b) Dispersante
c) Semiconservadora.
Na década de 1950 había tres hipóteses sobre a replicación do ADN en canto á conservación das febras orixinais nas moléculas replicadas. Estas hipóteses eran as seguintes:
- Hipótese semiconservadora ou semiconservativa (modelo aceptado hoxe). En cada unha das moléculas replicadas consérvase unha das febras completas orixinais, mentres que a outra febra é de nova síntese.
- Hipótese conservadora ou conservativa. Sintetízase unha molécula totalmente nova (coas dúas febras de nova síntese), copia da orixinal.
- Hipótese dispersante ou dispersiva. As cadeas replicadas constan de fragmentos da cadea antiga e de fragmentos de nova síntese.
O experimento de Meselson e Stahl realizado na bacteria Escherichia coli en 1958 demostrou que a hipótese correcta era a semiconservadora, é dicir, cada molécula de ADN replicada ten unha febra completa orixinal e unha febra completa de nova síntese.
Proceso de replicación
editar- Artigos principais: Replicación do ADN procariótica e Replicación do ADN eucariótica.
A replicación do ADN, como todos os procesos de polimerización biolóxica, ten lugar por medio de tres etapas coordinadas e catalizadas encimaticamente, que son: iniciación, elongación e terminación.
Iniciación
editarPara que se divida unha célula debe primeiro replicarse o seu ADN.[11] Este proceso iníciase en puntos concretos do ADN chamados orixes de replicación, que son a diana de certas proteínas iniciadoras.[3] En E. coli esta proteína é DnaA (escrito con minúscula); en lévedo, é o complexo de recoñecemento da orixe.[12] As secuencias usadas como dianas polas proteínas iniciadoras adoitan ser ricas en AT (adenina e timina), porque os pares A-T teñen dúas pontes de hidróxeno (en vez das tres que forman a unión máis forte do par CG), polo que son fáciles de romper para abrir nese punto o ADN como unha cremalleira.[13] Unha vez que se localiza a orixe, estes iniciadores recrutan outras proteínas e forman o complexo de pre-replicación, que desenrola o ADN bicatenario. A partir da orixe fórmanse dúas forquitas de replicación que avanzan en direccións opostas, polo que a replicación é bidireccional. A zona entre estas dúas forquitas denomínase burbulla de replicación.
Elongación
editarA ADN polimerase ten unha actividade 5'-3'. Todos os sistemas de replicación do ADN coñecidos requiren un grupo 3'-hidroxilo libre para que se poida iniciar a síntese (Nota: o ADN é lido en dirección 3' a 5' mentres que a nova febra sintetízase na dirección 5' a 3'). Distínguense catro mecanismos de iniciación da síntese, que son:
- Todas as formas de vida celulares e moitos virus de ADN, fagos plásmidos usan unha encima primase para sintetizar un curto cebador de ARN cun grupo 3'-OH que despois vai ser elongado por unha ADN polimerase.
- Os retroelementos (como os retrovirus) empregan un ARN de transferencia que ceba a replicación do ADN ao proporcionar un 3′-OH libre que se utiliza para a elongación pola transcriptase inversa.
- Nos adenovirus e na familia φ29 de bacteriófagos, o grupo 3'-OH proporciónao a cadea lateral dun aminoácido dunha proteína unida ao xenoma (a proteína terminal), e a este grupo a ADN polimerase engade os nucleótidos para formar a nova febra.
- Nos virus de ADN monocatenario (entre os que están os circovirus, os xeminivirus, os parvovirus e outros) e tamén nos moitos fagos e plásmidos que utilizan o mecanismo de replicación de círculos rodantes (RCR), a endonuclease RCR crea unha amosega na febra do xenoma (en virus monocatenarios) ou nunha das dúas febras do ADN (en plásmidos). O extremo 5′ da febra coa amosega é transferida a un residuo de tirosina da nuclease e despois o grupo 3′-OH libre é utilizado pola ADN polimerase para sintetizar a nova febra.
O primeiro destes mecanismos é o mellor coñecido e é o utilizado polos organismos celulares. Neste mecanismo, unha vez que as dúas febras están separadas, a primase engade cebadores de ARN a febras molde. A febra guía (líder, condutora ou continua) recibe un cebador de ARN mentres que a febra retardada (ou descontinua) recibe varios. A ADN polimerase estende a febra guía de forma continua desde o cebador con alta procesividade, mentres que a febra retardada esténdese de forma descontinua desde cada un dos cebadores, formando fragmentos de Okazaki (de aí que tamén se chamen febra continua e descontinua). A RNase retira os fragmentos de cebador de ARN, e unha ADN polimerase de baixa procesividade distinta da polimerase replicativa entra para encher con ADN os ocos onde estaban os cebadores. Cando isto se completa, atópase unha soa amosega na febra guía e varias amosegas na febra retardada. Un encima ligase actúa agora para encher estas amosegas, completando así a nova molécula de ADN replicada. Por tanto, a febra retardada ou descontinua, que estaba formada por fragmentos de Okazaki separados, faise finalmente continua.
A primase usada neste proceso difire significativamente entre bacterias e arqueas/eucariotas. As bacteias usan unha primase que pertence á superfamilia da proteína DnaG, que contén un dominio catalítico de tipo pregamento TOPRIM.[14] O pregamento TOPRIM contén unha parte central α/β con catro febras conservadas nunha topoloxía de tipo Rossmann. Esta estrutura tamén se encontra nos dominios catalíticos da topoisomerase Ia, topoisomerase II, a familia OLD de nucleases e nas proteínas de reparación do ADN relacionadas coa proteína RecR.
A primase utilizada por arqueas e eucariotas contén unha versión moi conservada derivada do motivo de recoñecemento do ARN (RRM). Esta primase é estruturalmente similar a moitas ARN polimerases dependentes de ARN virais, transcriptases inversas, ciclases xeradoras de nucleótidos cíclicos e ADN polimerases das familias A/B/Y que están implicadas na replicación e reparación do ADN. Na replicación eucariota, a primase forma un complexo coa Pol α.[15]
No proceso de replicación do ADN as ADN polimerases teñen diferentes papeis. En E. coli, a ADN Pol III é o encima polimerase principal responsable da replicación do ADN. Ensámblase no complexo de replicación na forquita de replicación que presenta unha procesividade extremadamente alta, e permanece intacto en todo o ciclo de replicación. Ao contrario, a ADN Pol I é o encima responsable da substitución dos cebadores de ARN por ADN. A ADN Pol I ten unha actividade de exonuclease 5' a 3' ademais da súa actividade de polimerase, e usa a súa actividade exonuclease para degradar os cebadores de ARN por diante del a medida que estende a febra de ADN por detrás del, nun proceso chamado traslado de amosega (nick translation). A Pol I é moito menos procesiva que a Pol III porque a súa función principal na replicación do ADN é crear moitos tramos de ADN curtos e non uns poucos tramos moi longos.
En eucariotas, o encima de baixa procesividade Pol α, axuda a iniciar a replicación. Os encimas de alta procesividade son a Pol δ e a Pol ε.
A medida que continúa a síntese de ADN, as febras de ADN orixinais seguen desenrolándose a cada lado da burbulla de replicación, formando unha forquita de replicación con dous brazos. Nas bacterias, que teñen unha única orixe de replicación no seu cromosoma circular, este proceso xera unha "estrutura en theta" (que lembra á letra grega theta, θ). Ao contrario, os eucariotas teñen cromosomas máis longos e lineares e inician a replicación desde moitas orixes en cada cromosoma.[16]
Forquita de replicación
editara: molde, b: febra guía, c: febra retardada, d: forquita de replicación, e: cebador, f: fragmento de Okazaki.
A forquita de replicación ou forcada de replicación é unha estrutura que se forma no núcleo durante a replicación do ADN. É creada pola acción das helicases, que rompen as pontes de hidróxeno que mantiñan unidas as dúas febras do ADN. A estrutura resultante ten dúas ramificacións ou brazos da forquita, cada unha constituída por unha soa febra do ADN. Estas dúas febras serven como moldes para as fibras guía e retardada, que se crean cando a ADN polimerase introduce nucleótidos complementarios sobre os moldes; os moldes poden denominarse molde da febra guía e molde da febra retardada.
O ADN sempre se sintetiza en dirección 5' a 3'. Como os moldes das febras guía e retardada están orientados en direccións opostas na forquita de replicación, un importante problema é conseguir sintetizar a febra do ADN retardada nacente (nova), cuxa dirección de síntese é oposta á dirección de crecemento da forquita de replicación.
Febra guía
editarA febra guía (ou líder ou condutora ou continua) é a febra do ADN nacente que está sendo sintetizada na mesma dirección en que avanza a forquita de replicación en crecemento. Unha polimerase fai a "lectura" da febra guía molde e engade nucleótidos complementarios á febra guía nacente de forma continua.
A polimerase implicada na síntese da febra guía é a ADN polimerase III (ADN Pol III) en procariotas e a Pol δ en eucariotas.[17] A Pol ε pode substituír a Pol δ en circunstancias especiais.[18]
Febra retardada
editarA febra retardada (ou atrasada ou descontinua) é a febra de ADN nacente cuxa dirección de síntese é oposta á dirección de crecemento da forquita de replicación. Debido a esta orientación, a replicación da febra retardada é máis complicada comparada coa da febra guía.
A febra retardada sintetízase en segmentos curtos separados (descontinuos). Sobre a febra retardada molde, unha primase "le" o mode de ADN e inicia a síntese dun cebador de ARN curto complementario. Unha ADN polimerase estende os segmentos cebados, formando fragmentos de Okazaki (que constan de ARN e ADN). Os cebadores de ARN son despois eliminados e substituídos por ADN, polo que todo o fragmento de Okazaki é agora de ADN, e os fragmentos de ADN separados son unidos por unha ADN ligase formando unha febra continua.
A responsable da extensión (con ADN) dos cebadores (de ARN) engadidos durante a replicación da febra retardada é a ADN polimerase III (en procariotas) ou a Pol δ (en eucariotas). A eliminación dos cebadores realízaa a ADN polimerase I (en procariotas) e a Pol δ (en eucariotas).[19] A primase eucariota é intrínseca á Pol α.[20] En eucariotas, a Pol ε axuda á reparación durante a replicación do ADN.
Dinámica da forquita de replicación
editarA medida que a helicase desenrola o ADN na forquita de replicación, o ADN que está por diante é obrigado a rotar. Este proceso ten como resultado unha acumulación de retorceduras no ADN que está diante.[21] Esta acumulación forma unha resistencia torsional que finalmente faría deter o avance da forquita de replicación. As topoisomerases son ecimas que rompen temporalmente as febras de ADN, aliviando a tensión causada polo desenrolamento das dúas febras da hélice de ADN; as topoisomerases (como a ADN xirase) conseguen isto ao engadir superenrolamentos negativos á hélice de ADN.[22]
Os ADN monocatenarios espidos tenden a pregarse sobre si mesmos formando estruturas secundarias; estas estruturas poden interferir co movemento da ADN polimerase. Para evitar isto, únese ao ADN unha proeínas de unión á febra sinxela ata que se sintetiza unha segunda febra, o que impide a formación da mencionada estrutura secundaria.[23]
As proteínas abrazadeira forman unha abrazadeira escorregante arredor do ADN, o que axuda á ADN polimerase a manter o contacto co seu molde, o que contribúe á procesividade. A cara interna da abrazadeira permite que o ADN se enfíe a través dela. Unha vez que a polimerase chega ao final do molde ou detecta ADN bicatenario, a abrazadeira escorregante sofre un cambio conformacional que libera a ADN polimerase. As proteínas de carga da abrazadeira utilízanse para cargar inicialmente a abrazadeira sobre o ADN, xa que rcoñecen a zona de unión entre o molde e os cebadores de ARN.[2]:274-5
Proteínas que inteveñen na replicación do ADN
editarNa forquita de replicación, ensámblanse moitos encimas sobre o ADN formando unha máquina molecular complexa chamada replisoma en moitos organismos. A seguinte é unha lista dos principais encimas de replicación que forman parte do replisoma:[24]
| Encima | Función na replicación do ADN |
|---|---|
| ADN helicase | Tamén chamada encima desestabilizane da hélice. Desenrola a dobre hélice do ADN na forquita de replicación. |
| ADN polimerase | Constrúe unha nova febra de ADN dúplex ao engadir nucleótidos en dirección 5' a 3'. Tamén realiza a corrección de probas e corrección de erros. Existen moitos tipos diferentes de ADN polimerase, cada unha das cales realiza diferentes funcións en distintos tipos de células. |
| Abrazadeira do ADN (DNA clamp) | Unha proteína que impide que as ADN polimerases que realizan a elongación se disocien da febra de ADN parental. |
| Proteínas de unión á febra sinxela (Single-Strand Binding ou SSB) | Únense ao ADN monocatenario e impiden que o ADN de hélice sinxela volva a formar ADN bicatenario (impide o re-annealing) unha vez que a ADN helicase o desenrolou, mantendo así a separación das dúas febras, e facilitando a síntese da febra nacente. |
| Topoisomerase | Relaxa o ADN do seu estado superenrolado. |
| ADN xirase | Alivia a tensión do desenrolamento causado pola ADNA helicase; este é un tipo específico de topoisomerase |
| ADN ligase | Volve a enrolar (re-anneal) as febras semiconservadoras e une os fragmentos de Okazaki da febra retardada. |
| Primase | Proporciona un punto de iniciación no ARN (ou ADN) para que a ADN polimerase comece a síntese da nova febra de ADN. |
| Telomerase | Alonga o ADN telomérico ao engadir secuencias de nucleótidos repetitivas aos extremos dun cromosoma eucariota. Isto permite que as células xerminais e as células nai eviten o límite de Hayflick en canto ao número de divisións celulares posibles.[25] |
Maquinaria de replicación
editarAs maquinarias de replicación constan de factores implicados na replicación do ADN e aparecen nas febras monocatenarias molde do ADN. As maquinarias de replicación inclúen os primosotores, que son encimas de replicación, como os seguintes: ADN polimerase, ADN helicases, abrazadeiras do ADN e ADN topoisomerases, e tamén as proteínas de replicación, como por exemplo as proteínas de unión á febra sinxela do ADN (SSB). Nas maquinarias de replicación estes compoñentes coordínanse. Na maioría das bacterias, todos os factores implicados na replicación do ADN están localizados en forquitas de replicación e os complexos permanecen nas forquitas durante a replicación do ADN. Estas maquinarias de replicación denomínanse replisomas ou sistemas de ADN replicase, termos que orixinalmente se aplicaban de forma xenérica ás proteínas localizadas nas forquitas de replicación. Non obstante, nas células eucariotas e nalgunhas células bacterianas non se forman replisomas.
Como as maquinarias de replicación non se moven do seu sitio en relación ao ADN molde, estas fábricas ou factorías denomínanse factorías de replicación.[26] Nunha imaxe descritiva alternativa, as factorías de ADN son similares a proxectores, e os ADNs son como filmes cinematográficos que van pasando continuamente polos proxectores. No modelo da factoría de replicación, despois de que ambas as ADN helicases para a febra retardada e a guía se cargan nos ADNs molde, as helicasaes móvense ao longo dos ADNs unha en dirección á outra ata que chocan. As helicases permanecen asociadas durante o resto do proceso de replicación. Peter Meister et al. observaron os sitios de replicación directamente no lévedo de xemación monitorizando ADN polimerases α etiquetadas con proteína fluorescente verde (GFP). Detectaron a replicación do ADN de pares de loci etiquetados espazados simetricamente desde unha orixe de replicación e atoparon que a distancia entre os pares diminuía marcadamente co tempo.[27] Este descubrimento indica que o mecanismo da replicación do ADN funciona con dúas factorías de ADN. É dicir, cárganse parellas de factorías de replicación nas orixes de replicación e as factorías asócianse unha coa outra. Ademais, os ADNs molde móvense ás factorías, o cal produce unha extrusión dos ADNs monocatenarios molde e os ADNs nacentes. O descubrimento de Meister é a primeira proba directa do modelo da factoría de replicación. Posteriores investigacións indicaron que as ADN helicases forman dímeros en moitas células eucariotas e as maquinarias de replicación bacterianas permanecen nunha soa localización intranuclear durante a síntese de ADN.[26]
As factorías de replicación realizan o desenredo das cromátides irmás. Este desenredo é esencial para distribuír as cromátides nas células fillas despois da replicación do ADN. Como as cromátides fillas despois da replicación do ADN se manteñen unidas entre si por medio de aneis de proteínas cohesinas, a única oportunidade que hai de desenredalas é na replicación do ADN. A fixación de maquinarias de replicación como factorías de replicación pode mellorar a taxa de éxito na replicación do ADN. Se a forquita de replicación se movese libremente nos cromosomas, a catenación de núcleos agravaríase e impediría a segregación mitótica.[27]
Terminación
editarOs eucariotas inician a replicación do ADN en múltiples puntos do cromosoma, e modo que as forquitas de replicación acaban encontrándose e terminanado en moitos puntos do cromosoma; estes non se sabe que estean regulados de ningún modo particular. Como os eucariotas teñen cromosomas lineares, a replicación do ADN non pode chegar ao punto final máis extremo dos cromosomas, senón que acaba un pouco antes na rexión do telómero que é unha zona de ADN repetitivo preto dos extremos. Isto acurta os telómeros da febra de ADN filla. O acurtamento dos telómeros é un proceso normal nas células somáticas. Como resultado, as células só poden dividirse un certo número de veces antes de que a mencionada perda de ADN impida máis divisións (isto denomínase límite de Hayflick). Nas células da liña xerminal, que pasan ao ADN á seguinte xeración, o encima telomerase estende as secuencias repetitivas da rexión do telómero para impedir a súa degradación. A telomerase non está normalmente activa nas células somáticas, pero en ocasións pode estalo por erro, o que podería orixinar a formación dun cancro. Unha actividade da telomerase incrementada é unha das marcas distintivas do cancro.
A terminación require que o progreso da forquita de replicación do ADN deba parar ou ser bloqueado. A teminación nun locus específico, cando ocorre, implica a interacción entre dous compoñentes: (1) unha secuencia de sitio de terminación no ADN, e (2) unha proteína que se une a esta secuencia para deter fisicamente a replicación do ADN. En varias especies de bacterias, esta denomínase proteína de unión ao sitio de termo da replicación ou proteína Ter.
Como as bacterias teñen cromosomas circulares, a terminación da replicación ocorre cando se encontran dúas forquitas de replicación no extremo oposto do cromosoma parental. E. coli regula este proceso utilizando secuencias de terminación que, cando se unen á proteína Tus, só permiten que pase unha dirección de forquita de replicación. Como resultado, as forquitas de replicación están obrigadas a encontrarse sempre na rexión de terminación do cromosoma.[28]
Regulación
editarEucariotas
editarNos eucariotas, a replicación do ADN está controlada no contexto do ciclo celular. A medida que a célula crece e se divide, progresa a través das distintas fases do ciclo celular. A replicación do ADN ten lugar durante a fase S (fase de síntese de ADN). O avance da célula eucariota polas sucesivas fases do ciclo está controlado por puntos de control do ciclo celular. A progresión por estes puntos de control (checkpoints) está controlada por complexas interaccións entre varias proteínas, entre as que están as ciclinas e as quinases dependentes de ciclina.[29] A diferenza das bacterias, o ADN eucariota replícase dentro dos límites do núcleo (pero hai tamén ADN nas mitocondrias e cloroplastos).[30]
O punto de control G1/S (ou punto de control de restrición) regula se a célula eucariota entrará no proceso de replicación do ADN e na subseguinte división. As células que nunca avanzan alén deste punto de control permanecen no estado G0 e non replican o seu ADN.
As replicacións dos xenomas do cloroplasto e mitocondrial ocorren independentemente do ciclo celular, por medio do proceso da replicación de bucle D.
Foco de replicación
editarEn células de vertebrados, os sitios de replicación concéntranse en localizacións chamadas focos de replicación.[27] Os sitios de replicación poden ser detectados por inmunomarcaxe das febras fillas e encimas de replicación monitorizan os factores de replicación etiquetados con GFP. Utilizando estes métodos encontrouse que na fase S do ciclo celular aparecen focos de replicación de varios tamaños e posicións e o seu número por núcleo é moito menor que o número de forquitas de replicación xenómicas.
P. Heun et al.(2001) rastrexaron os focos de replicación etiquetados con GFP en células de lévedo de xemación e atoparon que as orixes de replicación se moven constantemente nas fases G1 e S e a súa dinámica decrece significativamente na fase S.[27] Tradicionalmente, pensábase que os sitios de replicación eran fixados na estrutura espacial dos cromosomas pola matriz nuclear ou proteínas laminas. Os resultados de Heun negan este concepto tradicional, xa que os lévedos de xemación non teñen laminas, e os seus datos apoian que as orixes de replicación se autoensamblan e forman focos de replicación.
A formación de focos de replicación está regulada polo disparo (inicio da replicación) das orixes de replicación, controlado espacial e temporalmente. D. A. Jackson et al.(1998) revelaron que as orixes veciñas dispáranse simultaneamente nas células de mamíferos.[27] A xustaposición espacial dos sitios de replicación produce o agrupamento das forquitas de replicación. A agrupación rescata as forquitas de replicación bloqueadas e favorece o progreso normal das forquitas de replicación. O progreso das forquitas de replicación é inhibido por moitos factores, como a colisión con proteínas ou con complexos que se unen fortemente ao ADN, a deficiencia de desoxirribonucleósidos trifosfato (dNTPs), as amosegas nos moldes de ADN etc. Se as forquitas de replicación quedan bloqueadas e as secuencias restantes a partir da forquita bloqueada non son replicadas, as febras fillas teñen sitios non replicados obtidos en amosegas. Os sitios non replicados nas febras parentais manteñen as outras febras unidas pero non as febras fillas. Por tanto, as cromátides irmás resultantes non poden separarse xuntas e non poden repartirse entre as dúas células fillas. Cando as orixes veciñas se disparan e a forquita a partir dunha das orixes queda bloqueaa, unha forquita que partiu doutra orixe accede en dirección oposta á da forquita bloqueada e duplica os sitios non replicados.
Bacterias
editarA maioría das bacterias non pasan por un ciclo celular ben definido senón que copian continuamente o seu ADN; durante o seu rápido crecemento, isto pode ter como resultado que se produzan concorrentemente moitas roldas de replicación.[31] En E. coli, que é a bacteria mellor estudada, a replicación do ADN está regulada por varios mecanismos, incluíndo os seguintes: a hemimetilación e secuestro da secuencia de orixe, a proporción de ATP con respecto ao ADP, e os niveis da proteína DnaA. Todo isto controla a unión de proteínas iniciadoras ás secuencias de orixe.
Como E. coli metila as secuencias GATC do ADN, a síntese de ADN dá lugar a secuencias hemimetiladas. Este ADN hemimetilado é recoñecido pola proteína SeqA, que se une e secuestra a secuencia orixe; ademais, a DnaA (necesaria para a iniciación da replicación) únese peor ao ADN hemimetilado. Como consecuencia, as orixes que acaban de ser replicadas non poden iniciar inmediatamente outra rolda de replicación do ADN.[32]
O ATP acumúlase cando a célula está nun medio rico, o que desencadea a replicación do ADN unha vez que a célula alcanzou un tamaño específico. O ATP compite co ADP para unirse á proteína DnaA, e o complexo DnaA-ATP pode iniciar a replicación. Certo número de proteínas DnaA son tamén necesarias para a replicación, xa que cada vez que se copia unha orixe, o número de sitios de unión para a DnaA duplícase, polo que se require a síntese de máis DnaA para posibilitar outra iniciación da replicación.
Reacción en cadea da polimerase
editar- Artigo principal: Reacción en cadea da polimerase.
Os investigadores xeralmente replican o ADN in vitro usando a reacción en cadea da polimerase (PCR). A PCR utiliza un par de cebadores para cubrir unha rexión diana no ADN molde, e despois polimeriza febras complementarias en cada dirección desde estes cebadores usando unha ADN polimerase termoestable chamada Taq polimerase. Repetindo este proceso en moitos ciclos amplifícase a cantidade da rexión diana do ADN. Ao comezo de cada ciclo, a mestura do molde e os cebadores quéntase, para separar as moléculas acabadas de sintetizar das moléculas molde. Despois, cando a mestura arrefría, ambas as moléculas convétense en novos moldes para que se unan a elas novos cebadores, e a polimerase estende o ADN a partir deles. O resultado é que o número de copias da rexión diana duplícase en cada rolda, crecendo exponencialmente.[33]
Notas
editar- ↑ Berg JM, Tymoczko JL, Stryer L, Clarke ND (2002). "Chapter 27: DNA Replication, Recombination, and Repair". Biochemistry. W.H. Freeman and Company. ISBN 0-7167-3051-0. [1]
- ↑ 2,0 2,1 Alberts B, Johnson A, Lewis J, Raff M, Roberts K, Walter P (2002). "5DNA Replication, Repair, and Recombination". Molecular Biology of the Cell. Garland Science. ISBN 0-8153-3218-1. [2]
- ↑ 3,0 3,1 Berg JM, Tymoczko JL, Stryer L, Clarke ND (2002). "Chapter 27, Section 4: DNA Replication of Both Strands Proceeds Rapidly from Specific Start Sites". Biochemistry. W.H. Freeman and Company. ISBN 0-7167-3051-0. [3]
- ↑ Alberts, B., et al., Molecular Biology of the Cell, Garland Science, 4th ed., 2002, pp. 238–240 ISBN 0-8153-3218-1
- ↑ Allison, Lizabeth A. Fundamental Molecular Biology. Blackwell Publishing. 2007. p.112 ISBN 978-1-4051-0379-4
- ↑ Berg JM, Tymoczko JL, Stryer L, Clarke ND (2002). Biochemistry. W.H. Freeman and Company. ISBN 0-7167-3051-0. Chapter 27, Section 2: DNA Polymerases Require a Template and a Primer
- ↑ A enerxética deste proceso pode tamén axudar a explicar a direccionalidade da síntese. Se o ADN fose sintetizado en dirección 3' a 5', a enerxía para este proceso viría do extremo 5' da febra en crecemento en vez de dos nucleósidos trifosfato libres. O problema é que se os trifosfatos de alta enerxía estivesen na febra en crecemento e non nos nucleósidos libres, a corrección de probas feita liminando un nucleótido terminal mal apareado faríase problemática: Unha vez que se engade un nucleótido, pérdese o trifosfato e só queda un só fosfato no esqueleto da molécula entre o novo nucleótido e o resto da febra. Se o nucleótido engadido estivese erradamente apareado, a súa eliminación tería como resultado unha febra de ADN que remata nun monofosfato no extremo da "febra en crecemento" en vez dun trifosfato de alta enerxía. Deste modo a febra quedaría bloqueada e non podería xa crecer máis. En realidade, o que ocorre é que os trifosfatos de alta enerxía hidrolizados en cada paso da síntese se orixinan a partir de nucleósidos trifosfato libres, e non da febra polimerizada, polo que este problema non existe.
- ↑ 8,0 8,1 McCulloch SD, Kunkel TA (xaneiro de 2008). "The fidelity of DNA synthesis by eukaryotic replicative and translesion synthesis polymerases". Cell Research 18 (1): 148–61. PMC 3639319. PMID 18166979. doi:10.1038/cr.2008.4.
- ↑ McCarthy D, Minner C, Bernstein H, Bernstein C (1976). "DNA elongation rates and growing point distributions of wild-type phage T4 and a DNA-delay amber mutant". J Mol Biol 106 (4): 963–81. PMID 789903. doi:10.1016/0022-2836(76)90346-6.
- ↑ Drake JW (1970) The Molecular Basis of Mutation. Holden-Day, San Francisco ISBN 0-8162-2450-1 ISBN 978-0-8162-2450-0
- ↑ Alberts B, Johnson A, Lewis J, Raff M, Roberts K, Walter P (2002). Molecular Biology of the Cell. Garland Science. ISBN 0-8153-3218-1. Chapter 5: DNA Replication Mechanisms
- ↑ Weigel C, Schmidt A, Rückert B, Lurz R, Messer W (novembro de 1997). "DnaA protein binding to individual DnaA boxes in the Escherichia coli replication origin, oriC". The EMBO Journal 16 (21): 6574–83. PMC 1170261. PMID 9351837. doi:10.1093/emboj/16.21.6574.
- ↑ Lodish H, Berk A, Zipursky LS, Matsudaira P, Baltimore D, Darnell J (2000). Molecular Cell Biology. W. H. Freeman and Company. ISBN 0-7167-3136-3.12.1. General Features of Chromosomal Replication: Three Common Features of Replication Origins
- ↑ Aravind, L.; Leipe, D. D.; Koonin, E. V. (1998). "Toprim--a conserved catalytic domain in type IA and II topoisomerases, DnaG-type primases, OLD family nucleases and RecR proteins". Nucleic Acids Research 26 (18): 4205–4213. PMC 147817. PMID 9722641. doi:10.1093/nar/26.18.4205.
- ↑ Frick, David; Richardson, Charles (xullo de 2001). "DNA Primases". Annual Review of Biochemistry 70: 39–80. PMID 11395402. doi:10.1146/annurev.biochem.70.1.39.
- ↑ Huberman JA, Riggs AD (1968). "On the mechanism of DNA replication in mammalian chromosomes". J Mol Biol 32 (2): 327–341. PMID 5689363. doi:10.1016/0022-2836(68)90013-2.
- ↑ Johnson, RE; Klassen, R; Prakash, L; Prakash, S (xullo de 2015). "A Major Role of DNA Polymerase δ in Replication of Both the Leading and Lagging DNA Strands.". Molecular Cell 59 (2): 163–175. PMID 26145172. doi:10.1016/j.molcel.2015.05.038.
- ↑ Hansen, Barbara (2011). Biochemistry and Medical Genetics: Lecture Notes. Kaplan Medical. p. 21.
- ↑ Distinguishing the pathways of primer removal during Eukaryotic Okazaki fragment maturation Autor: Rossi, Marie Louise. Consultado o 2009-02-23T17:05:09Z. Data dispoñible: 2009-02-23T17:05:09Z. Data emisión: 2009-02-23T17:05:09Z. Identificador Uri: http://hdl.handle.net/1802/6537. Descrición: Dr. Robert A. Bambara, Faculty Advisor. Tese (PhD) – School of Medicine and Dentistry, University of Rochester. UR só ata xaneiro de 2010.
- ↑ Elizabeth R. Barry; Stephen D. Bell (decembro de 2006). "DNA Replication in the Archaea". Microbiology and Molecular Biology Reviews 70 (4): 876–887. PMC 1698513. PMID 17158702. doi:10.1128/MMBR.00029-06.
- ↑ Alberts B, Johnson A, Lewis J, Raff M, Roberts K, Walter P (2002). Molecular Biology of the Cell. Garland Science. ISBN 0-8153-3218-1. DNA Replication Mechanisms: DNA Topoisomerases Prevent DNA Tangling During Replication
- ↑ Reece, R. J.; Maxwell, A.; Wang, J. C. (1991). "DNA Gyrase: Structure and Function". Critical Reviews in Biochemistry and Molecular Biology 26 (3–4): 335–375. PMID 1657531. doi:10.3109/10409239109114072.
- ↑ Alberts B, Johnson A, Lewis J, Raff M, Roberts K, Walter P (2002). Molecular Biology of the Cell. Garland Science. ISBN 0-8153-3218-1. DNA Replication Mechanisms: Special Proteins Help to Open Up the DNA Double Helix in Front of the Replication Fork
- ↑ Griffiths A.J.F., Wessler S.R., Lewontin R.C., Carroll S.B. (2008). Introduction to Genetic Analysis. W. H. Freeman and Company. ISBN 0-7167-6887-9.[Chapter 7: DNA: Structure and Replication. pg 283–290]
- ↑ "Will the Hayflick limit keep us from living forever?". Howstuffworks. Consultado o 20 de xaneiro de 2015.
- ↑ 26,0 26,1 James D. Watson et al. (2008), "Molecular Biology of the gene", Pearson Education: 237
- ↑ 27,0 27,1 27,2 27,3 27,4 Peter Meister, Angela Taddei1, Susan M. Gasser(xuño de 2006), "In and out of the Replication Factory", Cell 125 (7): 1233–1235 [4]
- ↑ TA Brown (2002). Genomes. BIOS Scientific Publishers. ISBN 1-85996-228-9.13.2.3. Termination of replication
- ↑ Alberts B, Johnson A, Lewis J, Raff M, Roberts K, Walter P (2002). Molecular Biology of the Cell. Garland Science. ISBN 0-8153-3218-1. Intracellular Control of Cell-Cycle Events: S-Phase Cyclin-Cdk Complexes (S-Cdks) Initiate DNA Replication Once Per Cycle
- ↑ Brown, TA (2002). "13". Genomes (2nd ed.). Oxford: Wiley-Liss.
- ↑ Tobiason DM, Seifert HS (2006). "The Obligate Human Pathogen, Neisseria gonorrhoeae, Is Polyploid". PLoS Biology 4 (6): e185. PMC 1470461. PMID 16719561. doi:10.1371/journal.pbio.0040185.
- ↑ Slater S, Wold S, Lu M, Boye E, Skarstad K, Kleckner N (setembro de 1995). "E. coli SeqA protein binds oriC in two different methyl-modulated reactions appropriate to its roles in DNA replication initiation and origin sequestration". Cell 82 (6): 927–36. PMID 7553853. doi:10.1016/0092-8674(95)90272-4.
- ↑ Saiki, RK; Gelfand DH; Stoffel S; Scharf SJ; Higuchi R; Horn GT; Mullis KB; Erlich HA (1988). "Primer-directed enzymatic amplification of DNA with a thermostable DNA polymerase". Science 239 (4839): 487–91. PMID 2448875. doi:10.1126/science.239.4839.487.
| Commons ten máis contidos multimedia sobre: Replicación do ADN |