Receptor activado polo proliferador do peroxisoma
En bioloxía molecular, os receptores activados polo proliferador do peroxisoma (PPAR) son un grupo de proteínas receptoras nucleares que funcionan como factoresde transcrición que regulan a expresión de xenes.[1] Os PPAR desempeñan papeis eenciais na regulación da diferenciación celular, desenvolvemento e metabolismo de carbohidratos, lípidos e proteínas),[2] e tumoroxénese[3] de organismos superiores.[4][5]
Nomenclatura e distribución nos tecidos
editar| Identificadores | |
| Símbolo | PPARA |
| Símbolos alt. | PPAR |
| Entrez | 5465 |
| HUGO | 9232 |
| OMIM | |
| RefSeq | NM_001001928 |
| UniProt | Q07869 |
| Outros datos | |
| Locus | Cr. 22 q12-q13.1 |
| Identificadores | |
| Símbolo | PPARG |
| Entrez | 5468 |
| HUGO | 9236 |
| OMIM | |
| RefSeq | NM_005037 |
| UniProt | P37231 |
| Outros datos | |
| Locus | Cr. 3 p25 |
| Identificadores | |
| Símbolo | PPARD |
| Entrez | 5467 |
| HUGO | 9235 |
| OMIM | |
| RefSeq | NM_006238 |
| UniProt | Q03181 |
| Outros datos | |
| Locus | Cr. 6 p21.2 |
Identificáronse tres tipos de PPAR: alfa, gamma e delta (beta):[4]
- α (alfa).- Expresado no fígado, riles, corazón, músculo, tecido adiposo e outros.[6]
- β/δ (beta/delta).- Expresado en moitos tecidos, mais especialmente no cerebro, tecido adiposo e pel
- γ (gamma).- Aínda que todas as súas formas se transcriben do mesmo xene, este PPAR, debido a sofre empalme alternativo, exprésase en tres formas:
- γ1.- Expresado en virtualmente todos os tecidos, incluíndo o corazón, músculo, colon, riles, páncreas e bazo
- γ2.- Expresado principalmente no tecido adiposo (é 30 aminoácidos máis longo que γ1)
- γ3.- Expresado en macrófagos, intestino groso, tecido adiposo branco.
Historia
editarOs PPAR foron identificados orixinalmente no anfibio Xenopus como receptores que inducían a proliferación dos peroxisomas nas células, de aí o seu nome.[7] O primeiro PPAR (PPARα) descubriuse durante a investigación da diana molecular para un grupo de axentes que entón se chamaban proliferadores do peroxisoma, xa que facían que se incrementase a cantidade de peroxisomas en roedores, ademais de aumentaren a sensibilidade á insulina.[8] Estes axentes, relacionados farmacoloxicamente cos fibratos descubríronse a inicios da década de 1980. Cando se fixo evidente que os PPAR xogaban un papel moito máis versátil en bioloxía, estes axentes foron denominados ligandos de PPAR. Os ligandos de PPAR máis coñecidos son as tiazolidinedionas (véxase máis abaixo para máis detalles).
Unha vez que se identificou o PPARδ (delta) en humanos en 1992,[9] resultou que estaba moi relacionado co PPARβ (beta) previamente descrito ese mesmo ano noutros animais (o anfibio Xenopus). O nome PPARδ é o que xeralmente se usa nos Estados Unidos, mentres que a denominación PPARβ segue usándose en Europa, onde se descubrira este receptor en Xenopus.
Función fisiolóxica
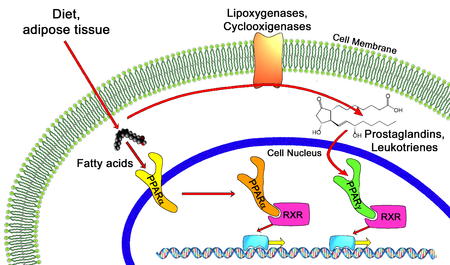
editarTodos os PPAR heterodimerízanse co receptor X retinoide (RXR) e únense a rexións específicas do ADN de xenes diana. Estas secuencias de ADN denomínanse PPREs (siglas en inglés de elementos de resposta a hormonas do proliferador do peroxisoma). A secuencia consenso do ADN é AGGTCANAGGTCA, onde N significa calquera nucleótido. En xeral, esta secuencia aparece na rexión promotora dun xene e, cando o PPAR se une ao seu ligando, a transcrición de xenes diana increméntase ou diminúe, dependendo do xene. O RXR tamén forma un heterodímero con outros receptores (por exemplo, da vitamina D e da hormona tiroide).
A función dos PPAR é modificada pola forma precisa do seu dominio de unión a ligando (véxase máis abaixo) inducido pola unión do ligando e por varias proteínas coactivadoras e correpresoras, cuxa presenza pode estimular ou inhibir a función do receptor, respectivamente.[10]
Entre os ligandos endóxenos dos PPAR están os ácidos graxos, os eicosanoides e a vitamina B3. O PPARγ é activado por PGJ2 (unha prostaglandina) e certos membros da familia do 5-HETE de metabolitos do ácido araquidónico como o 5-oxo-15(S)-HETE e o 5-oxo-ETE.[11] En contraste, o PPARα é activado polo leucotrieno B4. Certos membros da familia do ácido 15-hidroxieicosatetraenoico de metabolitos do ácido araquidónico, incluíndo 15(S)-HETE, 15(R)-HETE e 15-HpETE activan en varios graos os PPAR alfa, beta/delta e gamma.[12] A activación do PPARγ polo agonista RS5444 pode inhibir o crecemento do cancro de tiroide anaplástico.[13] Ver[14] para unha revisión crítica do papel do PPAR-gamma no cancro.
Xenética
editarAs tres formas principais transcríbense en diferentes xenes:
- PPARα - cromosoma 22q12-13.1 (OMIM 170998)
- PPARβ/δ - cromosoma 6p21.2-21.1 (OMIM 600409)
- PPARγ - cromosoma 3p25 (OMIM 601487).
Describíronse trastornos hereditarios de todos os PPAR, que xeralmente orixinan unha perda de función e unha concomitante lipodistrofia, resistencia á insulina e/ou acantose nigricans.[15] De PPARγ describiuse unha mutación de ganancia de función (Pro12Ala) que fai diminuír o risco da resistencia á insulina; é bastante frecuente (frecuencia alélica de 0,03 - 0,12 nalgunhas poboacións).[16] En contraste, a pro115gln está asociada coa obesidade. Algúns outros polimorfismos teñen unha alta incidencia en poboacións con índices de masa corporal elevados.
Estrutura
editarIgual que outros receptores nucleares, os PPAR teñen estrutura modular e conteñen os seguintes dominios funcionais:
- (A/B) rexión N-terminal
- (C) DBD (dominio de unión ao ADN)
- (D) rexión bisagra flexible
- (E) LBD (dominio de unión a ligando)
- (F) rexión C-terminal.
O DBD contén dous motivos de dedo de zinc, que se unen a secuencias específicas de ADN coñecidas como elementos de resposta a hormonas cando o receptor é activado. O LBD ten unha ampla estrutura secundaria que consiste en 13 hélices alfa e unha folla beta.[17] Os ligandos naturais e sintéticos únense ao LBD, activando ou reprimindo o receptor.
Farmacoloxía e moduladores do PPAR
editarO PPARα e o PPARγ son as dianas moleculares de varios fármacos comercializados coñecidos como moduladores do PPAR. Por exemplo os fibratos hipolipidémicos activan o PPARα, e as tiazolidinedionas antidiabéticas activan o PPARγ. O composto químico sintético ácido perfluorooctanoico activa o PPARα, mentres que o ácido perfluorononanoico sintético activa tanto o PPARα coma o PPARγ. A berberina activa o PPARγ, así como outros compostos naturais de diferentes clases químicas.[18][19]
Notas
editar- ↑ Michalik L, Auwerx J, Berger JP, Chatterjee VK, Glass CK, Gonzalez FJ, Grimaldi PA, Kadowaki T, Lazar MA, O'Rahilly S, Palmer CN, Plutzky J, Reddy JK, Spiegelman BM, Staels B, Wahli W (2006). "International Union of Pharmacology. LXI. Peroxisome proliferator-activated receptors". Pharmacol. Rev. 58 (4): 726–41. PMID 17132851. doi:10.1124/pr.58.4.5.
- ↑ Dunning, Kylie R.; Anastasi, Marie R.; Zhang, Voueleng J.; Russell, Darryl L.; Robker, Rebecca L. (2014-02-05). "Regulation of Fatty Acid Oxidation in Mouse Cumulus-Oocyte Complexes during Maturation and Modulation by PPAR Agonists". PLOS ONE 9 (2): e87327. ISSN 1932-6203. PMC 3914821. PMID 24505284. doi:10.1371/journal.pone.0087327.
- ↑ Belfiore A, Genua M, Malaguarnera R (2009). "PPAR-gamma Agonists and Their Effects on IGF-I Receptor Signaling: Implications for Cancer". PPAR Res 2009: 830501. PMC 2709717. PMID 19609453. doi:10.1155/2009/830501.
- ↑ 4,0 4,1 Berger J, Moller DE (2002). "The mechanisms of action of PPARs". Annu. Rev. Med. 53: 409–35. PMID 11818483. doi:10.1146/annurev.med.53.082901.104018.
- ↑ Feige JN, Gelman L, Michalik L, Desvergne B, Wahli W (2006). "From molecular action to physiological outputs: peroxisome proliferator-activated receptors are nuclear receptors at the crossroads of key cellular functions". Prog. Lipid Res. 45 (2): 120–59. PMID 16476485. doi:10.1016/j.plipres.2005.12.002.
- ↑ Tyagi S, Gupta P, Saini AS, Kaushal C, Sharma S (October 2011). "The peroxisome proliferator-activated receptor: A family of nuclear receptors role in various diseases". J Adv Pharm Technol Res 2 (4): 236–40. PMC 3255347. PMID 22247890. doi:10.4103/2231-4040.90879.
- ↑ Dreyer C, Krey G, Keller H, Givel F, Helftenbein G, Wahli W (1992). "Control of the peroxisomal beta-oxidation pathway by a novel family of nuclear hormone receptors". Cell 68 (5): 879–87. PMID 1312391. doi:10.1016/0092-8674(92)90031-7.
- ↑ Issemann I, Green S (1990). "Activation of a member of the steroid hormone receptor superfamily by peroxisome proliferators". Nature 347 (6294): 645–50. PMID 2129546. doi:10.1038/347645a0.
- ↑ Schmidt A, Endo N, Rutledge SJ, Vogel R, Shinar D, Rodan GA (1992). "Identification of a new member of the steroid hormone receptor superfamily that is activated by a peroxisome proliferator and fatty acids". Mol. Endocrinol. 6 (10): 1634–41. PMID 1333051. doi:10.1210/me.6.10.1634.
- ↑ Yu S, Reddy JK (2007). "Transcription coactivators for peroxisome proliferator-activated receptors". Biochim. Biophys. Acta 1771 (8): 936–51. PMID 17306620. doi:10.1016/j.bbalip.2007.01.008.
- ↑ Biochim. Biophys. Acta 1736:228-236, 2005
- ↑ Mol. Pharmacol. 77-171-184, 2010
- ↑ Marlow LA, Reynolds LA, Cleland AS, Cooper SJ, Gumz ML, Kurakata S, Fujiwara K, Zhang Y, Sebo T, Grant C, McIver B, Wadsworth JT, Radisky DC, Smallridge RC, Copland JA (February 2009). "Reactivation of suppressed RhoB is a critical step for the inhibition of anaplastic thyroid cancer growth". Cancer Res. 69 (4): 1536–44. PMC 2644344. PMID 19208833. doi:10.1158/0008-5472.CAN-08-3718.
- ↑ Curr. Mol. Med. 7:532-540, 2007
- ↑ Meirhaeghe A, Amouyel P (2004). "Impact of genetic variation of PPARgamma in humans". Mol. Genet. Metab. 83 (1-2): 93–102. PMID 15464424. doi:10.1016/j.ymgme.2004.08.014.
- ↑ Buzzetti R, Petrone A, Ribaudo MC, Alemanno I, Zavarella S, Mein CA, Maiani F, Tiberti C, Baroni MG, Vecci E, Arca M, Leonetti F, Di Mario U (2004). "The common PPAR-gamma2 Pro12Ala variant is associated with greater insulin sensitivity". European Journal of Human Genetics 12 (12): 1050–4. PMID 15367918. doi:10.1038/sj.ejhg.5201283.
- ↑ Zoete V, Grosdidier A, Michielin O (2007). "Peroxisome proliferator-activated receptor structures: ligand specificity, molecular switch and interactions with regulators". Biochim. Biophys. Acta 1771 (8): 915–25. PMID 17317294. doi:10.1016/j.bbalip.2007.01.007.
- ↑ Atanasov AG, Wang JN, Gu SP, Bu J, Kramer MP, Baumgartner L, Fakhrudin N, Ladurner A, Malainer C, Vuorinen A, Noha SM, Schwaiger S, Rollinger JM, Schuster D, Stuppner H, Dirsch VM, Heiss EH (2013). "Honokiol: a non-adipogenic PPARγ agonist from nature". Biochim. Biophys. Acta 1830 (10): 4813–9. PMC 3790966. PMID 23811337. doi:10.1016/j.bbagen.2013.06.021.
- ↑ Atanasov AG, Blunder M, Fakhrudin N, Liu X, Noha SM, Malainer C, Kramer MP, Cocic A, Kunert O, Schinkovitz A, Heiss EH, Schuster D, Dirsch VM, Bauer R (2013). "Polyacetylenes from Notopterygium incisum--new selective partial agonists of peroxisome proliferator-activated receptor-gamma". PLoS ONE 8 (4): e61755. PMC 3632601. PMID 23630612. doi:10.1371/journal.pone.0061755.
Véxase tamén
editarOutros artigos
editarLigazóns externas
editar- [1] (PPAR Resource Page, Penn State University).
- [2] (Nuclear Receptor Resource).
- PPAR reference outlineArquivado 14 de febreiro de 2020 en Wayback Machine. (Rutgers University).
- Peroxisome Proliferator-Activated Receptors Medical Subject Headings (MeSH) na Biblioteca Nacional de Medicina dos EUA.
- Proteopedia Peroxisome_Proliferator-Activated_Receptors - the Peroxisome Proliferator-Activated Receptor Structure in Interactive 3D