Promotor (xenética)
En xenética, denomínase promotor a unha rexión do ADN na que se sitúan os encimas e outros factores que inician a transcrición dun determinado xene. Os promotores están localizados nas proximidades dos xenes que transcriben e na mesma cadea en dirección 5' da cadea con sentido.
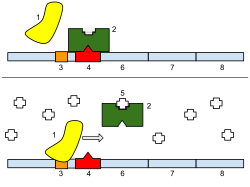
1: ARN polimerase, 2: Represor, 3: Promotor, 4: Operador, 5: Lactosa, 6: lacZ, 7: lacY, 8: lacA. Arriba: O xene está esencialmente desactivado. Non hai lactosa que inhiba o represor, polo que o represor se une ao operador, o cal impide que a ARN polimerase se una ao promotor e se forme o ARNm que orixinará o encima lactase. Abaixo: O xene está activado. O disacárido lactosa inhibe o represor, permitindo que a ARN polimerase se una co promotor, e exprese os xenes que sintetizan o ARNm da lactase. Finalmente, a lactase dixire a lactosa, ata que non hai ningunha que se una ao represor. O represor entón únese ao operador, e detén a formación de lactase.
Introdución
editarPara que teñea lugar a transcrición, o encima que sintetiza ARN, chamado ARN polimerase, debe unirse ao ADN preto do xene que se vai transcribir. Os promotores conteñen secuencias de ADN específicas e elementos de resposta que proporcionan un sitio de unión inicial para a ARN polimerase e para as proteínas chamadas factores de transcrición que recrutan a ARN polimerase. Estes factores de transcrición teñen activadores específicos ou secuencias represoras que se unen a promotores específicos e regulan así a expresión xénica.
En bacterias o promotor é recoñecido pola ARN polimerase e por un factor sigma asociado, o cal, á súa vez, é traído con frecuencia ata o promotor por unha proteína activadora, que se une ao seu propio sitio de unión no ADN próximo.
En eucariotas o proceso é máis complicado, e polo menos son necesarios sete factores diferentes para a unión dunha ARN polimerase II ao promotor.
Os promotores representan elementos críticos que poden funcionar en concerto con outras rexións reguladoras (amplificadores ou enhancers, silenciadores, elementos límite/insuladores ou insulators) para dirixir o nivel de transcrición dun xene dado.
Localización relativa
editarOs promotores normalmente están situados en posición inmediatamente adxacente ao xene en cuestión. As posicións no promotor desígnanse en relación ao sitio de inicio da transcrición, onde empeza a transcrición dun ADN para un xene particular, é dicir, as posicións corrente arriba (antes do xene en dirección 5' ou upstream) indícanse con números negativos contando para atrás desde o -1; por exemplo -100 é unha posición situada 100 pares de bases corrente arriba.
Elementos promotores
editarNun promotor podemos distinguir as seguintes partes:
- Núcleo do promotor (core promoter). É a mínima porción do promotor que se require para iniciar adecuadamente a transcrición.[1] Inclúe as seguintes partes:
- Sitio de inicio da transcrición e elementos directamente corrente arriba.
- Un sitio de unión da ARN polimerase.
- A ARN polimerase I transcribe xenes que codifican o ARN ribosómico
- A ARN polimerase II transcribe xenes que codifican o ARN mensaxeiro e certos ARN nucleares pequenos.
- A ARN polimerase III transcribe xenes que codifican os ARN transferentes e outros pequenos ARNs.
- Sitios de unión do factor de transcrición xerais, por exemplo a caixa TATA.
- Promotor proximal. É a secuencia proximal corrente arriba do xene que adoita conter elementos regulatorios primarios. Situada aproximadamente a 250 pares de bases corrente arriba do sitio de inicio.
- Sitios de unión do factor de transcrición específicos.
- Promotor distal. É a secuencia distal corrente arriba dun xene que pode conter elementos regulatorios adicionais, a miúdo cunha influencia máis débil cá do promotor proximal.
- Calquera outra rexión corrente arriba (pero excluíndo os amplificadores ou enhancers ou outras rexións regulatorias cunha influencia independente da posición/orientación).
- Sitios de unión de factores de transcrición específicos.
Promotores procarióticos
editarNos procariotas, o promotor consta de dúas curtas secuencias situadas nas posicións -10 e -35 corrente arriba a partir do sitio de inicio da transcrición. Os factores sigma non só axudan a amplificar a unión da ARN polimerase (RNAP) ao promotor senón tamén axudan a que a ARN polimerase se una a xenes específicos para transcribilos.
- A secuencia en posición -10 denomínase caixa de Pribnow, ou o elemento -10, e consiste nunha secuencia de seis nucleótidos; a máis común é TATAAT.[2] Fai unha función similar á caixa TATA dos eucariotas.
- A outra secuencia en posición -35 (o elemento -35) xeralmente consiste en sete núcleótidos, frecentemente coa secuencia TTGACAT.
- Ambas as secuencias consenso anteriores, aínda que como media están conservadas, non se atopan intactas en todos os promotores. Como media, só se encontran 3 dos 6 pares de bases de cada secuencia consenso nun promotor determinado. Non se identificou ningúnn promotor ata agora que teña intactas as secuencias consenso nas posicións -10 e -35; os promotores artificiais cunha conservación completa dos hexámeros -10/-35 viuse que transcriben a frecuencias máis baixas cós que teñen uns poucos cambios con respecto á secuencia consenso.
- Algúns promotores conteñen un elemento UP (secuencia consenso 5'-AAAWWTWTTTTNNNAAANNN-3'; W = A ou T; N = calquera base) centradas en -50; a presenza do elemento -35 parece ser importante para a transcrición a partir dos promotores que conteñen o elemento UP.[3]
Debe terse en conta que as secuencias promotoras antes mencionadas son recoñecidas só pola proteína sigma -70 que interacciona coa ARN polimerase procariótica. Os complexos da ARN polimerase con outros factores sigma recoñecen outras secuencias diferentes do núcleo do promotor.
<-- corrente arriba corrente abaixo--> 5'-XXXXXXXPPPPPXXXXXXPPPPPPXXXXGGGGGGGGGGGGGGGGGGGGGGGGGGGGGGGGGGGGGGGGGGGGGGGGGGGGGXXXX-3' -35 -10 Xene que vai ser transcrito (O espazado óptimo entre as secuencias -35 e -10 é 17 pares de bases.)
Probabilidade de aparición de cada nucleótido
editarpara a secuencia -10 T A T A A T 77% 76% 60% 61% 56% 82%
para a secuencia -35 T T G A C A 69% 79% 61% 56% 54% 54%
Promotores eucarióticos
editarOs promotores eucarióticos son extremadamente diversos e son difíciles de caracterizar. Sitúanse tipicamente corrente arriba do xene e poden ter elementos regulatorios situados a varias quilobases de distancia do sitio de inicio da transcrición, chamados amplificadores ou enhancers. Nos eucariotas, o complexo transcricional pode causar que o ADN se dobre cara a atrás sobre si mesmo, o que permite que haxa secuencias regulatorias situadas lonxe do sitio real da transcrición, que debido a ese pregamento acaban quedando fisicamente próximas ao xene. Moitos promotores eucarióticos, que supoñen entre o 10 e o 20% dos promotores de todos os xenes,[4] conteñen a caixa TATA (secuencia TATAAA), á que se une a proteína de unión á TATA, a cal axuda na formación do complexo transcricional da ARN polimerase.[1] A caixa TATA está xeralmente moi preto do sitio de inicio da transcrición (a miúdo a 50 bases).
Ás secuencias regulatorias eucarióticas promotoras únense proteínas chamadas factores de transcrición que están implicados na formación do complexo transcricional. Un exemplo é a caixa E (secuencia CACGTG), que se une a factores de transcrición da familia hélice básica-bucle-hélice (bHLH) (por exemplo, BMAL1-CLOCK, cMyc).[5]
Detección de promotores
editarDesenvolvéronse diversos algoritmos para facilitar a detección de promotores nunha secuencia xenómica, e a predición de promotores é un elemento común de moitos métodos de predición de xenes. Unha rexión promotora está localizada antes das secuencias consenso -35 e -10. Canto máis próxima está a rexión promotora ás secuencias consenso máis frecuentemente terá lugar a transcrición dese xene. Non hai un patrón establecido para as rexións promotoras como o que hai para as secuencias consenso.
Cambios evolutivos
editarUnha cuestión importante en bioloxía evolutiva é o grao de importancia que teñen os cambios nas secuencias dos promotores no cambio evolutivo; por exemplo, os cambios que ocorreron na liñaxe humana despois da separación da liñaxe dos chimpancés.
Algúns biólogos evolutivos, como Allan Wilson, propuxeron que a evolución no promotor ou en rexións regulatorias pode ser máis importante cós cambios nas secuencias codificantes neses marcos temporais.
Unha razón chave para a importancia que se lle dá aos promotores é o seu potencial de incorporar sinais endócrinos e ambientais [6] como cambios na expresión xénica [7]: Unha gran variedade de cambios no ambiente extracelular ou intracelular [8] poden ter impacto na expresión xénica, dependendo da configuración exacta dun promotor dado: a combinación e arranxo [9] de secuencias específicas de ADN que constitúen o promotor define os grupos exactos de proteínas que poden unirse ao promotor, nun momento dado.[10] Unha vez que a célula recibe un estímulo fisiolóxico, patolóxico, ou farmacolóxico, modífícanse bioquimicamente varias proteínas celulares por cascadas de sinais.[6] Por medio de cambios na estrutura, determinadas proteínas adquiren a capacidade de entrar no núcleo da célula e unirse ao ADN promotor, ou a outras proteínas, as cales están xa unidas a un determinado promotor. Os complexos multiproteicos que se forman teñen o potencial de cambiar os niveis de expresión xénica.[11] Como resultado o produto xénico pode incrementarse ou decrecer dentro da célula.
Enfermidades asociadas co funcionamento anormal de promotores
editarAínda que OMIM é a maior fonte para recoller información sobre as relacións entre as mutacións e a variación natural da secuencia xénica e susceptibilidade a centos de enfermidades, requírese unha estratexia de investigación sofisticada para detectar enfermidades asociadas con defectos no control transcricional nas que se crea que teña unha implicación directa o promotor.
Existe unha lista de doenzas nas que as evidencias suxiren que hai algún mal funcionamento do promotor, debido a unha mutación directa dunha secuencia promotora ou pola mutación dun factor de transcrición ou coactivador transcricional.
Moitas enfermidades teñen unha etioloxía (causa) heteroxénea, o que significa que unha "doenza" son en realidade moitas doenzas diferentes a nivel molecular, aínda que os síntomas que mostran e as respostas aos tratamentos sexan idénticas. O modo en que responden aos tratamentos doenzas de diferente orixe molecular é parcialmente tratado pola farmacoxenómica.
Ademais desas doenzas hai moitos tipos de cancro no que está envolvida a regulación transcricional anormal debida á creación de xenes quiméricos por medio de translocacións cromosómicas. A intervención no número e estrutura de proteínas de unión ao promotor é un punto chave para tratar unha doenza sen afectar á expresión de xenes non relacionados que comparten elementos co xene diana.[12] Xenes nos que os cambios non son desexables poden influenciar o potencial dunha célula de facerse cancerosa e formar un tumor.[13]
Exemplos de enfermidades asociadas con cambios nos promotores
editarAlgúns casos de moitas das doenzas de orixe xenética están asociados con variacións nos promotores ou nos factores de transcrición.
Exemplos:
Promotores constitutivos e regulados
editarAlgúns promotores denomínanse constitutivos, xa que están sempre activos, e outros están regulados e só están activos en resposta a estímulos específicos.
Promotores subxenómicos
editarUn promotor subxenómico é un promotor engadido a un virus por un xene heterólogo específico, que resulta na formación de ARNm para ese xene só.
Notas
editar- ↑ 1,0 1,1 Smale, T.; Kadonaga, T. (2003). "The RNA polymerase II core promoter". Annual review of biochemistry 72: 449–479. doi:10.1146/annurev.biochem.72.121801.161520. ISSN 0066-4154. PMID 12651739.
- ↑ Harley, Calvin B.; Reynolds, Robert P. (March 1987). "Analysis of E. coli promoter sequences" (PDF, 0.9 MB). Nucleic Acids Research 15 (5): 2343–2361. doi:10.1093/nar/15.5.2343. ISSN 0305-1048. PMC 340638. PMID 3550697. http://nar.oxfordjournals.org/content/15/5/2343.long.
- ↑ Estrem, Gaal, Ross, Gourse (1998). "Identification of an UP element consensus sequence for bacterial promoters". PNAS 95 (11): 9761–9766. Bibcode:1998PNAS...95.9761E. PMC 21410. PMID 9707549. doi:10.1073/pnas.95.17.9761.
- ↑ Gershenzon NI, Ioshikhes IP (2005). "Synergy of human Pol II core promoter elements revealed by statistical sequence analysis". Bioinformatics 21 (8): 1295–300. PMID 15572469. doi:10.1093/bioinformatics/bti172.
- ↑ Levine, M.; Tjian, R. (Jul 2003). "Transcription regulation and animal diversity". Nature 424 (6945): 147–151. doi:10.1038/nature01763. ISSN 0028-0836. PMID 12853946.
- ↑ 6,0 6,1 Vlahopoulos S, Zoumpourlis VC (2004). "JNK: a key modulator of intracellular signaling". Biochemistry (Mosc) 69 (8): 844–54. PMID 15377263. doi:10.1023/B:BIRY.0000040215.02460.45.
- ↑ Vlahopoulos S, Boldogh I, Casola A, Brasier AR (1999). "Nuclear factor-kappaB-dependent induction of interleukin-8 gene expression by tumor necrosis factor alpha: evidence for an antioxidant sensitive activating pathway distinct from nuclear translocation". Blood 94 (6): 1878–89. PMID 10477716.
- ↑ Veitia RA, Nijhout HF (2006). "The robustness of the transcriptional response to alterations in morphogenetic gradients". BioEssays 28 (3): 282–9. PMID 16479586. doi:10.1002/bies.20377.
- ↑ Tomilin NV (2008). "Regulation of mammalian gene expression by retroelements and non-coding tandem repeats". BioEssays 30 (4): 338–48. PMID 18348251. doi:10.1002/bies.20741.
- ↑ Celniker SE, Drewell RA (2007). "Chromatin looping mediates boundary element promoter interactions". BioEssays 29 (1): 7–10. PMID 17187351. doi:10.1002/bies.20520.
- ↑ Smith CL (2008). "A shifting paradigm: histone deacetylases and transcriptional activation". BioEssays 30 (1): 15–24. PMID 18081007. doi:10.1002/bies.20687.
- ↑ Copland JA, Sheffield-Moore M, Koldzic-Zivanovic N, Gentry S, Lamprou G, Tzortzatou-Stathopoulou F, Zoumpourlis V, Urban RJ, Vlahopoulos SA (2009). "Sex steroid receptors in skeletal differentiation and epithelial neoplasia: is tissue-specific intervention possible?". BioEssays 31 (6): 629–41. PMID 19382224. doi:10.1002/bies.200800138.
- ↑ Vlahopoulos SA, Logotheti S, Mikas D, Giarika A, Gorgoulis V, Zoumpourlis V (2008). "The role of ATF-2 in oncogenesis". BioEssays 30 (4): 314–27. PMID 18348191. doi:10.1002/bies.20734.
- ↑ Hobbs, K. N.; Negri, J.; Klinnert, M.; Rosenwasser, L. J.; Borish, L. (1 December 1998). "Interleukin-10 and transforming growth factor-beta promoter polymorphisms in allergies and asthma" (Free full text). American Journal of Respiratory and Critical Care Medicine 158 (6): 1958–1962. ISSN 1073-449X. PMID 9847292. http://ajrccm.atsjournals.org/cgi/pmidlookup?view=long&pmid=9847292.
- ↑ Burchard, E. S.; Silverman, E. K.; Rosenwasser, L. J.; Borish, L.; Yandava, C.; Pillari, A.; Weiss, S. T.; Hasday, J. et al. (1 September 1999). "Association between a sequence variant in the IL-4 gene promoter and FEV(1) in asthma" (Free full text). American Journal of Respiratory and Critical Care Medicine 160 (3): 919–922. ISSN 1073-449X. PMID 10471619. http://ajrccm.atsjournals.org/cgi/pmidlookup?view=long&pmid=10471619.
- ↑ Kulozik, A. B. K. (May 1991). "Thalassemia intermedia: moderate reduction of beta globin gene transcriptional activity by a novel mutation of the proximal CACCC promoter element". Blood 77 (9): 2054–2058. ISSN 0006-4971. PMID 2018842.
- ↑ Petrij, F.; Giles, H.; Dauwerse, G.; Saris, J.; Hennekam, C.; Masuno, M.; Tommerup, N.; Van Ommen, J. et al. (Jul 1995). "Rubinstein-Taybi syndrome caused by mutations in the transcriptional co-activator CBP". Nature 376 (6538): 348–351. Bibcode 1995Natur.376..348P. doi:10.1038/376348a0. ISSN 0028-0836. PMID 7630403.
Véxase tamén
editarOutros artigos
editar- Regulación da experesión xenética
- Factor de transcrición
- Activador (xenética)
- Represor
- Operón e operón lac
- Illador (xenética)
- Amplificador xenético
Ligazóns externas
editar- ORegAnno - Open Regulatory Annotation Database Arquivado 21 de marzo de 2021 en Wayback Machine.
- mybioinfo.info - Unha máquina de busca para atopar a rexión promotora dun xene.
- SwitchDB - Unha base de datos online utilizada para analizar promotores e sitios de inicio da transcrición (TSSs) no xenoma humano.
- Pleiades Promoter Project - un proxecto de investigación para crear minipromotores que dirixan a expresión xenética en zonas do cerebro de interese terapéutico.
- ENCODE threads Explorer Patróns de modificación do ARN e da cromatina arredor dos promotores. Reista Nature.