Translocación cromosómica
En xenética, unha translocación cromosómica é unha anormalidade cromosómica causada polo desprazamento dun segmento dun cromosoma a outro cromosoma non homólogo. Hai dous tipos principais de translocacións: recíprocas (tamén chamadas non robertsonianas), que son intercambios de segmentos entre dous cromosomas, e robertsonianas, que orixina a fusión de cromosomas acrocéntricos. As translocacións tamén se poden clasificar como equilibradas (cun intercambio equitativo de material xenético, sen que se perda nin gañe infòrmación xenética e mantendo a funcionalidade) ou desequilibrada (na que o intercambio de material xenético entre os cromosomas é desequilibrado e orixínase unha perda ou ganancia de xenes). As translocacións poden xuntar dous xenes que estaban separados, e orixinarse fusións de xenes, o cal é común en casos de cancro. Poden detectarse por estudos citoxenéticos ou de cariotipo das células afectadas.
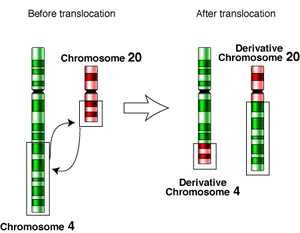
Translocacións recíprocas (non robertsonianas)
editarAs translocacións recíprocas consisten xeralmente nun intercambio de material xenético entre dous cromosomas non homólogos. O xeito máis común de producirse é que os brazos de dous cromosomas non homólogos se aproximen de tal maneira que se facilite o intercambio. Se o intercambio inclúe segmentos cromosómicos internos, serán precisas catro roturas, dúas en cada cromosoma. Isto pode orixinar sinapses complexas na meiose, con formación de confuguracións en cruz. O intercambio pode dar lugar a novas relacións de ligamento entre xenes, que se poden detectar experimentalmente. A incidencia destas translocacións estímase que vai desde un caso entre cada 500 [1] ata un caso cada 625 nos humanos recentemente nados.[2] Estas translocacións son xeralmente inofensivas e poden detectarse na diagnose prenatal. Porén, os portadores de translocacións recíprocas equilibradas teñen un incremento do risco de formar gametos con translocacións cromosómicas desequilibradas que orixinan os abortos espontáneos de moitos fetos con estas anormalidades, polo que ás familias que portan estas translocacións se lles recomenda facer probas xenéticas. A maioría dos portadores de translocafcións equilibradas son persoas saudables, que non presentan síntomas, pero arredor do 6% deles manifestan síntomas que varían desde o autismo, ao atraso intelectual, ou anomalías corporais conxénitas, debido seguramente á rotura dalgún xene no punto de translocación.
Translocacións robertsonianas
editar- Artigo principal: Translocación robertsoniana.
Este tipo de translocación afecta a cromosomas acrocéntricos que se fusionan preto do centrómero e perden os brazos curtos. O cariotipo resultante en humanos é de só 45 cromosomas, xa que dous deles se fusionaron. Isto non ten efecto no fenotipo, xa que os únicos xenes nos brazos curtos dos cromosomas acrocéntricos son comúns a todos os cromosomas acrocéntricos e están presentes en números de copias variables (son os xenes do organizador nucleolar). As translocacións robertsonianas poden darse en calquera combinación de cromosomas acrocéntricos, pero a máis común nos humanos é a que afecta aos cromosomas 13 e 14 e dáse no 0,97/1000 dos recentemente nados.[3] Os portadores de translocacións robertsonianas non presentan anormalidades fenotípicas, pero teñen un risco de producir gametos desequilibrados, que orixinarán o aborto dos fetos enxendrados ou o nacemento de meniños con anormalidades. Por exemplo, os portadores de translocacións robertsonianas que afectan ao cromosoma 21 teñen un alto risco de ter fillos con síndrome de Down (que tamén se orixina por trisomía total). Isto débese a unha incorrecta segregación (non disxunción) dos cromosomas durante a gametoxénese. A nai ten un risco máis alto (10%) de transmisión ca o pai (1%). As translocacións robertsonianas que afectan ao cromosoma 14 tamén comportan un certo risco de disomía uniparental 14.
Enfermidades asociadas
editarAlgunhas enfermidades humanas causadas por translocacións son:
- Cancro: varias formas de cáncer son causadas por translocacións adquiridas (é dicir, non conxénitas); como é o caso das leucemias (leucemia mielóxena aguda e leucemia mielóxena crónica), ou en tumores sólidos como o sarcoma de Ewing.
- Infertilidade: en persoas asintomáticas que presentan unha translocación equilibrada, pero que producen fetos non viables.
- Síndrome de Down: causado nunha pequena parte dos casos (5% ou menos) por unha translocación robertsoniana do brazo longo do cromosoma 21 sobre o brazo longo do cromosoma 14 (na maioría dos casos é unha trisomía total).
Translocacións por cromosomas
editarALL - leucemia linfoblástica aguda
AML - leucemia mieloide aguda
CML - leucemia mielóxena crónica
DFSP - dermatofibrosarcoma protuberans.
Denotación
editarPara denotar as translocacións entre cromosomas utilízase o Sistema Internacional de Nomenclatura de Citoxenética Humana (ISCN).[5] Unha translocación entre o cromosoma A e o B desígnase así: t(A;B)(p1;q2). A información que vai nas segundas parénteses, cando se dá, indica a localización precisa da translocación nos cromosomas A e B, respectivamente, na que p indica o brazo curto do cromosoma e q o longo, e os números despois de p ou q refírense a rexións, bandas e subbandas vistas ao marcar os cromosomas cunha tinguidura (ver tamén locus).
Exemplos
editar| Translocación | Enfermidades asociadas | Xenes/proteínas fusionados | |
|---|---|---|---|
| Primeiro | Segundo | ||
| t(8;14)(q24;q32) | linfoma de Burkitt | c-myc no cromosoma 8, dá á proteína de fusión (ou quimérica formada pola fusión de dous xenes) capacidade proliferativa do linfocito |
IGH@ (locus da cadea pesada da inmunoglobulina) no cromosoma 14, que induce a transcrición masiva da proteína de fusión |
| t(11;14)(q13;q32) | linfoma de célula do manto[6] | ciclina D1[6] no cromosoma 11, dá á proteína de fusión capacidade proliferativa celular |
IGH@[6] (locus da cadea pesada da inmunoglobulina) no cromosoma 14, que induce a transcrición masiva da proteínas de fusión. |
| t(14;18)(q32;q21) | linfoma folicular | IGH@[6] (locus da cadea pesada da inmunoglobulina) no cromosoma 14, que induce a transcrición masiva da proteína de fusión |
Bcl-2 no cromosoma 18, dá á proteína de fusión capacidades antiapoptóticas |
| t(10;(varios))(q11;(varios)) | cancro de tiroide papilar [7] | RET protooncoxene[7] no cromosoma 10 | PTC (Papillary Thyroid Cancer), marcador de posición para outros xenes/proteínas [7] |
| t(2;3)(q13;p25) | cancro de tiroide folicular[7] | PAX8 - paired box gene 8[7] no cromosoma 2 | PPARγ1[7] (peroxisome proliferator-activated receptor γ 1) no cromosoma 3 |
| t(8;21)(q22;q22) | leucemia mieloblástica aguda con maduración | ETO no cromosoma 8 | AML1 no cromosoma 21 |
| t(9;22)(q34;q11) cromosoma Filadelfia | leucemia mielóxena crónica (CML), leucemia linfoblástica aguda (ALL) | xene Abl1 no cromosoma 9[8] | BCR ("breakpoint cluster region" no cromosoma 22 [8] |
| t(15;17) | leucemia promielocítica aguda | proteína PML no cromosoma 15 | RAR-α no cromosoma 17 |
| t(12;15)(p13;q25) | Leucemia mieloide aguda, fibrosarcoma conxénito, carcinoma de mama secretor | TEL no cromosoma 12 | receptor TrkC no cromosoma 15 |
| t(9;12)(p24;p13) | CML, ALL | JAK no cromosoma 9 | TEL no cromosoma 12 |
| t(12;21)(p12;q22) | ALL | TEL no cromosoma 12 | AML1 no cromosoma 21 |
| t(11;18)(q21;q21) | linfoma MALT[9] | BCL-2[9] | MLT[9] |
| t(1;11)(q42.1;q14.3) | Esquizofrenia [4] | ||
| t(2;5)(p23;q35) | linfoma de célula grande anaplástica | ||
| t(11;22)(q24;q11.2-12) | sarcoma de Ewing | ||
| t(17;22) | DFSP | Coláxeno I no cromosoma 17 | factor B de crecemento derivado de plaquetas no cromosoma 22 |
| t(1;12)(q21;p13) | leucemia mielóxena aguda | ||
| t(X;18)(p11.2;q11.2) | Sarcoma sinovial | ||
| t(1;19)(q10;p10) | Oligodendroglioma e oligoastrocitoma | ||
| t(17;19)(q22;p13) | ALL | ||
| t(7,16) (q32-34;p11) ou t(11,16) (p11;p11) | sarcoma fibromixoide de baixo grao | FUS | CREB3L2 ou CREB3L1 |
Evolución e translocacións
editarAs translocacións teñen relevancia evolutiva. O caso máis extremo de utilización das translocacións como mecanismo de evolución, prodúcese no xénero Oenothera, no que os individuos son heterocigotos estruturais permanentes, xa que todos os cromosomas están implicados en translocacións múltiples. Na meiose destes individuos fórmase un único multivalente e só se forman dous tipos de gametos viables. Isto fixo posible que por medio de translocacións múltiples se chegasen a formar dous grupos de cromosomas (complexos C e complexos R) de tal forma que cada cromosoma ten os extremos dos brazos cromosómicos homólogos aos extremos doutros cromosomas distintos do outro grupo. A zona central non se aparea nunca ao ser moi pequena ou non ter homólogo no outro complexo.
Historia
editarEn 1938 Karl Sax, nos Laboratorios Biolóxicos da Universdidade de Harvard, publicou un traballo titulado "Aberraccións cromosómicas inducidas por raios X", que demostraba que a radiación pode inducir cambios xenéticos importantes ao afectar ás translocacións cromosómicas. Esta publicación pénsase que é o comezo da citoloxía de radiación.
Notas
editar- ↑ Caroline Mackie Ogilvie and Paul N Scriven (2002). "Meiotic outcomes in reciprocal translocation carriers ascertained in 3-day human embryos". European Journal of Human Genetics (European Society of Human Genetics) 10 (12): 801–806. PMID 12461686. doi:10.1038/sj.ejhg.5200895. Consultado o 2008-12-26.
- ↑ M. Oliver-Bonet; J. Navarro1, M. Carrera, J. Egozcue, J. Benet (2002). "Aneuploid and unbalanced sperm in two translocation carriers: evaluation of the genetic risk". Molecular Human Reproduction (Oxford University Press for the European Society for Human Reproduction and Embryology) 8 (10): 958–963. ISSN 1460-2407. PMID 12356948. doi:10.1093/molehr/8.10.958. Consultado o 2008-12-26.
- ↑ E. Anton; J. Blanco, J. Egozcue, F. Vidal (April 29, 2004). "Sperm FISH studies in seven male carriers of Robertsonian translocation t(13;14)(q10;q10)". Human Reproduction (Oxford University Press) 19 (6): 1345–1351. ISSN 1460-2350. PMID 15117905. doi:10.1093/humrep/deh232. Consultado o 2008-12-25.
- ↑ 4,0 4,1 Semple CA, Devon RS, Le Hellard S, Porteous DJ (2001). "Identification of genes from a schizophrenia-linked translocation breakpoint region". Genomics 73 (1): 123–6. PMID 11352574. doi:10.1006/geno.2001.6516.
- ↑ Schaffer, Lisa. (2005) International System for Human Cytogenetic Nomenclature S. Karger AG ISBN 978-3-8055-8019-9
- ↑ 6,0 6,1 6,2 6,3 Li JY, Gaillard F, Moreau A; et al. (1999). "Detection of translocation t(11;14)(q13;q32) in mantle cell lymphoma by fluorescence in situ hybridization". Am. J. Pathol. 154 (5): 1449–52. PMC 1866594. PMID 10329598. doi:10.1016/S0002-9440(10)65399-0.
- ↑ 7,0 7,1 7,2 7,3 7,4 7,5 Chapter 20 in: Mitchell, Richard Sheppard; Kumar, Vinay; Abbas, Abul K.; Fausto, Nelson. Saunders, ed. Robbins Basic Pathology. Philadelphia. ISBN 1-4160-2973-7. 8th edition.
- ↑ 8,0 8,1 Kurzrock R, Kantarjian HM, Druker BJ, Talpaz M (2003). "Philadelphia chromosome-positive leukemias: from basic mechanisms to molecular therapeutics". Ann. Intern. Med. 138 (10): 819–30. PMID 12755554.
- ↑ 9,0 9,1 9,2 Page 626 in: Mitchell, Richard Sheppard; Kumar, Vinay; Abbas, Abul K.; Fausto, Nelson. Saunders, ed. Robbins Basic Pathology. Philadelphia. ISBN 1-4160-2973-7. 8th edition.