Fosfofrutoquinase-1
A fosfofrutoquinase-1[1] ou PFK-1 (ás veces escrita fosfofrutoquinase 1 ou PFK1) ou 6-fosfofrutoquinase con Número EC 2.7.1.11, é un dos encimas regulatorios máis importantes da glicólise. Cataliza a terceira reacción da glicólise, na cal a frutosa 6-fosfato e o ATP se converten en frutosa 1,6-bisfosfato e ADP. A reacción que cataliza é unha fosforilación dependente do ATP, que é un dos pasos limitantes e regulatorios chave da glicólise. É un encima alostérico constituído por catro subunidades e controlado por moitos activadores e inhibidores. A PFK-1 pode regular a glicólise por inhibición alostérica, e deste modo, a célula pode aumentar ou diminuír a velocidade da glicólise en resposta aos requirimentos enerxéticos da célula en cada momento. Por exemplo, unha alta proporción de ATP con respecto ao ADP inhibe a PFK-1 e a glicólise. As diferenzas chave entre a regulación da PFK-1 en eucariotas e procariotas é que nos eucariotas este encima é activado pola frutosa 2,6-bisfosfato. O propósito desta activación por frutosa 2,6-bisfosfato é superar a inhibición por ATP, o que permite aos eucariotas ter unha maior sensibilidade á regulación por hormonas como o glicagón e a insulina.[2]
| Fosfofrutoquinase-1 | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| |||||||||
| Identificadores | |||||||||
| Número EC | 2.7.1.11 | ||||||||
| Número CAS | 9001-80-3 | ||||||||
| Bases de datos | |||||||||
| IntEnz | vista de IntEnz | ||||||||
| BRENDA | entrada de BRENDA | ||||||||
| ExPASy | vista de NiceZyme | ||||||||
| KEGG | entrada de KEGG | ||||||||
| MetaCyc | vía metabólica | ||||||||
| PRIAM | perfil | ||||||||
| Estruturas PDB | RCSB PDB PDBe PDBj PDBsum | ||||||||
| Gene Ontology | AmiGO / EGO | ||||||||
| |||||||||
| Fosfofrutoquinase-1 | |||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| Identificadores | |||||||||||
| Símbolo | PFK | ||||||||||
| Pfam | PF00365 | ||||||||||
| Pfam clan | CL0240 | ||||||||||
| InterPro | IPR000023 | ||||||||||
| PROSITE | PDOC00336 | ||||||||||
| SCOPe | 5pfk / SUPFAM | ||||||||||
| |||||||||||
Reacción
editarA continuación un esquema da reacción catalizada pola fosfofrutoquinase-1 (a reacción inversa é catalizada pola frutosa 1,6-bisfosfatase ou frutosa bisfosfatase).
| β-D-frutosa 6-fosfato | Fosfofrutoquinase-1 | β-D-frutosa 1,6-bisfosfato | |
| ATP | ADP | ||
| Pi | H2O | ||
| Frutosa 1,6-bisfosfatase | |||
Nome
editarÁ parte da súa escritura con guión ou sen el (fosfofrutoquinase-1 ou fosfofrutoquinase 1, e aínda fosfofrutoquinase I), que se pode atopar das dúas maneiras na literatura e bases de datos de proteínas (ver a sección sinónimos de BRENDA e outras nas táboas), ás veces á fosfofrutoquinase-1 chámaselle simplemente fosfofrutoquinase en moitos textos, porque é a máis estudada e coñecida, aínda que existe tamén a fosfofrutoquinase-2 e outras fosfofrutoquinases. Outros nomes que recibiu a fosfofrutoquinase-1 son: 6-fosfofrutoquinase (que é o seu nome recomendado), 6-fosfofruto-1-quinase, frutosa-6-fosfato 1-quinase, e frutosa-6-fosfato 1-fosfotransferase, entre outros.[1]
Estrutura
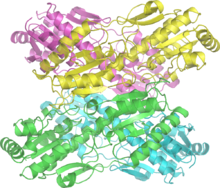
editarA PFK-1 de mamífero é un tetrámero de 340 kd[3] composto por catro subunidades que poden ser de tres tipos segundo o tecido que se trate: M (típica do músculo), L (do fígado, liver en inglés), e P (das plaquetas e outros tecidos). As subunidades de que consta o tetrámero dependerán do tipo de tecido. No caso do músculo maduro só se expresa o isoencima M, polo que o encima é alí un homotetrámero M4. No fígado e riles exprésase predominantemente a isoforma L. Nos eritrocitos exprésanse tanto as subunidades M coma a L, que se tetramerizan aleatoriamente formando os homotetrámeros M4, L4 e as formas híbridas ML3, M2L2 e M3L. Como resultado, as propiedades cinéticas e regulatorias dos varios isoencimas dependen da súa composición en subunidades. Os cambios específicos de tecido na actividade do encima e no contido de isoencimas contribúen significativamente á diversidade nas taxas de glicólise e gliconeoxénese que se observan en diferentes tecidos.[4]
A PFK-1 é un encima alostérico e ten unha estrutura similar á da hemoglobina no sentido de que é un dímero dun dímero.[5] Unha metade de cada dímero contén o sitio de unión para o ATP mentres que a outra metade ten o sitio de unión para o substrato frutosa 6-fosfato e un sitio adicional para a unión dun regulador alostérico.[6]
Cada subunidade do tetrámero ten 319 aminoácidos e consta de dous dominios, un para a unión do ATP e outro para a unión da frutosa 6-fosfato. Cada dominio é un barril beta, e ten unha lámina beta cilíndrica rodeada de hélices alfa.
En cada subunidade no lado oposto ao centro activo está o centro alostérico, na interface entre as subunidades do dímero. Aquí únese o ADP, que fai de regulador alostérico. O dominio N-terminal ten un papel catalítico e a el únese o ATP, mentres que o C-terminal ten un papel regulatorio.[7]
Mecanismo
editarA PFK-1 é un encima alostérico cuxa actividade pode describirse utilizando o modelo de simetría do alosterismo,[8] no cal hai unha transición concertada entre un estado T (tenso) encimaticamente inactivo e un estado R (relaxado) activo. A frutosa 6-fosfato únese con grande afinidade ao estado R do encima pero non ao estado T. Por cada molécula de frutosa 6-fosfato que se une á PFK-1, o encima cambia progresivamente do estado T ao R. Deste modo un gráfico da actividade da PFK-1 con concentracións crecentes de frutosa 6-fosfato ten forma de curva sigmoidal, típica dos encimas alostéricos.
A PFK-1 pertence á familia das fosfotransferases e cataliza a transferencia dun fosfato γ (gamma) desde o ATP á frutosa 6-fosfato. O sitio activo da PFK-1 comprende os sitios de unión para o ATP-Mg2+ e para a frutosa 6-fosfato. Algúns dos residuos que se propuxo que están implicados na unión do substrato na PFK-1 de E. coli son o Asp127 e a Arg171.[9] Na PFK-1 de Bacillus stearothermophilus, a cadea lateral cargada positivamente do residuo Arg162 forma unha ponte salina unida ao hidróxeno co grupo fosfato cargado negativamente da frutosa 6-fosfato, unha interacción que estabiliza o estado R en relación co estado T, e que é en parte responsable do efecto homotrópico da unión da frutosa 6-fosfato. No estado T, a conformación do encima cambia lixeiramente de tal modo que o espazo que previamente ocupaba a Arg162 é agora ocupado polo Glu161. Este intercambio de posicións entre residuos de aminoácidos adxacentes inhibe a unión da frutosa 6-fosfato ao encima.
Os activadores alostéricos como o AMP e o ADP únense ao sitio alostérico para facilitar a formación do estado R ao induciren cambios estruturais no encima. De xeito similar, os inhibidores como o ATP e o fosfoenolpiruvato únense ao mesmo sitio alostérico e facilitan a formación do estado T, inhibindo así a actividade do encima.
O oxíxeno do grupo hidroxilo do carbono 1 fai un ataque nucleofílico sobre o fosfato beta do ATP. Os electróns son impulsados ao oxíxeno anhidro que une os fosfatos beta e gamma do ATP.[10][11]
Regulación
editarA reacción da PFK-1 é o punto de control máis importante na vía glicolítica de mamíferos. Este paso está sometido a unha extensa regulación, xa que non só é moi exergónico en condicións fisiolóxicas, senón que tamén é a primeira reacción irreversible exclusiva da vía glicolítica. Esta regulación permite un control preciso da glicosa e outros monosacáridos como galactosa e frutosa que entran na vía glicolítica. Antes desta reacción encimática, a glicosa 6-fosfato pode potencialmente desviarse á vía da pentosa fosfato, ou ser convertida en glicosa 1-fosfato para ser utilizada na síntese de glicóxeno.
A PFK-1 é inhibida alostericamente por niveis altos de ATP pero o AMP inverte esta acción inhibitoria do ATP. Por tanto, a actividade do encima increméntase cando a proporción ATP/AMP na célula baixa. A glicólise está estimulada cando a carga de enerxía cae. A PFK-1 ten dous sitios con diferentes afinidades para o ATP, que é á vez inhibidor e substrato (xunto coa frutosa 6-fosfato) do encima.[3]
A PFK-1 é tamén inhibida polos pHs baixos (ácidos), os cales aumentan os efectos inhibitorios do ATP. O pH cae, por exemplo, cando os músculos están funcionando anaerobicamente e producindo ácido láctico e moito H+ (este último é o que causa a acidificación). Este efecto inhibitorio serve para protexer ao músculo dos danos que se poderían producir por esta acidez.[3]
Finalmente, a PFK-1 é inhibida alostericamente polo fosfoenolpiruvato (PEP) e probablemente polo citrato. O fosfoenolpiruvato é un produto das reaccións finais da glicólise. Xeralmente considérase que o citrato é outro inhibidor alostérico da PFK-1, pero discútese se in vivo os niveis de citrato son suficientes como para producir esta inhibición, aínda que si o fai coas concentracións dos experimentos in vitro.
A PFK1 é activada alostericamente por unha alta concentración de AMP, pero o seu activador máis potente é a frutosa 2,6-bisfosfato, que se produce tamén a partir da frutosa 6-fosfato por acción do encima fosfofrutoquinase-2. Así que, cando hai abundancia de frutosa 6-fosfato orixínanse maiores concentracións de frutosa 2,6-bisfosfato (F-2,6-BP). A unión ao encima da frutosa 2,6-bisfosfato incrementa a afinidade da PFK-1 pola frutosa 6-fosfato e diminúe o efecto inhibitorio do ATP. Isto é un exemplo de estimulación por feedforward (alimentación cara a adiante) que acelera a glicólise cando a glicosa é abundante.[3]
A PFK-1 é inhibida polo glicagón, que reprime a súa síntese. o glicagón activa a proteína quinase A, a cal, á súa vez, corta a actividade quinase da fosfofrutoquinase-2 (PFK-2). Isto inverte a síntese de frutosa 2,6-bisfosfato a partir de frutosa 6-fosfato e dese modo inhibe a actividade da PFK-1.
A regulación precisa da PFK-1 impide que a glicólise e a gliconeoxénese teñan lugar simultaneamente. Porén, hai un ciclo de substratos (ou ciclo fútil) entre a frutosa 6-fosfato e a frutosa 1,6-bisfosfato. O encima frutosa 1,6-bisfosfatase (FBPase) cataliza a hidrólise da frutosa 1,6-bisfosfato de novo a frutosa 6-fosfato, revertendo a reacción catalizada pola PFK-1. Hai unha pequena cantidade de actividade da FBPase durante a glicólise e algunha actividade da PFK1 durante a gliconeoxénese. Este ciclo permite a amplificación de sinais metabólicos e a xeración de calor por hidrólise de ATP.
A serotonina (5-HT) incrementa a actividade da PFK-1 ao unirse ao receptor 5-HT(2A), causando que un residuo de tirosina da PFK-1 sexa fosforilado pola vía da fosfolipase C. Como a PFK-1 regula o fluxo glicolítico en ratos, a serotonina exerce un papel regulatorio na glicólise.[12]
Xenes
editarHai tres xenes da fosfofrutoquinase-1 en humanos:
Importancia clínica
editarO principal trastorno causado polo mal funcionamento da PFK-1 é a enfermidade de Tauri. Unha mutación xenética no xene PFKM orixina unha deficiencia de fosfofrutoquinase chamada enfermidade de Tarui, que é unha enfermidade do almacenamento de glicóxeno na que a capacidade de certos tipos de células para utilizar os carbohidratos como fonte de enerxía está alterada.[13]
Enfermidade de Tarui: Os seus síntomas son debilidade muscular (miopatía) e cambras e espasmos inducidos polo exercicio, mioglobinuria (presenza de mioglobina na urina, que indica destrución do tecido muscular) e hemólise compensada. O ATP é un inhibidor da PFK-1, que impide a produción innecesaria de ATP por glicólise, pero a mutación Asp(543)Ala pode orixinar que o ATP teña un efecto inhibitorio moito máis forte (debido a que aumenta a súa unión ao sitio alostérico inhibitorio do encima).[14][15]
Mutacións na PFK-1 e cancro: Para que as células cancerosas obteñan a enerxía que cómpre para o seu rápido crecemento e división, é favorable que teñan un encima PFK-1 hiperactivo. Cando as células cancerosas crecen e se dividen tan rapidamente, inicialmente non teñen un subministración suficiente de sangue, e poden morrer de hipoxia (falta de oxíxeno), e isto activa a O-GlcNAcilación na serina 529 da PFK-1, o que lles dá unha vantaxe para o crecemento selectiva.[16][16][17][18]
As infeccións víricas e a PFK-1: Algúns virus, como o VIH, HCMV, Mayaro, e HCMV afectan a vías metabólicas celulares como a glicólise por un incremento dependente de MOI na actividade da PFK-1. O Herpes simplex tipo 1 (HSV-1) tamén afecta á PFK-1. O mecanismo por medio do que o Herpesvirus incrementa a actividade da PFK-1 é a fosforilación do encima en residuos de serina. A glicólise inducida polo HSV-1 incrementa o contido de ATP, o cal é vital para a replicación do virus.[19]
Notas
editar- ↑ 1,0 1,1 MeshName Phosphofructokinase-1.
- ↑ Usenik A, Legiša M (2010). Kobe, Bostjan, ed. "Evolution of allosteric citrate binding sites on 6-phosphofructo-1-kinase". PLOS ONE 5 (11): e15447. PMC 2990764. PMID 21124851. doi:10.1371/journal.pone.0015447.
- ↑ 3,0 3,1 3,2 3,3 Stryer L, Berg JM, Tymoczko JL (2007). Biochemistry (Sixth ed.). San Francisco: W.H. Freeman. ISBN 0-7167-8724-5.
- ↑ Dunaway GA, Kasten TP, Sebo T, Trapp R (1988). "Analysis of the phosphofructokinase subunits and isoenzymes in human tissues". Biochem. J. 251 (3): 677–83. PMC 1149058. PMID 2970843.
- ↑ "Phosphofructokinase: structure and control". Philosophical Transactions of the Royal Society of London. B, Biological Sciences (en inglés) 293 (1063): 53–62. 1981-06-26. ISSN 0080-4622. doi:10.1098/rstb.1981.0059.
- ↑ Shirakihara Y, Evans PR (1988). "Crystal structure of the complex of phosphofructokinase from Escherichia coli with its reaction products". J. Mol. Biol. 204 (4): 973–94. PMID 2975709. doi:10.1016/0022-2836(88)90056-3.
- ↑ Banaszak K, Mechin I, Obmolova G, Oldham M, Chang SH, Ruiz T, Radermacher M, Kopperschläger G, Rypniewski W. (2011). "The crystal structures of eukaryotic phosphofructokinases from baker's yeast and rabbit skeletal muscle". J Mol Biol. 402 (7): 284–97. PMC 1149058. PMID 21241708. doi:10.1016/j.jmb.2011.01.019.
- ↑ Peskov K, Goryanin I, Demin O (2008). "Kinetic model of phosphofructokinase-1 from Escherichia coli". J Bioinform Comput Biol 6 (4): 843–67. PMID 18763746. doi:10.1142/S0219720008003643.
- ↑ Hellinga HW, Evans PR (1987). "Mutations in the active site of Escherichia coli phosphofructokinase". Nature 327 (6121): 437–9. PMID 2953977. doi:10.1038/327437a0.
- ↑ Phong WY, Lin W, Rao SP, Dick T, Alonso S, Pethe K (2013). Parish, Tanya, ed. "Characterization of Phosphofructokinase Activity in Mycobacterium tuberculosis Reveals That a Functional Glycolytic Carbon Flow Is Necessary to Limit the Accumulation of Toxic Metabolic Intermediates under Hypoxia". PLOS ONE 8 (2): 1198–206. PMC 1149058. PMID 23409118. doi:10.1371/journal.pone.0056037.
- ↑ Papagianni M, Avramidis N (2012). "Engineering the central pathways in Lactococcus lactis: functional expression of the phosphofructokinase (pfk) and alternative oxidase (aox1) genes from Aspergillus niger in Lactococcus lactis facilitates improved carbon conversion rates under oxidizing conditions". Enzyme and Microbial Technology 51 (3): 125–30. PMID 22759530. doi:10.1016/j.enzmictec.2012.04.007.
- ↑ Coelho WS, Sola-Penna M. (2013). "Serotonin regulates 6-phosphofructo-1-kinase activity in a PLC-PKC-CaMK II- and Janus kinase-dependent signaling pathway". Mol Cell Biochem. 372 (1–2): 211–20. PMC 1149058. PMID 23010892. doi:10.1007/s11010-012-1462-0.
- ↑ Nakajima H, Raben N, Hamaguchi T, Yamasaki T (2002). "Phosphofructokinase deficiency; past, present and future". Curr. Mol. Med. 2 (2): 197–212. PMID 11949936. doi:10.2174/1566524024605734.
- ↑ Bruser A, KirchbergerJ, Schoneberg T (2012). "AAltered allosteric regulation of muscle 6-phosphofructokinase causes Tarui disease". Biochem Biophys Res Commun 427 (1): 133–7. PMC 1149058. PMID 22995305. doi:10.1016/j.bbrc.2012.09.024.
- ↑ Brüser A, Kirchberger J, Schöneberg T (2012). "Altered allosteric regulation of muscle 6-phosphofructokinase causes Tarui disease". Biochem. Biophys. Res. Commun. 427 (1): 133–7. PMID 22995305. doi:10.1016/j.bbrc.2012.09.024.
- ↑ 16,0 16,1 Yi W, Clark PM, Mason DE, Keenan MC, Hill C, Goddard WA 3rd, Peters EC, Driggers EM, Hsieh-Wilson LC (2012). "Phosphofructokinase 1 glycosylation regulates cell growth and metabolism". Science 337 (6097): 975–80. PMC 1149058. PMID 22923583. doi:10.1126/science.1222278.
- ↑ Gomez LS, Zancan P, Marcondes MC, Ramos-Santos L, Meyer-Fernandes JR, Sola-Penna M, Da Silva D (2013). "Resveratrol decreases breast cancer cell viability and glucose metabolism by inhibiting 6-phosphofructo-1-kinase". Biochimie. 1822 (8): 1198–206. PMC 1149058. PMID 23454376. doi:10.1016/j.biochi.2013.02.013.
- ↑ Vaz CV, Alves MG, Marques R, Moreira PI, Oliveira PF, Maia CJ, Socorro S (2012). "Androgen-responsive and nonresponsive prostate cancer cells present a distinct glycolytic metabolism profile". Int. J. Biochem. Cell Biol. 44 (11): 2077–84. PMID 22964025. doi:10.1016/j.biocel.2012.08.013.
- ↑ Abrantes JL, Alves CM, Costa J, Almeida FC, Sola-Penna M, Fontes CF, Souza TM (2012). "Herpes simplex type 1 activates glycolysis through engagement of the enzyme 6-phosphofructo-1-kinase (PFK-1)". Biochim Biophys Acta. 1822 (8): 1198–206. PMC 1149058. PMID 22542512. doi:10.1016/j.bbadis.2012.04.011.
Véxase tamén
editarOutros artigos
editar- Fosfofrutoquinase (páxina sobre os tipos de PFK)
- Fosfofrutoquinase-2 (converte a frutosa 6-fosfato e frutosa 2,6-bisfosfato)
- PFP (interconverte reversiblemente a frutosa 6-fosfato e a frutosa 1,6-bisfosfato utilizando un pirofosfato inorgánico en vez de ATP)
- Frutosa 1,6-bisfosfatase (hidroliza a frutosa 1,6-bisfosfato a frutosa 6-fosfato).