Frutosa-1,6-bisfosfatase
| |
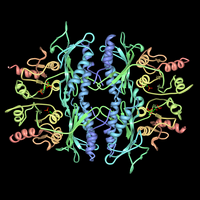
| Frutosa-1,6-bisfosfatase e o seu complexo coa frutosa 2,6-bisfosfato (PDB 3FBP). | |
Frutosa-1,6-bisfosfatase 1
| |
| Identificadores | |
| Símbolo | FBP1 |
| Símbolos alt. | FBP |
| Entrez | 2203 |
| HUGO | 3606 |
| OMIM | |
| RefSeq | NM_000507 |
| UniProt | P09467 |
| Outros datos | |
| Número EC | 3.1.3.11 |
| Locus | Cr. 9 q22.3 |
A frutosa-1,6-bisfosfatase, tamén chamada frutosa 1,6-bisfosfatase, frutosa bisfosfatase ou FBPase (número EC 3.1.3.11) é un encima que converte a frutosa 1,6-bisfosfato en frutosa 6-fosfato na gliconeoxénese e o ciclo de Calvin da fase escura da fotosíntese, que son ambas as dúas vías metabólicas anabólicas. A frutosa bisfosfatase cataliza unha reacción de hidrólise que é a inversa da reacción que cataliza a fosfofrutoquinase-1 na glicólise.[1][2] Estes dous encimas só catalizan a reacción nunha reacción, e son regulados por metabolitos como a frutosa 2,6-bisfosfato para que a actividae alta dun dos encimas vaia acompañada da actividade baixa do outro. A frutosa 2,6-bisfosfato inhibe alostericamente á frutosa-1,6-bisfosfatase, pero activa a fosfofrutoquinase-1. A frutosa-1,6-bisfosfatase está implicada en moitas vías metabólicas e encóntrase na maioría dos organismos. A FBPase require ións metálicos para a catálise (Mg2+ e Mn2+ son os preferidos) e o encima é inhibido potencialmente polo Li+.
| Frutosa-1,6-bisfosfatase | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| Identificadores | |||||||||
| Símbolo | FBPase | ||||||||
| Pfam | PF00316 | ||||||||
| Pfam clan | CL0171 | ||||||||
| InterPro | IPR000146 | ||||||||
| PROSITE | PDOC00114 | ||||||||
| SCOPe | 1frp / SUPFAM | ||||||||
| |||||||||
| Frutosa-1,6-bisfosfatase | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| Identificadores | |||||||||
| Símbolo | FBPase_2 | ||||||||
| Pfam | PF06874 | ||||||||
| Pfam clan | CL0163 | ||||||||
| InterPro | IPR009164 | ||||||||
| |||||||||
| Frutosa-1,6-bisfosfatase | |||||||||
|---|---|---|---|---|---|---|---|---|---|
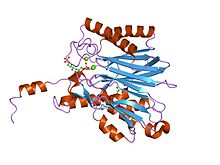 Estrutura cristalina da frutosa-1,6-bisfosfatase. | |||||||||
| Identificadores | |||||||||
| Símbolo | FBPase_3 | ||||||||
| Pfam | PF01950 | ||||||||
| InterPro | IPR002803 | ||||||||
| SCOPe | 1umg / SUPFAM | ||||||||
| |||||||||
| β-D-frutosa 1,6-bisfosfato | Frutosa-1,6-bisfosfatase | β-D-frutosa 6-fosfato | |

|

| ||
| H2O | Pi | ||

| |||
| ADP | ATP | ||
| Fosfofrutoquinase-1 | |||
Familia proteica da FBPase
editarO pregamento que presenta a frutosa-1,6-bisfosfatase de porco é idéntico ao da inositol-1-fosfatase (IMPase).[3] Ademais, a inositol polifosfato 1-fosfatase (IPPase), IMPase e FBPase comparten unha secuencia motivo (Asp-Pro-Ile/Leu-Asp-Gly/Ser-Thr/Ser) que se une a ións metálicos e participa na catálise. Este motivo tamén se encontra nos homólogos da IMPase relacionadas distantemente de bacterias, os lévedos Saccharomyces cerevisiae e outros fungos. Suxeriuse que estas proteínas definen unha antiga familia proteica conservada estruturalmente implicada en diversas vías metabólicas, como a sinalización por inositol, gliconeoxénese, asimilación do sulfato e posiblemente o metabolismo das quinonas.[4]
Identificáronse tres grupos diferentes de FBPases en eucariotas e bacterias, chamadas FBPase I, II e III.[5] Ningún destes grupos se atopou en arqueas ata agora, aínda que nas arqueas se identificou recentemente un novo grupo de FBPases, denominadas FBPase IV, que tamén teñen actividade de inositol monofosfatase.[6]
Outro grupo novo de FBPases, as FBPase V, atopouse en arqueas termófilas e nas bacterias hipertermófilas Aquifex aeolicus.[7] Os membros caracterizados deste grupo mostran especificiade de substrato estrita pola frutosa 1,6-bisfosfato, polo que se suxeriu que son verdadeiras FBPases nestes organismos.[7][8] Un estudo estrutural suxeriu que as FBPase V teñen un pregamento proteico que novo nunha fosfatase de azucres, que forma un sandwich de catro capas alfa-beta-beta-alfa, a diferenza do arranxo máis común en cinco capas alfa-beta-alfa-beta-alfa.[8] O arranxo das cadeas laterais catalíticas e ligandos metálicos concorda co mecanismo de catálise asistido por tres ións metálicos proposro para outras FBPases.
As frutosa-1,6-bisfosfatases atopadas nas bacterias Firmicutes (grampositivas de baixo GC) non mostran ningunha semellanza de secuencia cos encimas doutros organismos. O encima de Bacillus subtilis é inhibido polo AMP, aínda que este efecto pode ser eliminado polo fosfoenolpiruvato, e é dependente do Mn2+.[9][10] Os mutantes que carecen deste encima aparentemente aínda poden crecer con substratos gliconeoxénicos como o malato e o glicerol.
Notas
editar- ↑ Marcus F, Harrsch PB (1990). "Amino acid sequence of spinach chloroplast fructose-1,6-bisphosphatase". Arch. Biochem. Biophys. 279 (1): 151–7. PMID 2159755. doi:10.1016/0003-9861(90)90475-E.
- ↑ Marcus F, Gontero B, Harrsch PB, Rittenhouse J (1986). "Amino acid sequence homology among fructose-1,6-bisphosphatases". Biochem. Biophys. Res. Commun. 135 (2): 374–81. PMID 3008716. doi:10.1016/0006-291X(86)90005-7.
- ↑ Zhang Y, Liang JY, Lipscomb WN (1993). "Structural similarities between fructose-1,6-bisphosphatase and inositol monophosphatase". Biochem. Biophys. Res. Commun. 190 (3): 1080–3. PMID 8382485. doi:10.1006/bbrc.1993.1159.
- ↑ York JD, Ponder JW, Majerus PW (1995). "Definition of a metal-dependent/Li(+)-inhibited phosphomonoesterase protein family based upon a conserved three-dimensional core structure". Proc. Natl. Acad. Sci. U.S.A. 92 (11): 5149–53. PMC 41866. PMID 7761465. doi:10.1073/pnas.92.11.5149.
- ↑ Donahue JL, Bownas JL, Niehaus WG, Larson TJ (2000). "Purification and characterization of glpX-encoded fructose 1, 6-bisphosphatase, a new enzyme of the glycerol 3-phosphate regulon of Escherichia coli". J. Bacteriol. 182 (19): 5624–7. PMC 111013. PMID 10986273.
- ↑ Stec B, Yang H, Johnson KA, Chen L, Roberts MF (2000). "MJ0109 is an enzyme that is both an inositol monophosphatase and the 'missing' archaeal fructose-1,6-bisphosphatase". Nat. Struct. Biol. 7 (11): 1046–50. PMID 11062561. doi:10.1038/80968.
- ↑ 7,0 7,1 Rashid N, Imanaka H, Kanai T, Fukui T, Atomi H, Imanaka T (2002). "A novel candidate for the true fructose-1,6-bisphosphatase in archaea". J. Biol. Chem. 277 (34): 30649–55. PMID 12065581. doi:10.1074/jbc.M202868200.
- ↑ 8,0 8,1 Nishimasu H, Fushinobu S, Shoun H, Wakagi T (2004). "The first crystal structure of the novel class of fructose-1,6-bisphosphatase present in thermophilic archaea". Structure 12 (6): 949–59. PMID 15274916. doi:10.1016/j.str.2004.03.026.
- ↑ Fujita Y, Freese E (1979). "Purification and properties of fructose-1,6-bisphosphatase of Bacillus subtilis". J. Biol. Chem. 254 (12): 5340–9. PMID 221467.
- ↑ Fujita Y, Yoshida K, Miwa Y, Yanai N, Nagakawa E, Kasahara Y (1998). "Identification and expression of the Bacillus subtilis fructose-1, 6-bisphosphatase gene (fbp)". J. Bacteriol. 180 (16): 4309–13. PMC 107433. PMID 9696785.
Véxase tamén
editarOutros artigos
editarBibliografía
editar- Berg, Jeremy Mark; John L. Tymoczko, Lubert Stryer (2002). "Glycolysis and Gluconeogenesis". En Susan Moran (ed.). Biochemistry (5th Edition ed.). 41 Madison Avenue, New York, New York: W. H. Freeman and Company. ISBN 0-7167-3051-0.
Ligazóns externas
editar- Fructose-1,6-Biphosphatase Medical Subject Headings (MeSH) na Biblioteca Nacional de Medicina dos EUA.
Este artigo incorpora contidos de InterPro en dominio público (IPR000146, IPR009164, IPR002803).