Hidrólise do ATP
A hidrólise do ATP é a reacción catabólica por medio do cal a enerxía química que estaba almacenada nos chamados enlaces fosfoanhidro de alta enerxía do adenosín trifosfato (ATP) libérase ao romper estes enlaces, por exemplo para producir traballo en forma de enerxía mecánica (como no músculo), ou impulsar reaccións químicas ou outros trqanballos celulares ou producir calor. Os produtos desta hidrólise son o adenosín difosfato (ADP) e un fosfato inorgánico (Pi). O ADP pode despois ser hidrolizado para producir enerxía a adenosín monofosfato (AMP) e outro fosfato inorgánico (Pi).[1] A hidrólise do ATP é a ligazón final entre a enerxía derivada dos alimentos ou da luz do sol e o traballo útil como a contracción muscular, o establecemento de gradientes electroquimicos a través de membranas e os procesos biosintéticos que cómpren para manter a vida.
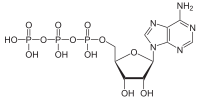
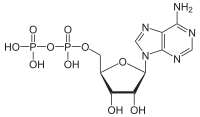

Na descrición e nos libros de texto habituais denomínanse os enlaces anhidro como "enlaces de alta enerxía". Os enlaces P-O son bastante fortes (~30 kJ/mol máis fortes que os enlaces C-N)[2][3] e non son especialmente fáciles de romper. Como se indica máis abaixo, a enerxía que se libera procede da hidrólise do ATP. Porén, cando rompe un enlace P-O, necesítase unha aportación de enerxía. É a formación de novos enlaces e fosfatos inorgánicos de enerxía máis baixa que realizan unha liberación dunha cantidade maior de enerxía o que rebaixa a enerxía total do sistema e faino máis estable.[1]
A hidrólise dos grupos fosfato do ATP é especialmente exergónica, porque o ión molecular de fosfato inorgánico resultante está moi estabilizado por múltiples estruturas de resonancia, facendo que os produtos (ADP e Pi) teñan unha enerxía máis baixa que o reactante (ATP). A alta densidade de carga negativa asociada coas tres unidades fosfato adxacentes do ATP tamén desestabiliza a molécula, facéndoa de maior enerxía. A hidrólise alivia algunhas das repulsións electrostáticas que se establecen, liberando enerxía útil no proceso ao causar cambios conformacionais na estrutura do encima.
Nos humanos aproximadamente o 60% da enerxía liberada na hidrólise do ATP produce calor metabólica en vez de impulsar as reaccións que están tendo lugar.[4] Debido ás propiedades ácido-básicas do ATP, ADP e fosfato inorgánico, a hidrólise do ATP ten o efecto de rebaixar (acidificar) o pH do medio de reacción. Baixo certas condicións, altos niveis de hidrólise de ATP poden contribuír a que se presente acidose láctica.
Cantidade de enerxía producida
editarA hidrólise do enlace fosfoanhidro terminal é un proceso altamente exergónico. A cantidade de enerxía liberada depende das condicións de cada célula. Concretamente, a enerxía liberada depende das concentracións de ATP, ADP e Pi. A medida que as concentracións destas moléculas se desvían dos valores no equilibrio, os cambios nos valores da enerxía libre de Gibbs (ΔG) serán cada vez máis diferentes. En condicións estándar (con concentracións de ATP, ADP e Pi iguais a 1M, e concentración da auga de 55 M) o valor de ΔG está entre -28 e -34 kJ/mol.[5][6]
Este rango de valores de ΔG existe porque esta reacción depende da concentración de catións Mg2+, o cal estabiliza a molécula de ATP. O ambiente celular tamén contribúe ás diferenzas no valor de ΔG, xa que a hidrólise do ATP depende non só da célula estudada, senón tamén do tecido que a rodea e mesmo do compartimento dentro da célula de que se trate. A variabilidade nos valores de ΔG é, por tanto, o que se debe esperar.[6]
As relacións entre o cambio ou incremento na enerxía libre de Gibbs estándar ΔrGo e o equilibrio químico son reveladoras. Esta relación defínese pola ecuación ΔrGo = -RT ln(K), onde K é a constante de equilibrio, que é igual ao cociente de reacción Q en equilibrio. O valor estándar de ΔG para esta reacción está, como xa se mencionou, entre -28 e -34 kJ/mol; porén, as concentracións determinadas experimentalmente das moléculas implicadas indican que a reacción non está en equilibrio.[6] Dado isto, unha comparación entre a constante de equilibrio, K, e o cociente de reacción, Q, proporciona moita información. K ten en consideración as reaccións que están tendo lugar en condicións estándar, pero no ambiente celular as concentracións das moléculas que interveñen (concretemente, ATP, ADP e Pi) están lonxe das estándar de 1 M. De feito, as concentracións mídense máis axeitadamente en mM, o cal é mil veces menor que o M.[6] Usando estas concentracións non estándar o valor calculado de Q é moito menor que 1. Relacionando Q con ΔG usando a ecuación ΔG = ΔrGo + RT ln(Q), onde ΔrGo é o cambio estándar na enerxía libre de Gibbs para a hidrólise do ATP, atópase que a magnitude de ΔG é moito maior que o valor estándar. As condicións non estándar da célula en realidade teñen como resultado que a reacción sexa máis favorable.[7]
Nun determinado estudo feito para determinar ΔG in vivo en humanos, medíronse as concentracións de ATP, ADP e Pi usando resonancia magnética nuclear.[6] En células musculares humana en repouso, a concentración de ATP era de arredor de 4 mM e a concentración de ADP de arredor de 9 μM. Introducindo estes valores nas ecuacións de arriba, isto rende unha ΔG = -64 kJ/mol. Despois da isquemia, cando o músculo se está a recuperar do exercicio, a concentración de ATP é de só 1 mM e a concentración de ADP é de arredor de 7 μM. Por tanto, a ΔG absoluta sería de -69 kJ/mol.[8]
Comparando o valor estándar de ΔG e o valor experimental de ΔG, pode verse como a enerxía liberada pola hidrólise do ATP, medida en humanos, é case o dobre que a enerxía producida en condicións estándar.[6][7]
Notas
editar- ↑ 1,0 1,1 Lodish, Harvey (2013). Molecular cell biology (7th ed.). New York: W.H. Freeman and Co. pp. 52, 53. ISBN 9781464109812. OCLC 171110915.
- ↑ Darwent, B. deB. (1970). "Bond Dissociation Energies in Simple Molecules", Nat. Stand. Ref. Data Ser., Nat. Bur. Stand. (U.S.) 31, 52 páxinas.
- ↑ "Common Bond Energies (D". www.wiredchemist.com. Consultado o 2020-04-04.
- ↑ Berne & Levy physiology. Berne, Robert M., 1918-2001., Koeppen, Bruce M., Stanton, Bruce A. (6th, updated ed.). Philadelphia, PA: Mosby/Elsevier. 2010. ISBN 9780323073622. OCLC 435728438.
- ↑ "Standard Gibbs free energy of ATP hydrolysis - Generic - BNID 101989". bionumbers.hms.harvard.edu. Consultado o 2018-01-25.
- ↑ 6,0 6,1 6,2 6,3 6,4 6,5 Philips, Ron Milo & Ron. "» How much energy is released in ATP hydrolysis?". book.bionumbers.org (en inglés). Consultado o 2018-01-25.
- ↑ 7,0 7,1 "ATP: Adenosine Triphosphate". cnx.org. Consultado o 2018-05-16.
- ↑ Wackerhage, H.; Hoffmann, U.; Essfeld, D.; Leyk, D.; Mueller, K.; Zange, J. (decembro de 1998). "Recovery of free ADP, Pi, and free energy of ATP hydrolysis in human skeletal muscle". Journal of Applied Physiology 85 (6): 2140–2145. ISSN 8750-7587. PMID 9843537. doi:10.1152/jappl.1998.85.6.2140.
Véxase tamén
editarOutros artigos
editarLigazóns externas
editar- Syberg, F.; Suveyzdis, Y.; Kotting, C.; Gerwert, K.; Hofmann, E. (2012). "Time-Resolved Fourier Transform Infrared Spectroscopy of the Nucleotide-binding Domain from the ATP-binding Cassette Transporter MsbA: ATP Hydrolysis ID The Rate-Limiting Step in the Catalytic Cycle". Journal of Biological Chemistry 278 (28): 23923–23931. PMC 3390668. PMID 22593573. doi:10.1074/jbc.M112.359208.
- Zharova, T. V.; Vinogradov, A. D. (2003). "Proton-Translocating ATP-synthase of Paracoccus denitrificans: ATP- Hydrolytic Activity". Biochemistry (Moscow) 68 (10): 1101–1108. PMID 14616081. doi:10.1023/A:1026306611821.
- Kamerlin, S. C.; Warshel, A. (2009). "On the energetics of ATP hydrolysis in solution". Journal of Physical Chemistry. B 113 (47): 15692–15698. PMID 19888735. doi:10.1021/jp907223t.
- Bergman, C.; Kashiwaya, Y.; Veech, R. L. (2010). "The effect of pH and Free Mg2+ on ATP Linked Enzymes and the Calculation of Gibbs Free Energy of ATP Hydrolysis". Journal of Physical Chemistry. B 114 (49): 16137–16146. PMID 20866109. doi:10.1021/jp105723r.
- Berg, J. M.; Tymoczko, J. L.; Stryer, L. (2011). Biochemistry (International ed.). Nova York: W. H. Freeman. p. 287.