Doenza pulmonar obstrutiva crónica
A doenza pulmonar obstrutiva crónica (DPOC) (en inglés COPD - chronic obstructive pulmonary disease) é unha enfermidade pulmonar caracterizada pola presenza dunha obstrución das vías aéreas (alvéolos, bronquíolos e bronquios, na meirande parte das veces de xeito progresivo e en xeral irreversíbel. A causa principal da DPOC é a inflamación crónica dos pulmóns por mor da inhalación de pequenas partículas nocivas e gases, sobre todo o fume do tabaco. É por iso que a DPOC é unha doenza prevíbel se se abandona o tabaquismo. A obstrución das vías aéreas provoca pois unha limitación do fluxo do ar aos pulmóns. Esta limitación do fluxo aéreo non é máis ca unha serie de procesos inflamatorios mesturados, como poden ser a bronquiolite obstrutiva, ou enfisema (destrución do parénquima). Co paso do tempo, estes procesos rematan por minguar a capacidade respiratoria do doente e chegan mesmo a acurtar considerábelmente a vida do paciente.[1] Entre un 20% e un 25% dos fumadores rematan por desenvolver a doenza.[2] Porén, aínda son descoñecidas as causas da predisposición ao padecemento da DPOC. Case que tódolos estudos confirman que pode ser un compoñente multifactorial o que determine a susceptibilidade individual á enfermidade, isto é, interveñen elementos xenéticos, como ambientais (alimentación, tabaco, estilo de vida etc). É a 4º causa de morte no mundo, e constitúe unha das doenzas na que non se conseguiu minguar a mortalidade nos derradeiros 30 anos.
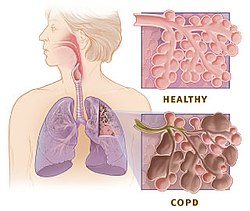
Definición
editarNo ano 2002, o Segundo Consenso Mexicano para o Diagnóstico e Tratamento da DPOC, definiuno coma unha doenza caracterizada pola limitación do fluxo aéreo, que non é modificábel significativamente e usualmente progresiva. Esta limitación asóciase cunha resposta inflamatoria anormal dos pulmóns e a vía aérea cuxos factores de risco máis importantes so a exposición a partículas nocivas e gases, principalmente derivados do consumo de tabaco e a exposición ao fume de leña. Segundo a iniciativa GOLD de 2006, na Guía para o manexo e prevención da DPOC:
A DPOC é unha doenza prevíbel e tratábel, con afección sistémica extrapulmonar que pode contribuír á gravidade nalgúns doentes. O compoñente pulmonar caracterízase por unha limitación do fluxo de aire (respiratorio) que pode ou non ser completamente reversíbel. A limitación ao fluxo de ar é polo xeral progresiva e asóciase a unha resposta inflamatoria pulmonar anómala a partículas ou gases tóxicos.[3]
Epidemioloxía
editarA prevalencia mundial da DPOC é arredor de entre o 5 e o 10 % da poboación adulta entre 40 e 80 anos. Se se considera o total da poboación, a prevalencia é de aproximadamente o 1 % en todas as idades.[4] A prevalencia é maior en homes, malia que nos últimos anos veuse detectando un aumento exponencial dos casos de DPOC en mulleres. Isto pode ser debido ao incremento do tabaquismo tamén nas mulleres nas últimas décadas. A DPOC adoita diagnosticarse tarde, xa que moitos doentes non presentan síntoma ningún. As probas de función respiratoria, como poden ser as espirometrías, poderían axudar a un diagnóstico precoz. A mortalidade por DPOC varía grandemente entre os diferentes países, sendo unha das principais causas de morte tanto nos países desenvolvidos coma nos subdesenvolvidos. O 96% dos doentes teñen máis de 40 anos.
O proxecto Platino, levado a termo pola ALAT (Asociación Latinoamericana del Tórax), foi quen de dar a coñecer a prevalencia da DPOC en cinco países de Iberoamérica (Brasil, Chile, México, Uruguai e Venezuela), variando moito as porcentaxes dun país ao outro, entre un 7,8% en Cidade de México e un 17 % en Montevideo[5]
Mortalidade
editarA mortalidade global da DPOC estaba na sexta posición con 2,2 millóns de mortes en 1990, e prevese unha tendencia en ascenso ata a terceira causa de morte en 2020.[6] Un estudo realizado nos Estados Unidos no período 1971-2000 mostrou que o cambio de maior importancia durante ese tempo foi o aumento da mortalidade nas mulleres, que pasou de 20,1/100 000 en 1980 a 56,7/100 000 en 2000.[7]
Morbilidade
editarDe forma global, a morbilidade da DPOC é elevada, aumenta coa idade e é superior en homes que en mulleres na actualidade.
Etioloxía
editarA DPOC está fundamentalmente asociada ao tabaquismo, sobre todo en países desenvolvidos. Nalgunhas sociedades moi deprimidas, debido á exposición a fumes tóxicos, pode desenvolverse EPOC. Tamén se dá casos, aínda que cada vez menos en países desenvolvidos, de persoas que cociñan con lume de leña en espazos reducidos e mal ventilados.
Factores de risco
editarNos países desenvolvidos, o tabaquismo contribúe ao 95 % dos casos de DPOC, sendo o factor de risco máis prevalecente.[8] Outros factores comunmente asociados a unha DPOC son:[9]
Factores do hóspede
editar- Factores xenéticos: Existen numerosos informes que afirman que na patoxénese da DPOC están ou deben estar implicados varios factores xenéticos ambientais. Partindo da base de que só un 15-20 % dos fumadores desenvolven a enfermidade, é lóxico pensar que a xenética debe desempeñar un papel importante na susceptibilidade individual. Con todo, o estudo Framingham suxire que, na poboación xeral, os factores xenéticos contribúen moi pouco na perda da función pulmonar,[10] co fluxo espiratorio en primeiro lugar (FEV1) influenciado principalmente por un locus no cromosoma 6. Un factor xenético establecido da DPOC é a deficiencia de α1-antitripsina (α1-AT) ou inhibidor da protease (α1-PI), aínda que a deficiencia de α1 (alelo ZZ do xene α1-antitripsina-PiZZ) sucede en menos do 1 % dos casos (ver imaxe).[11]
Xenes candidatos asociados ao desenvolvemento de DPOC.
|
- Dieta: Unha inxesta pobre en vitaminas antioxidantes (A, C, E) asociouse nalgunhas ocasións a un maior risco de DPOC[12][13] e en estudos máis recentes contémplase a importancia da vitamina C e do magnesio.[14] Existe algunha evidencia de que as dietas ricas en aceite de peixe van ligadas a unha menor prevalencia de DPOC, aínda que estudos similares non confirmaron estes achados. Algunhas outras evidencias sinalan que unha dieta baixa en carbohidratos cunha maior achega de graxas saudables no requirimento diario do individuo diminúe a produción de CO2, e podería ser beneficiosa para os pacientes con DPOC. Os flavonoides das froitas e verduras si que parecen beneficiosos.[15] Unha boa nutrición desde os primeiros anos da vida é moi importante e os recentemente nados de baixo peso para a súa idade xestacional teñén maior risco de desenvolver DPOC en etapas posteriores.
- Atopia e hiperreactividade bronquial: En pneumoloxía a chamada hipótese holandesa que propoñía que a atopia e a IgE estaban implicadas no desenvolvemento da DPOC.[16] A DPOC pode ter unha maior reactividade da vía aérea á histamina e á metacolina. Coñécese que a mortalidade por DPOC aumenta con atopia máis grave e con hiperreactividade da vía aérea.[17][18] Un estudo lonxitudinal indicou unha asociación entre a eosinoflía e a mortalidade por DPOC só en grupos que sufriran ataques de asma.[19]
- Sexo: Varios estudos atoparon unha maior prevalencia de DPOC en mulleres que en homes[20][21] Aínda que se discute se as mulleres son máis sensibles para os efectos do tabaco, existe evidencia que confirma que as adolescentes novas fumadoras alcanzan unha menor función pulmonar,[22] e que para a mesma cantidade de exposición ao tabaco, o risco de ter obstrución das vías respiratórias é maior en mulleres.[23] Nos países en desenvolvemento, as mulleres poden estar expostas en maior grao que os homes debido á contaminación ambiental ao usar combustibles na cociña.[24]
Causas
editarA etioloxía da EPOC é multifactorial, e nela interveñen tanto factores xenéticos coma ambientais. Porén, case un 95% dos casos de DPOC no mundo teñen o tabaco como factor asociado. As causas máis importantes de DPOC no mundo son o tabaquismo, a contaminación, as infeccións e factores xenéticos.
Tabaquismo
editarO consumo de tabaco é, sen dúbida, o principal factor de risco para padecer DPOC. Os fumadores teñen unha taxa de obstrución pulmonar maior ca os non fumadores. Ademais, dentro do grupo dos fumadores terá máis probabilidades de padecer DPOC os que máis cigarrillos consuman. Isto é, o factor de risco do tabaco é dependente da dose. O feito de que non todos os fumadores rematen por desenvolver DPOC evidencia que o tabaco non é o único factor de risco e que ha de haber outros factores xenéticos ou ambientais. Outro factor a ter en conta á hora de valorar o risco do tabaco é a idade de comezo do tabaquismo, sendo un comezo temperá un maior risco que un comezo tardío. O feito de ter pais fumadores tamén aumenta o risco de DPOC, polo feito de seren os fillos fumadores pasivos en moitos casos. Por último, o tabaco tamén altera as vías respiratorias inhibindo a motilidade dos cilios cuxa función é protexernos das infeccións. Isto, xunto cunha inhibición da función dos macrófagos (células da defensa), provoca un aumento das infeccións e da inflamación que contribúe a desencadear ou ben agravar o DPOC.
Contaminación ambiental
editarA prevalencia de DPOC é maior en cidades e áreas industrializadas. Ademais a incidencia e a mortalidade da bronquite crónica e o enfisema están moi relacionadas con altos niveis de dióxido de xofre.[25]
Contaminación no eido laboral
editarExiste un aumento no número de casos de DPOC en traballadores de certas industrias que manexan contaminantes. Estableceuse relación cos traballadores expostos a diisocianato de tolueno, algodón, minaría en xeral e o gran.[26]
Infeccións
editarAs infeccións respiratorias das vías altas durante as primeiras etapas da vida están asociadas a DPOC en etapas posteriores da vida.[27][28] As infeccións víricas latentes, como a do adenovirus, os rinovirus ou o virus respiratorio sincitial (VRS), poden causar amplificación das resposta inflamatoria no enfisema e predispor ao desenvolvemento da DPOC.[29]
Xenéticas
editarMáis do 95% das persoas con DPOC grave teñen o alelo do xene PiZZ. Estes individuos padecen enfisema prematuro, moitas veces acompañado de bronquiectasias e bronquilisis.
Xenes candidatos asociados ao desenvolvemento de DPOC
|
Fisiopatoloxía
editarNa DPOC prodúcense distintos fenómenos patolóxicos en cinco puntos anatómicos, o que resulta en varias manifestacións clínicas:[30]
- Bronquite crónica: inflamación crónica de vía aérea que conduce á hipersecreción mucosa con tose produtiva crónica.
- Bronquiolite obstrutiva: inflamación de vía aérea pequena que provoca fibrose e remodelado conducindo a obstrución de vía aérea.
- Enfisema: debido á destrución proteolítica con remodelaxe de bronquíolos e alvéolos.
- Doenza vascular pulmonar e cor pulmonale: por destrución de leito capilar pulmonar causando hipertensión arterial pulmonar e insuficiencia cardíaca dereita. Esta patoloxía coñécese como cor pulmonale.
- Doenza sistémica: en caso de DPOC avanzada hai inflamación extrapulmonar con caquexia e perda de masa magra con debilidade muscular.[30]
A resposta inflamatoria esaxerada á inhalación de partículas ou gases (fundamentalmente o fume do tabaco), alén dunha resposta inflamatoria «normal» de protección, é un evento característico da EPOC que provoca lesións pulmonares en fumadores susceptibles.[31][32] A lesión da célula epitelial bronquial e a activación dos macrófagos causan a liberación dos factores quimiotácticos que recrutan os neutrófilos da circulación. Os macrófagos e neutrófilos liberan entón unhas proteases que afectarán á metaloproteinases da matriz (MMP) e á elastase dos neutrófilos (NE) provocando alteracións no tecido conxuntivo. Unha vez secuestrados os neutrófilos adhírense á célula endotelial e migran ao tracto respiratorio baixo o control de factores quimiotácticos como o leucotrieno B4 ou a interleucina (IL)8.
Así mesmo, os linfocitos T CD8+ citotóxicos teñen un papel na cascada inflamatoria. Sinalouse que a presenza de linfocitos T podería diferenciar entre os fumadores que desenvolven DPOC e aqueles en que non a desenvolven, baseado na relación entre o número de células T, a cantidade de destrución alveolar e a intensidade de obstrución ao fluxo aéreo.[33] Unha das causas descritas para explicar a resposta inflamatoria amplificada na DPOC é a colonización da vía aérea por patóxenos bacterianos ou víricos.[34] É posible tamén que o fume do tabaco dane a célula epitelial bronquial xerando novos autoantíxenos que estimulan resposta inflamatoria, chegando a postular que a DPOC fose unha doenza autoinmune.[35]
A proteólise, a fibrose e a remodelaxe das vías aéreas pequenas son as características prominentes da patoloxía do enfisema. A célula endotelial vascular, os neumocitos e os mastocitos poden contribuír tamén na patoxenia da DPOC.
Cadro clínico
editarA DPOC asóciase fundamentalmente a dúas doenzas:
- Enfisema pulmonar: É o agrandamento permanente dos bronquíolos terminais, con destrución da parede alveolar, podendo ou non presentarse fibrose. Isto provoca o colapso das vías respiratorias. Adoita evidenciarse na clínica por polipnea e taquipnea, mais con diminución do murmurio vesicular na auscultación e por aumento do espazo retroesternal na radiografía lateral esquerda do tórax.[36] O perfil dos pacientes con enfisema (Perfil Pink Puffer) é astenia, arredor de 60 anos, escasa expectoración, dispnea precoz, leve alteración da difusión de gases, signos radiolóxicos de hiperinsuflación, moi baixa capacidade de difusión de CO e unha resistencia da vía aérea pouco alterada (ocasionalmente elevada). Estes pacientes obteñen pouca mellora clínica co uso de broncodilatadores e polo xeral progresan desfavorablemente co paso do tempo.[37]
- Bronquite crónica: É unha inflamación dos bronquios, que fai que se reduza o fluxo de ar que entra e sae dos pulmóns. Paralelamente, hai un aumento da secreción mucosa que obstrúe as vías respiratorias. En termos clínicos, considérase como crónica cando se aprecia tose e expectoración na maior parte dos días durante tres meses ao ano, en polo menos dous anos consecutivos.[38] O perfil dos pacientes que sofren bronquite crónica (Perfil Blue bloater) esé sobrepeso, arredor de 50 anos, expectoración abundante, dispnea tardía, grave alteración do intercambio de gases, cambios crónicos radiolóxicos, frecuente aparición de cor pulmonale, diminución leve da difusión de CO.
Diagnóstico
editarPara o diagnóstico de DPOC emprégase unha proba denominada espirometría, que mide a capacidade funcional pulmonar. Os suxeitos presentan unha FEV1 post-broncodilatador menor ao 80 % (agás no estadio 1, onde VEF1 é maior ou igual ao 80 %) e unha relación FEV1/FVC menor a 0,70.[39]
Tratamento
editarO tratamento desta doenza pretende evitar a progresión da enfermidade e aliviar os síntomas derivadas da mesma. A terapia con osíxeno é de uso obrigatorio en caso de diminución na concentración da saturación de osíxeno, ben sexa esta medida cuns gases arteriais ou cun oximetría de pulso.[40]
Os casos de enfermidade crónica trátanse con esteroides inhalados como a beclometasona; ademais úsase o bromuro de ipratropio, o tiotropio ou con glicopirronio bromuro. Recoméndase o uso de esteroides orais superior a catorce días como a prednisona, porque despois deste tempo non hai un efecto demostrado; usáronse esquemas de cinco días de tratamento oral con bos resultados con esteroides parenterais como a hidrocortisona ou metilprednisolona indícados no caso de que durante a enfermidade preséntese broncoespasmo, desta maneira redúcese a obstrución ao fluxo. O uso de teofilina non é contraditorio aínda que non se considera na maioría de escenarios. O uso de sulfato de magnesio é controversial, e algunhas guías reservan o seu uso para a asma. A fisioterapia respiratoria indícase como piar central no tratamento.[40]
Unha revisión sistemática de 15 estudos, a maioría realizados en Asia, particularmente na China, e un en Suráfrica, atopou evidencia de que a rehabilitación comunitaria xera un impacto positivo. Un dos casos estivo centrado na enfermidade pulmonar obstructiva crónica. Resulta necesaria unha avaliación custo-efectividade das rehabilitacións que permita avaliar a asignación dos recursos. [41]
Tratamento farmacolóxico
editarA base do tratamento farmacolóxico son medicamentos inhalados, con diferentes accións na árbore respiratoria:
- Corticosteroide: en forma inhalada, permite reducir a inflamación nos condutos respiratorios, interactuando en diferentes puntos co sistema inmune a este nivel. As formas inhaladas de corticoide (fluticasona etc) elevan o risco de padecer enfermidades infecciosas na cavidade oral por diminuír as defensas inmunitarias a este nivel. En formas graves da enfermidade ou en casos de reagudización, adoitan empregarse corticoides por vía oral ou endovenosa (prednisona, metilprednisolona etc), que diminúen de xeito considerable a inflamación en todo o organismo.
- Beta-adrenérxicos: son un conxunto de fármacos que dilatan os condutos respiratorios de forma notable. Divídense en fármacos de acción curta (salbutamol) e de acción longa salmeterol, formoterol). Incrementan o risco de arritmia cardíaca, especialmente os de acción curta.
- Anticolinérxicos: son un grupo de medicamentos que reducen as secrecións respiratorias e dilatan de xeito discreto as vías respiratorias. Divídense en fármacos de acción curta (bromuro de ipratropio e de acción longa (bromuro de tiotropio).
Osixenoterapia
editarEn xeral, a administración de osíxeno de forma crónica está indicada en pacientes con DPOC que teñen hipoxemia (PaO2 menor de 55 mm Hg), ou unha PaO2 entre 55 e 60 mm Hg asociado á hipertensión pulmonar, cor pulmonale ou poliglobulia secundaria (hematocrito >55 %). Nestes pacientes demostrouse que a osixenoterapia continua de polo menos 15 horas mellora a supervivencia.[42] Poden ser necesario baixos fluxos de osíxeno, dado que en pacientes con DPOC, o control da respiración está controlado fundamentalmente polos niveis de osíxeno máis que polos de carbónico, aumentos da entrega de osíxeno pode diminuír esta resposta e causar insuficiencia respiratoria con retención carbónica. As guías clínicas da American Thoracic Society sobre DPOC recollen o uso de osíxeno e os seus riscos.[43] Existe un consenso que indica unha meta máxima de saturación de osíxeno ata que a oximetría de pulso marque 92 %, xa que despois existe risco de hipercapnia inducida por osíxeno.[40]
Tratamento non farmacolóxico
editarRecoméndase a profilaxe da enfermidade tromboembólica venosa, en agudizacións que requiran ingreso, e asegurar un axeitado balance hídrico e soporte nutricional.[40]
Notas
editar- ↑ A. Martin Zurro: Claves diagnósticas en Medicina de Familia, atención al paciente con asma y EPOC en la consulta del médico de familia. Editorial Masson S.A. 2002, ISBN 84-458-1236-X
- ↑ "EPOC, una enfermedad que afecta al 25% de los fumadores". Infobae (en castelán). 5 de xaneiro de 2010. Consultado o 26 de mayo de 2020.
- ↑ Resumo 2006: Estratexia Global para Diagnostico, Tratamento e Prevención da Doenza Pulmonar Obstructica Crónica, Global Initiative for Chronic Obstructive Lung Disease (GOLD) 2006. Dispoñíbel en html: [1] Arquivado 16 de marzo de 2012 en Wayback Machine.
- ↑ "Copia archivada". Arquivado dende o orixinal o 27 de febreiro de 2015. Consultado o 24 de novembro de 2014.
- ↑ "Proxecto Platino". Arquivado dende o orixinal o 09 de decembro de 2012. Consultado o 15 de novembro de 2012.
- ↑ Murray et al. "Alternative projections of mortality and disability by cause 1990-2020": Global Burden of Disease Study.Lancet 1997;349:1498-504
- ↑ Mannino DM et al. Chronic obstructive pulmonary disease surveillance-United Sates, 1971-2000. Repir Care 2002;47:1148-9
- ↑ P.J.Barnes, S.D.Shapiroby R.A.Pauwels. «Enfermedad pulmonar obstructiva crónica: mecanismos moleculares y celulares.» Eur Respir J. (edición española) 2004;5(2):76-95.
- ↑ Postma, Dirkje S.; Bush, Andrew; Berge, Maarten van den (2015-03-07). "Risk factors and early origins of chronic obstructive pulmonary disease". The Lancet (en inglés) 385 (9971): 899–909. ISSN 0140-6736. PMID 25123778. doi:10.1016/S0140-6736(14)60446-3. Consultado o 29 de marzo do 2023.
- ↑ Gottlieb DJ, et al. «Heritability of longitudinal change in lung function. The Framinghan Study.» Am J Crit Care Med. 2001;164:1655-9.
- ↑ Dowson LJ, et al. «Longitudinal changes in physiological, radiological, and health status measurement in alpha(1)-antytripsin deficiency and factors associated with decline.» Am J Respir Crit Care Med 2001;164:1805-9.
- ↑ Britton JR et al Dietary antioxidant vitamin intake and lung function in the general population. Am. J. Respir Crit Care Med 1995;151:1383-7
- ↑ Morabia A. et al. «Vitamin A, cigarette smoking and airway obstruction.» Am Rev Respir Dis. 1989;1312-16.
- ↑ McKeever TM et al. «Propsective study of diet and decline in lung function in a general population.» Am Rev Respir Crit Care Med 2002;165:1299-303.
- ↑ Tabak C et al. «Chronic obstructive pulmonary disease and intake of catechins, flavonols and flavones: the MORGEN Study.» Am Repir Crit Care Med 2001;164:61-4.
- ↑ Orie NGM et al. «The host factor in bronchitis.» In Orie NGM, Sluiter HJ eds. Bronchitis, an international symposium Assen, Netherland:Royal Vangorcum, 1961.
- ↑ Hospers JJ et al. «Histamine airways hyper-responsiveness and mortality from chronic obstructive pulmonary disease:a cohort study.» Lancet 2000;356:1313-17
- ↑ Vestbo J et al. «Airways hiperresponsiveness and COPD mortality.» Thorax 2001;56(Suppl 2) 11-14.
- ↑ Hospers JJ. et al. «Asthma attacks with eosinophilia predictor mortality from chronic obstructive pulmonary disease in general population sample.» Am J Respir Crot Care Med. 1999;160:1869-74.
- ↑ Feinleib M. et al. Trends in COPD morbidity and mortality in the United States. Am. Rev Respir Dis 1989;140:S9-18
- ↑ Prescott E. et al Gender diffrerence in smoking effects on lung function and risk of hospitalization for COPD: results from a Danish longitudinal population study. Eur Respir J 1997;10:822-7
- ↑ Gold DR. et al.Effects of cigarrete smoking on lung function in adolecents boys and girls.N Eng J Med 1996;335:931-7
- ↑ Amaral, André F. S.; Strachan, David P.; Burney, Peter G. J.; Jarvis, Deborah L. (2017-05-01). "Female Smokers Are at Greater Risk of Airflow Obstruction Than Male Smokers. UK Biobank". American Journal of Respiratory and Critical Care Medicine 195 (9): 1226–1235. ISSN 1073-449X. doi:10.1164/rccm.201608-1545OC. Consultado o 30 de marzo do2023.
- ↑ Dennis RJ. et al. Woodsmoke exposure and risk for obstructive airways disease among wome. Chest 1996;109:115-9
- ↑ Abbey DE. et al. «Long-term particulate and other air pollutants and lunng function in nonsmokers.» Am J Respir Crit Care Med 1998;158:289-98.
- ↑ Davison AG. et al. Cadmium fume inhalation and emphysema. Lancet 1988;1:663-7
- ↑ Barker DJ et al. The intrauterine an early postnatal origins of cardiovascular disease and chronic bronchitis. J Epidemiol Community Health 1989;237-40
- ↑ Stracha DP. et al Chest illness in infancy and chronic respiratory disease in later life:an analisys by month of birth. Int Epidemiol 1994;23:1060-8
- ↑ Retamales I. et al. Amplification of inflammation in emphysema and its association with latent adenoviral infection. Am J Repir Crit Med 2001;164:469-73
- ↑ 30,0 30,1 T Hansel and Peter J. Barnes. Atlas de la Enfermedad Pulmonar Obstructiva Crónica2005. 1;en Parthenon Publishing
- ↑ Cosio et al. "Nuevas perspectivas terapéuticas farmacológicas en el manejo de la EPOC". Arch Bronconeumol 2007;43 Supl 4:27-35
- ↑ Hogg JC et al. "The nature of small airways obstruction in chronic obstructive disaese". N Engl J Med 2004;350:2654-53
- ↑ Saetta M et al. "CD8+ T-lymphocytes in peripheral airways of smokers with chronic obstructive pulmonary disease". Am J Respir Crit Care Med 1998;157:882-6
- ↑ Retamales et al. "Amplification of inflamamtion in emphysema and its association with latent adenoviral infection". Am J Respir Crit Care Med 2000;164:496-73
- ↑ Agusti A. et al. "Hypotesis: does COPD have an autoinmune component". Thorax 2003;58:832-4
- ↑ Snider GL. et al. "The definition of emphysema:report of National Heart, Lung and Blood Institute, Division of Lung Diseases, Workshop". Am Rev Respir Dis 1985; 132: 182-185.
- ↑ Myers, Allen R. (1997). Medicine (en inglés) (3.ª ed.). Lippincott Williams & Wilkins. pp. 71. ISBN 078172144X.
- ↑ Longmore, J. M.; Longmore, Murray; Wilkinson, Ian; Rajagopalan, Supraj R. (2004). Oxford handbook of clinical medicine. Oxford [Oxfordshire]: Oxford University Press. pp. 188-189. ISBN 0-19-852558-3.
- ↑ Myers, Allen R. (1997). Medicine (en inglés) (3.ª ed.). Lippincott Williams & Wilkins. pp. 66. ISBN 078172144X.
- ↑ 40,0 40,1 40,2 40,3 Holden, V; Slack, D; McCurdy, MT; Shah, NG (2017). "Diagnosis and Management of Acute Exacerbation of Chronic Obstructive Pulmonary Disease Confidence interval.". Emergency Medicine Practice 19 (10). PMID 28926214. Consultado o 14 de abril do 2023.
- ↑ Campbell Collaboration (2018). "Efectos positivos de la rehabilitación comunitaria para personas con discapacidades y sus cuidadores en países de ingresos medios y bajos". Oslo: Campbell Collaboration. Consultado o 31 de maio do 2023.
- ↑ Elsevier Article Locator
- ↑ Standards for the Diagnosis and Management of patients with COPD. American Thoracic Society y European Respiratory Society, 2004. American Thoracic Society e European Respiratory Society.
Véxase tamén
editar| Wikimedia Commons ten máis contidos multimedia na categoría: Doenza pulmonar obstrutiva crónica |
Outros artigos
editarLigazóns externas
editar- LA EPOC, una enfermedad evitable (1.01.2008) (en castelán)