Melanina
A melanina (do grego μέλας, negro) é un pigmento amplamente distribuído na nautreza, que se atopa na maioría dos organismos (agás nas arañas). É o pigmento que lle dá cor á pel, pelo e iris dos ollos. Nos animais a melanina deriva do aminoácido tirosina. A forma bioloxicamente máis común de melanina é a eumelanina, un polímero castaño escuro-negro de dihidroxiindol-ácidos carboxílicos, e as súas formas reducidas. Todas as melaninas teñen unha estrutura similar á dos derivados do poliacetileno, xa que se basean nunha estrutura policonxugada. Outra forma común da melanina é a feomelanina, un polímero vermello-castaño da benzotiazina principal responsable do pelo vermello e as pencas. Algunhas neuronas conteñen neuromelanina. A presenza de melanina nas arqueas e bacterias está sendo debatida polos investigadores nese eido.
O aumento da produción de melanina na pel humana chámase melanoxénese. A produción de melanina é estimulada polos danos no ADN inducidos pola radiación ultravioleta B,[1] e produce un bronceado, que tarda en desenvolverse pero é moi duradeiro.[2]
As propiedades fotoquímicas da melanina fan que sexa un excelente fotoprotector. Absorbe as radiacións ultravioleta nocivas e transforma a enerxía en calor. Pode disipar como calor máis do 99,9% da luz ultravioleta absorbida [3]. Isto impide os danos indirectos no ADN que son responsables do desenvolvemento de cánceres de pel como o melanoma maligno.
Nos seres humanos
editarNos humanos a melanina é o principal determinante da cor da pel. Tamén lle dá cor ao pelo e aos iris (cor dos ollos), e aparece no epitelio pigmentario que rodea a retina e no oído interno na estría vascular da cóclea. Outros tecidos con melanina inclúen certas partes da glándula suprarrenal, e as neuronas pigmentadas do tronco cerebral, como o locus coeruleus e a substancia negra.
A melanina da pel prodúcena os melanocitos, que se encontran na capa basal da epiderme, os cales transfiren a melanina aos queratinocitos. Aínda que, en xeral, os seres humanos posúen unha concentración de melanocitos similar na súa pel, os melanocitos dalgúns individuos e grupos étnicos expresan en maior ou menor medida os xenes para a produción de melanina, o que causará unha maior ou menor concentración de melanina na pel. Tanto en animais coma en humanos algúns individuos teñen moi pouca ou ningunha melanina, condición chamada albinismo.
Como a melanina é un polímero e, por tanto, un agregado de moléculas máis pequensas, hai moitos tipos diferentes de melaninas con diferentes proporcións e patróns de enlace das moléculas que a compoñen. Tanto a feomelanina coma a eumelanina están presentes na pel e pelo humanos, pero a eumelanina é a máis abundante nos humanos, e tamén a que máis frecuentemente é deficiente no albinismo.
Eumelanina
editarConsiderouse durante moito tempo que os polímeros de eumelanina constaban de numerosos polímeros 5,6-dihidroxiindol (DHI) e 5,6-dihidroxiindol-2-ácido carboxílico (DHICA) entrelazados. Porén, recentes investigacións sobre as propiedades eléctricas da eumelanima indicaron que pode consistir en oligómeros máis básicos adheridos un a outro por algún outro mecanismo. A eumelanina atópase no pelo, aréola, e pel. É máis abundante nos individuos de pel escura.
Hai dous tipos diferentes de eumelanina. Os dous tipos son a eumelanina negra e a castaña. A negra aparece principalmente entre os non europeos e nos europeos vellos, e a castaña principalmente nos europeos novos.
Unha pequena cantidade de eumelanina en ausencia doutros pigmentos orixina os cabelos grises. Unha pequena cantidade de eumelanina castaña en ausencia doutros pigmentos orixina cabelos louros.
Feomelanina
editarA feomelanina tamén se atopa na pel e pelo, tanto nos individuos de pel clara coma de pel escura. As feomelaninas están especialmente concentradas nos beizos, mamilas, glande do pene, e vaxina.[4] A feomelanina dá un ton rosa ou vermello, polo que é un pigmento que se atopa en grandes cantidades nos individuos roxos (de pelo vermello).[5] Quimicamente, a feomelanina difire da eumelanina en que a súa estrutura oligomérica incorpora unidades de benzotiazina e benzotiazol, que se producen,[6] en lugar do DHI e DHICA, cando o aminoácido L-cisteína está presente.
Neuromelanina
editarA neuromelanina é o pigmento escuro presente nas neuronas pigmentadas de catro núcleos profundos do encéfalo. Son a substancia negra, a pars compacta do locus coeruleus, o núcleo motor dorsal do nervio vago (par cranial X), e o núcleo do rafe medio da ponte de Varolio. Tanto a substancia negra coma o locus coeruleus poden identificarse facilmente nunha autopsia pola súa pigmentación escura. Nos humanos, estes núcleos non están pigmentados no momento do nacemento, pero desenvolven a súa pigmentación durante a maduración e a idade adulta.
Aínda que a natureza funcional da neuromelanina no encéfalo non se coñece, o pigmento está feito a partir de oxirradicais de neurotransmisores monoaminas como dopamina e norepinefrina. Luigi Zecca e David Sulzer demonstraron que o pigmento neuromelanina é un produto autofáxico que se acumula nos lisosomas, que non poden degradalo.[7] Neste sentido, a síntese de neuromelanina é protectora, xa que a súa encapsulación dentro do orgánulo autofáxico impídelle reaccionar no citosol neuronal causando unha posible neurotoxicidade.
Aínda que normalmente a neuromelanina se fai máis abondosa durante a vida na maioría da xente,[8] tamén se pode dar a perda de neuronas pigmentadas en núcleos específicos do encéfalo, que é signo de diversas enfermidades neurodexenerativas. Na enfermidade de Parkinson hai unha perda masiva de neuronas pigmentadas produtoras de dopamina na substancia negra e no locus coeruleus. Detéctanse tamén niveis elevados de neuromelanina noutros primates, e nos carnívoros como os gatos e cans.
Noutros organismos
editarAs melaninas teñen moi diversas funcións en distintos organismos. Unha forma de melanina serve para producir a tinta dos cefalópodos, que é unha defensa contra os depredadores. As melaninas tamén protexen a moitos microorganismos, como bacterias e fungos, contra os estreses ambientais que implican danos nas células, como a radiación ultravioleta do sol ou as especies reactivas do osíxeno. A melanina tamén protexe contra os danos por altas temperaturas, estreses químicos (como os metais pesados e axentes oxidantes), e ameazas bioquímicas (como as defensas do hospedador contra os microbios invasores).[9] Por tanto, en moitos microbios patóxenos (por exemplo, o fungo Cryptococcus neoformans) as melaninas parecen desempeñar un importante papel na virulencia e patoxenicidade ao protexeren ao microbio contra as respostas inmunitarias do hospedador. Nos invertebrados, unha parte importante das respostas defensivas innatas ou inespecíficas contra os patóxenos invasores implica á melanina. En poucos minutos despois dunha infección, o microbio é encapsulado en melanina (melanización), e pénsase que a xeración de subprodutos de radicais libres durante a formación desta cápsula axuda a matalos.[10] Algúns tipos de fungos, chamados fungos radiotróficos, parecen poder utilizar a melanina como pigmento que lles permite captar raios gamma e usar esa enerxía para biosínteses.[11][12]
As plumas negras dos paxaros deben a súa cor á melanina; estas plumas son degradadas moito máis facilmente polas bacterias ca as plumas brancas ou ca as que conteñen outros pigmentos como carotenos.[13]
As catecol melaninas son melaninas de plantas.
Rutas biosintéticas
editarO primeiro paso da vía biosintética das eumelaninas e feomelaninas é catalizado pola tirosinase:
- Tirosina → DOPA → dopaquinona
A dopaquinona pode combinarse coa cisteína por dúas rutas dando benzotiazinas e feomelaninas
- Dopaquinona + cisteína → 5-S-cisteinildopa → intermediato benzotiazina → feomelanina
- Dopaquinona + cisteína → 2-S-cisteinildopa → intermediato benzotiazina → feomelanina
Alternativamente, a dopaquinona pode converterse en leucodopacromo e seguir dúas vías máis para dar eumelanina
- Dopaquinona → leucodopacromo → dopacromo → 5,6-dihidroxuindol-2-ácido carboxílico → quinona → eumelanina
- Dopaquinona → leucodopacromo → dopacromo → 5,6-dihidroxiindol → quinona → eumelanina
Aparencia microscópica
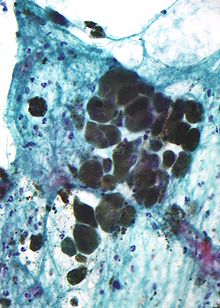
editarA melanina é castaña, non refractil, e finamente granular con gránulos individuais dun diámetro de menos de 800 nanómetros. Isto diferencia a melanina doutros pigmentos comúns, como os resultantes da degradación de pigmentos sanguíneos, que son máis grandes, macizos, e refrinxentes, e cunha cor que vai do verde ao amarelo ou vermello-castaño. En zonas danadas moi pigmentadas, os agregados densos de melanina poden escurecer os detalles histolóxicos. Un efectivo decolorante da melanina é unha solución diluída de permanganato potásico.
Trastornos xenéticos e enfermidades
editarA deficiencia de melanina está asociada con varias anormalidades xenéticas e doenzas.
Hai aproximadamente dez tipos de albinismo oculocutáneo (OCA), que é principalmente un trastorno recesivo autosómico [14]. Certas etnias teñen unha maior incidencia de determinadas formas. por exemplo, o tipo máis común, chamado albinismo oculocutáneo de tipo 2 (OCA2), é un trastorno recesivo caracterizado por unha redución conxénita ou ausencia do pigmento melanina na pel, pelo e ollos,[15] que é especialmente frecuente entre as persoas de orixe africana. Por exemplo, nos Estados Unidos, a frecuencia estimada de OCA2 entre os afroamericanos é de 1/10.000, que contrasta coa dos norteamericanos brancos, que é de 1/36.000. Nalgunhas nacións africanas, a frecuencia do trastorno é sete veces maior, entre 1/2.000 e 1/5.000.[16] Outra forma de albinismo, o "albinismo oculocutáneo amarelo", parece ser máis frecuente entre os Amish, que son de ascendencia principalmente suíza e alemá. A xente coa variante IB xeralmente teñen o pelo e a pel brancos ao naceren, pero rapidamente desenvolven unha pigmentación normal na pel durante a infancia.[16]
O albinismo ocular afecta non só á pigmentación dos ollos, senón tamén á agudeza visual.
Tamén se está a estudar o papel que pode xogar a melanina nas síndromes de Hermansky-Pudlak e Chediak-Higashi. Na primeira prodúcese unha predisposición ás hemorraxias, fibrose pulmonar e cardiomiopatía. Na segunda son susceptibles a infeccións e poden desenvolver o mal linfofolicular maligno.[16]
A conexión entre o albinismo e a xordeira, que se dá nos homes e varios animais, non se comprende ben. Parece que ten que ver con trastornos nos melanocitos e non coa síntese de melanina. A ausencia de melanocitos na estría vascular da cóclea orixina a xordeira.[17] Nos humanos a hipopigmentación e a xordeira están asociados na pouco frecuente síndrome de Waardenburg, observada predominantemente entre os indios hopi de América do Norte.[18][19][20].
Na enfermidade de Parkinson, que afecta ao funcionamento neuromotor, obsérvase un descenso de neuromelanina na substancia negra e no locus coeruleus como consecuencia dunha diminución das neuronas dopaminérxicas e noradrenérxicas pigmentadas.[21][22]
Ademais da deficiencia de melanina, o peso molecular do polímero de melanina pode decrecer por varios factores como o estrés oxidativo, exposición á luz, perturbación da súa asociación coas proteínas da matriz melanosómicas, e cambios de pH ou das concentracións locais de ións metálicos. Suxeriuse que un descenso do peso molecular ou unha diminución no grao de polimerización da melanina ocular cambia as propiedades normalmente antioxidantes do polímero en prooxidantes, o que pode causar a progresión da dexeneración macular e melanoma.[23]
A nicotina ten afinidade polos tecidos que conteñen melanina pola súa función precursora na síntese de melanina ou a súa unión irreversible coa melanina.[24]
Notas
editar- ↑ Agar N, Young AR (2005). "Melanogenesis: a photoprotective response to DNA damage?". Mutation research 571 (1–2): 121–32. PMID 15748643. doi:10.1016/j.mrfmmm.2004.11.016.
- ↑ "tanning tips". Arquivado dende o orixinal o 05 de xaneiro de 2012. Consultado o 06 de xaneiro de 2012.
- ↑ Meredith P, Riesz J (2004). "Radiative relaxation quantum yields for synthetic eumelanin". Photochemistry and photobiology 79 (2): 211–6. ISSN 0031-8655. PMID 15068035.
- ↑ Vincent J. Hearing and Katsuhiko Tsakamoto (1991). "Enzymatic control of pigmentation in mammals" (PDF). The FASEB Journal 5 (14): 2902–2909. PMID 1752358.
- ↑ V.Krishnaraj, M.D, Skin Layers [1] Arquivado 21 de maio de 2008 en Wayback Machine. Retrieved 2008-03-14
- ↑ Greco, Giorgia; Lucia Panzella, Luisella Verotta, Marco d’Ischia, Alessandra Napolitano (2011). "Uncovering the Structure of Human Red Hair Pheomelanin:Benzothiazolylthiazinodihydroisoquinolines As Key Building Blocks". Journal of Natural Products 74 (4): 675–82. PMID 21341762. doi:10.1021/np100740n.
- ↑ Sulzer, D.; Mosharov, E.; Talloczy, Z.; Zucca, F. A.; Simon, J. D.; Zecca, L. (2008). "Neuronal pigmented autophagic vacuoles: Lipofuscin, neuromelanin, and ceroid as macroautophagic responses during aging and disease". Journal of Neurochemistry 106 (1): 24–36. doi:10.1111/j.1471-4159.2008.05385.x. PMID 18384642.
- ↑ Zecca, Luigi; et al. (2002). "The absolute concentration of nigral neuromelanin, assayed by a new sensitive method, increases throughout the life and is dramatically decreased in Parkinson’s disease". FEBS Letters 510 (3): 216–220. doi:10.1016/S0014-5793(01)03269-0.
- ↑ Hamilton AJ, Gomez BL. (2002). "Melanins in fungal pathogens". J. Med. Microbiol 53 (3): 189–91. PMID 11871612.
- ↑ Cerenius L, Söderhäll K (2004). "The prophenoloxidase-activating system in invertebrates". Immunological reviews 198: 116–26. PMID 15199959. doi:10.1111/j.0105-2896.2004.00116.x.
- ↑ Science News, Dark Power: Pigment seems to put radiation to good use, Week of May 26, 2007; Vol. 171, No. 21 , p. 325 by Davide Castelvecchi
- ↑ Dadachova E, Bryan RA, Huang X, Moadel T, Schweitzer AD, Aisen P, Nosanchuk JD, Casadevall A. (2007). Rutherford, Julian, ed. "Ionizing radiation changes the electronic properties of melanin and enhances the growth of melanized fungi". PLoS ONE 2 (5): e457. PMC 1866175. PMID 17520016. doi:10.1371/journal.pone.0000457.
- ↑ Grande, Juan Manuel; Negro, Juan José; María Torres, José (2004). "The evolution of bird plumage colouration; a role for feather-degrading bacteria?". Ardeola 51 (2): 375–383.
- ↑ Dr. Mohammed O. Peracha, Dean Elloit, and Enrique Garcia-Valenzuela, "Occular Manifestations of Albinism" (Abstract at emedicine.com, Sept. 13, 2005).
- ↑ "Oculocutaneous Albinism". Arquivado dende o orixinal o 23 de decembro de 2008. Consultado o 06 de xaneiro de 2012.
- ↑ 16,0 16,1 16,2 "Ocular Manifestations of Albinism"
- ↑ "Termination of British Library Net internet service". Arquivado dende o orixinal o 23 de setembro de 2006. Consultado o 06 de xaneiro de 2012.
- ↑ OMIM Result
- ↑ Omim - Tyrosinase; Tyr
- ↑ Cable J, Huszar D, Jaenisch R, Steel KP (1994). "Effects of mutations at the W locus (c-kit) on inner ear pigmentation and function in the mouse". Pigment Cell Research 7 (1): 17–32. PMID 7521050. doi:10.1111/j.1600-0749.1994.tb00015.x.
- ↑ "Lewy Body Disease". Arquivado dende o orixinal o 21 de xullo de 2009. Consultado o 06 de xaneiro de 2012.
- ↑ Nicolaus BJ (2005). "A critical review of the function of neuromelanin and an attempt to provide a unified theory". Med. Hypotheses 65 (4): 791–6. PMID 15949901. doi:10.1016/j.mehy.2005.04.011.
- ↑ Meyskens FL, Farmer P, Fruehauf JP (2001). "Redox regulation in human melanocytes and melanoma". Pigment Cell Research 14 (3): 148–54. PMID 11434561. doi:10.1034/j.1600-0749.2001.140303.x.
- ↑ King G, Yerger VB, Whembolua GL, Bendel RB, Kittles R, Moolchan ET. Link between facultative melanin and tobacco use among African Americans.(2009). Pharmacol Biochem Behav. 92(4):589-96. PMID 19268687
Véxase tamén
editarOutros artigos
editarLigazóns externas
editar- Espectro de absorción da melanina.
- "Link 4-Melanin 95-97," de R.A.Nicolaus,G.Scherillo La Melanina.Un riesame su struttura, proprietà e sistemi, Atti della Accademia Pontaniana, Vol.XLIV,265-287, Napoli 1995.[2]