Glicosa-6-fosfato isomerase
A glicosa-6-fosfato isomerase, tamén chamada glicosa fosfato isomerase, fosfoglicosa isomerase (PGI) ou fosfohexosa isomerase[1], é un encima que cataliza a conversión da glicosa 6-fosfato en frutosa 6-fosfato no segundo paso da glicólise.
| Glicosa-6-fosfato isomerase | |||
|---|---|---|---|
 | |||
| Estruturas dispoñibles | |||
| PDB | Buscar ortólogos: PDBe, RCSB | ||
| Identificadores | |||
| Nomenclatura | Outros nomes
| ||
| Símbolos | GPI (HGNC: 4458) AMF; NLK; PGI; PHI; GNPI; SA-36 | ||
| Identificadores externos | |||
| Número EC | 5.3.1.9.html 5.3.1.9 | ||
| Locus | Cr. 19 q13.1 | ||
| Taxon | Eukaryota (ID:2759) NCBI UniProt; Bacteria (ID:2) NCBI UniProt; Archaea (ID:2157) NCBI UniProt | ||
| Padrón de expresión de ARNm | |||
 | |||
| Máis información | |||
| Estrutura/Función proteica | |||
| Tamaño | 558 (aminoácidos) | ||
| Tipo de proteína | Isomerase | ||
| Datos encimáticos | |||
| Actividade catalítica | Isomerización de Glc-6P a Fru-6P | ||
| Datos biotecnolóxicos/médicos | |||
| Enfermidades | Anemia hemolítica por deficiencia de GPI | ||
| Información adicional | |||
| Ruta(s) | Glicólise, Gliconeoxénese, Ruta das pentosas fosfato, Metabolismo de amidón e sacarosa | ||
| Ortólogos | |||
| Especies |
| ||
| Entrez |
| ||
| Ensembl |
| ||
| UniProt |
| ||
| RefSeq (ARNm) |
| ||
| RefSeq (proteína) NCBI |
| ||
| Localización (UCSC) |
| ||
| PubMed (Busca) |
| ||
| Glicosa-6-fosfato isomerase | |||||||||
|---|---|---|---|---|---|---|---|---|---|
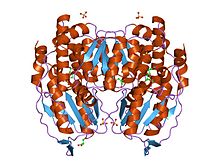 Estrutura cristalina da fosfoglicosa/fosfomanosa isomerase de Pyrobaculum aerophilum en complexo coa frutosa 6-fosfato | |||||||||
| Identificadores | |||||||||
| Símbolo | bact-PGI_C | ||||||||
| Pfam | PF10432 | ||||||||
| InterPro | IPR019490 | ||||||||
| |||||||||
| Glicosa-6-fosfato isomerase | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| Identificadores | |||||||||
| Símbolo | PGI | ||||||||
| Pfam | PF00342 | ||||||||
| SCOPe | 1pgi / SUPFAM | ||||||||
| |||||||||

A variante humana deste encima está codificada polo xene GPI situado no cromosoma 19.[2]
Estrutura
editarOs monómenros deste encima están constituídos por dous dominios, un formado por dous segmentos separados chamado dominio grande, e o outro formado por un segmento situado en medio chamado dominio pequeno.[3] Os dous dominios son sándwichs αβα. O dominio pequeno contén unha folla β de cinco cadeas rodeadas por hélices α, mentres que o dominio grande ten unha folla β de seis cadeas.[4] O dominio grande e o C-terminal de cada monómero conteñen tamén protrusións que son como "brazos".[3]
O encima completo funcional é un dímero composto por dous monómeros idénticos. Os dous monómeros interactúan principalmente por medio das dúas protrusións como se se deran unha aperta. O sitio activo de cada monómero está formado por unha fenda entre os dous dominios e a interface do dímero.[4]
Mecanismo
editarO mecanismo que a glicosa-6-fosfato isomerase utiliza para interconverter a glicosa-6-fosfato e a frutosa 6-fosfato consta de tres pasos: abertura do anel da glicosa, isomerización da glicosa en frutosa por medio dun intermediato enediol, e peche do anel de frutosa.[6]
A glicosa 6-fosfato únese ao encima como un anel hemiacetal. O anel ábrese por un mecanismo de "empuxar-tirar" pola His en posición 388, o cal protona ao oxíxeno C5, e pola Lys518, que desprotona o grupo hidroxilo do C1. Isto crea unha cadea aberta de aldosa. Despois, o substrato rota arredor do enlace C3-C4 para posicionalo para a isomerización. Neste punto o Glu357 desprotona o C2 para orixinar un intermediato cis-enediolato estabilizado pola Arg272. Para completar a isomerización, o Glu357 doa o seu protón a C1, o grupo hidroxilo de C2 perde o seu protón e fórmase a cetosa de cadea aberta, frutosa 6-fosfato. Finalmente, o anel péchase ao rotar o substrato de novo sobre o enlace C3-C4 e desprotonar o hidroxilo C5 coa Lys518 para causar o oposto ao producido durante o mecanismo de abertura do anel co que comezara a reacción.[5]
Función
editarO xene deste encima pertence á familia GPI cuxos membros codifican proteínas fosfoglicosa isomerases multifuncionais implicadas en rutas de produción de enerxía. A proteína codificada por este xene nos humanos é un encima dimérico que cataliza a isomerización reversible da glicosa-6-fosfato e a frutosa-6-fosfato.
glicosa 6-fosfato ⇌ frutosa 6-fosfato
A proteína ten diferentes funcións dentro e fóra da célula. No citoplasma, a proteína está implicada na glicólise e gliconeoxénese, pero fóra da célula funciona como un factor neurotrófico para as neuronas sensoriais e espiñais. A mesma proteína tamén a segregan as células cancerosas, nas cales se chama factor de motilidade autócrino[7] e estimula a metástase.[8] Certos defectos neste xene son a causa da anemia hemolítica non esferocítica, e unha grave deficiencia do encima pode ser asociada coa hidropesía fetal, morte neonatal inmediata e trastorno neurolóxico.[2]
Glicólise
editar| α-D-Glicosa 6-fosfato | Fosfoglicosa isomerase | β-D-Frutosa 6-fosfato | |
| Fosfoglicosa isomerase | |||
Isomerización da glicosa
editar| D-Glicosa | Fosfoglicosa isomerase | D-Frutosa | |
| Fosfoglicosa isomerase | |||
Neuroleucina
editarA tecnoloxía da clonación demostrou que a PGI é case idéntica á proteína neuroleucina (ou neuroleuquina), aínda que inicialmente foran tratadas como proteínas distintas.[9] A neuroleucina é un factor neurotrófico para as neuronas sensoriais e espiñais. Atópase en grandes cantidades no músculo, cerebro, corazón, e riles.[10]
A neuroleucina tamén actúa como linfocina segregada polas células T estimuladas pola lectina. Induce a secreción de inmunoglobulinas polas células B como parte da resposta que activa as células secretoras de anticorpos.[11]
Factor de motilidade autócrino de célula tumoral
editarOs experimentos de clonación revelaron tamén que a PGI é idéntica á proteína coñecida como factor de motilidade autócrino.[12] O factor de motilidade autócrino producido e segregado polas células cancerosas estimula o crecemento celular e a motilidade como factor de crecemento.[13] O factor de motilidade autócrino crese que xoga un papel chave na metástase do cancro.[14]
Glicosa-6-fosfato bifuncional procariótica
editarNalgunhas bacterias e arqueas a actividade de glicosa-6-fosfato isomerase (PGI) realízaa un encima bifuncional que tamén ten actividade de fosfomanosa isomerase (PMI). Aínda que non está relacionado estreitamente cos PGIs eucarióticos, o encima bifuncional é bastante similar e a súa secuencia inclúe o cluster de treoninas e serinas que forma o sitio de unión do azucre fosfato na PGI convencional. O encima crese que utiliza o mesmo mecanismo catalítico para a abertura do anel de glicosa e para a isomerización para así realizar a interconversión da glicosa 6-fosfato a frutosa 6-fosfato.[15]
Importancia clínica
editarA responsable do 4% das anemias hemolíticas debidas a deficiencias en encimas glicolíticos é unha deficiencia de glicosa-6-fosfato isomerase (ou fosfoglicosa isomerase).[16][17][18]
Identificáronse recentemente varios casos de deficiencia de glicosa-6-fosfato isomerase.[19]
Notas
editar- ↑ OMIM GPI
- ↑ 2,0 2,1 "Entrez Gene: GPI glucose phosphate isomerase".
- ↑ 3,0 3,1 Sun YJ, Chou CC, Chen WS, Wu RT, Meng M, Hsiao CD (1999). "The crystal structure of a multifunctional protein: phosphoglucose isomerase/autocrine motility factor/neuroleukin". Proc Natl Acad Sci U S A 96 (10): 5412–5417. PMC 21873. PMID 10318897.
- ↑ 4,0 4,1 Jeffery CJ, Bahnson BJ, Chien W, Ringe D, Petsko GA (2000). "Crystal structure of rabbit phosphoglucose isomerase, a glycolytic enzyme that moonlights as neuroleukin, autocrine motility factor, and differentiation mediator". Biochemistry 39 (5): 955–64. PMID 10653639. doi:10.1021/bi991604m.
- ↑ 5,0 5,1 Graham Solomons JT, Zimmerly EM, Burns S, Krishnamurthy N, Swan MK, Krings S, Muirhead H, Chirgwin J, Davies C (2004). "The crystal structure of mouse phosphoglucose isomerase at 1.6A resolution and its complex with glucose 6-phosphate reveals the catalytic mechanism of sugar ring opening". J Mol Biol. 342 (3): 847–60. PMID 15342241. doi:10.1016/j.jmb.2004.07.085.
- ↑ Read J, Pearce J, Li X, Muirhead H, Chirgwin J, Davies C (2001). "The crystal structure of human phosphoglucose isomerase at 1.6 A resolution: implications for catalytic mechanism, cytokine activity and haemolytic anaemia". J Mol Biol. 309 (2): 447–63. PMID 11371164. doi:10.1006/jmbi.2001.4680.
- ↑ Dobashi Y, Watanabe H, Sato Y; et al. (2006). "Differential expression and pathological significance of autocrine motility factor/glucose-6-phosphate isomerase expression in human lung carcinomas". J. Pathol. 210 (4): 431–40. PMID 17029220. doi:10.1002/path.2069.
- ↑ Watanabe H, Takehana K, Date M, Shinozaki T, Raz A (1 July 1996). "Tumor cell autocrine motility factor is the neuroleukin/phosphohexose isomerase polypeptide". Cancer Res. 56 (13): 2960–3. PMID 8674049.
- ↑ Chaput M, Claes V, Portetelle D, Cludts I, Cravador A, Burny A, Gras H, Tartar A (1988). "The neurotrophic factor neuroleukin is 90% homologous with phosphohexose isomerase". Nature 332 (6163): 454–5. PMID 3352744. doi:10.1038/332454a0.
- ↑ Gurney ME, Heinrich SP, Lee MR, Yin HS (1986). "Molecular cloning and expression of neuroleukin, a neurotrophic factor for spinal and sensory neurons". Science 234 (4776): 566–74. PMID 3764429. doi:10.1126/science.3764429.
- ↑ Gurney ME, Apatoff BR, Spear GT, Baumel MJ, Antel JP, Bania MB, Reder AT (1986). "Neuroleukin: a lymphokine product of lectin-stimulated T cells". Science 234 (4776): 574–81. PMID 3020690. doi:10.1126/science.3020690.
- ↑ Watanabe H, Takehana K, Date M, Shinozaki T, Raz A (1996). "Tumor cell autocrine motility factor is the neuroleukin/phosphohexose isomerase polypeptide". Cancer Res. 56 (13): 2960–3. PMID 8674049.
- ↑ Silletti S, Raz A (1993). "Autocrine motility factor is a growth factor". Biochem Biophys Res Commun. 194 (1): 454–5. PMID 8392842. doi:10.1006/bbrc.1993.1840.
- ↑ Liotta LA, Mandler R, Murano G, Katz DA, Gordon RK, Chiang PK, Schiffmann E (1986). "Tumor cell autocrine motility factor". Proc Natl Acad Sci U S A 83 (10): 3302–6. PMID 3085086.
- ↑ Swan MK, Hansen T, Schonheit P, Davies C (2004). "A novel phosphoglucose isomerase (PGI)/phosphomannose isomerase from the crenarchaeon Pyrobaculum aerophilum is a member of the PGI superfamily: structural evidence at 1.16-A resolution". J. Biol. Chem. 279 (38): 39838–45. PMID 15252053. doi:10.1074/jbc.M406855200.
- ↑ Walker JI, Layton DM, Bellingham AJ, Morgan MJ, Faik P (1993). "DNA sequence abnormalities in human glucose 6-phosphate isomerase deficiency". Hum. Mol. Genet. 2 (3): 327–9. PMID 8499925. doi:10.1093/hmg/2.3.327.
- ↑ Kanno H, Fujii H, Hirono A, Ishida Y, Ohga S, Fukumoto Y, Matsuzawa K, Ogawa S, Miwa S (1996). "Molecular analysis of glucose phosphate isomerase deficiency associated with hereditary hemolytic anemia". Blood 88 (6): 2321–5. PMID 8822954.
- ↑ Kugler W, Lakomek M (2000). "Glucose-6-phosphate isomerase deficiency". Baillieres Best Pract. Res. Clin. Haematol. 13 (1): 89–101. PMID 10916680.
- ↑ "GPI Deficiency". Arquivado dende o orixinal o 17 de maio de 2014. Consultado o 13 de decembro de 2013.
Véxase tamén
editarBibliografía
editar- Walker JI, Faik P, Morgan MJ (1990). "Characterization of the 5' end of the gene for human glucose phosphate isomerase (GPI).". Genomics 7 (4): 638–43. PMID 2387591. doi:10.1016/0888-7543(90)90212-D.
- Brownstein BH, Silverman GA, Little RD; et al. (1989). "Isolation of single-copy human genes from a library of yeast artificial chromosome clones.". Science 244 (4910): 1348–51. PMID 2544027. doi:10.1126/science.2544027.
- Mizrachi Y (1989). "Neurotrophic activity of monomeric glucophosphoisomerase was blocked by human immunodeficiency virus (HIV-1) and peptides from HIV-1 envelope glycoprotein.". J. Neurosci. Res. 23 (2): 217–24. PMID 2547084. doi:10.1002/jnr.490230212.
- Gurney ME, Apatoff BR, Spear GT; et al. (1986). "Neuroleukin: a lymphokine product of lectin-stimulated T cells.". Science 234 (4776): 574–81. PMID 3020690. doi:10.1126/science.3020690.
- Faik P, Walker JI, Redmill AA, Morgan MJ (1988). "Mouse glucose-6-phosphate isomerase and neuroleukin have identical 3' sequences.". Nature 332 (6163): 455–7. PMID 3352745. doi:10.1038/332455a0.
- Zanella A, Izzo C, Rebulla P; et al. (1981). "The first stable variant of erythrocyte glucose-phosphate isomerase associated with severe hemolytic anemia.". Am. J. Hematol. 9 (1): 1–11. PMID 7435496. doi:10.1002/ajh.2830090102.
- Faik P, Walker JI, Morgan MJ (1994). "Identification of a novel tandemly repeated sequence present in an intron of the glucose phosphate isomerase (GPI) gene in mouse and man.". Genomics 21 (1): 122–7. PMID 7545951. doi:10.1006/geno.1994.1233.
- Xu W, Beutler E (1995). "The characterization of gene mutations for human glucose phosphate isomerase deficiency associated with chronic hemolytic anemia.". J. Clin. Invest. 94 (6): 2326–9. PMC 330061. PMID 7989588. doi:10.1172/JCI117597.
- Xu W, Lee P, Beutler E (1996). "Human glucose phosphate isomerase: exon mapping and gene structure.". Genomics 29 (3): 732–9. PMID 8575767. doi:10.1006/geno.1995.9944.
- Baronciani L, Zanella A, Bianchi P; et al. (1996). "Study of the molecular defects in glucose phosphate isomerase-deficient patients affected by chronic hemolytic anemia.". Blood 88 (6): 2306–10. PMID 8822952.
- Beutler E, West C, Britton HA; et al. (1998). "Glucosephosphate isomerase (GPI) deficiency mutations associated with hereditary nonspherocytic hemolytic anemia (HNSHA).". Blood Cells Mol. Dis. 23 (3): 402–9. PMID 9446754. doi:10.1006/bcmd.1997.0157.
- Kanno H, Fujii H, Miwa S (1998). "Expression and enzymatic characterization of human glucose phosphate isomerase (GPI) variants accounting for GPI deficiency.". Blood Cells Mol. Dis. 24 (1): 54–61. PMID 9616041. doi:10.1006/bcmd.1998.0170.
- Kugler W, Breme K, Laspe P; et al. (1998). "Molecular basis of neurological dysfunction coupled with haemolytic anaemia in human glucose-6-phosphate isomerase (GPI) deficiency.". Hum. Genet. 103 (4): 450–4. PMID 9856489. doi:10.1007/s004390050849.
- Belyaeva OV, Balanovsky OP, Ashworth LK; et al. (1999). "Fine mapping of a polymorphic CA repeat marker on human chromosome 19 and its use in population studies.". Gene 230 (2): 259–66. PMID 10216265. doi:10.1016/S0378-1119(99)00056-6.
- Yakirevich E, Naot Y (2000). "Cloning of a glucose phosphate isomerase/neuroleukin-like sperm antigen involved in sperm agglutination.". Biol. Reprod. 62 (4): 1016–23. PMID 10727272. doi:10.1095/biolreprod62.4.1016.
- Haga A, Niinaka Y, Raz A (2000). "Phosphohexose isomerase/autocrine motility factor/neuroleukin/maturation factor is a multifunctional phosphoprotein.". Biochim. Biophys. Acta 1480 (1-2): 235–44. PMID 11004567.