Transferencia horizontal de xenes
A transferencia horizontal de xenes, tamén chamada transferencia lateral de xenes ou transferencia xenética horizontal (abreviada THX ou HGT polas súas siglas en inglés) é unha transferencia de xenes entre organismos dun modo distinto á reprodución tradicional, que pode darse entre individuos da mesma especie ou de especies distintas. O seu nome de transferencia horizontal ou lateral de xenes contraponse a transferencia vertical, que é a transmisión de xenes desde a xeración parental á descendencia por medio da reprodución sexual ou asexual. A transferencia horizontal de xenes foi un importante factor na evolución de moitos organismos, desde bacterias a eucariotas superiores.
A transferencia horizontal de xenes é a razón principal de que se produza a resistencia a antibióticos bacteriana,[1][2][3][4] e xoga un importante papel na activación de bacterias que poden degradar novos compostos como os pesticidas fabricados polo ser humano[5] e na evolución, mantemento e transmisión da virulencia nos microorganismos.[6] Esta transferencia horizontal de xenes con frecuencia implica a bacteriófagos temperados e plásmidos.[7] Os xenes que son responsables da resistencia a antibióticos nunha especie de bacterias poden transferirse a outras especies bacterianas por medio de varios mecanismos (por exemplo, por medio de pilus F), o que dotará de xenes de resistencia a antibióticos ao receptor, o cal é unha ameaza médica coa que hai que tratar. Esta é a principal razón pola que os antibióticos non deben ser consumidos e administrados aos pacientes sen unha axeitada prescrición por parte dun médico.[8]
A maioría dos estudos en xenética enfocáronse á transferencia vertical, pero hai unha consciencia crecente de que a transferencia horizontal de xenes é un fenómeno moi significativo e quizais é, entre os organismos unicelulares, a forma dominante de transferencia xenética.[9][10]
A transferencia horizontal de xenes artificial é un tipo de técnica en enxeñaría xenética.
Historia
editarA transferencia horizontal de xenes foi descrita por primeira vez en Seattle en 1951 nunha publicación que demostraba que a transferencia dun xene viral á bacteria Corynebacterium diphtheriae orixinaba unha cepa virulenta a partir dunha cepa que non o era,[11] o que tamén serviu para resolver o enigma da difteria (no que os pacientes podían infectarse coa bacteria pero non ter síntomas, pero despois ás veces esta transformábase de repente en virulenta),[12] e deu o primeiro exemplo da importancia dos ciclos lisoxénicos.[13] A transferencia de xenes foi descrita no Xapón en 1959 nunha publicación que demostraba a transferencia da resistencia a antibióticos entre diferentes especies de bacterias.[14][15] A metade da década de 1980, Syvanen[16] predixo que a transferencia lateral de xenes tivo unha grande importancia biolóxica, e estivo implicada en dar forma á historia evolutiva das especies desde o principio da aparición da vida sobre a Terra.
En palabras de Jain, Rivera e Lake (1999): "Cada vez máis, os estudos de xenes e xenomas indican que tivo lugar unha considerable transferencia horizontal de xenes entre os procariotas".[17] (ver tamén Lake e Rivera, 2007).[18] O fenómeno parece que foi moi significativo tamén entre os eucariotas unicelulares. Como sinaloron Bapteste et al. (2005), "evidencias adicionais suxiren que a transferencia de xenes podería tamén ser un importante mecanismo evolutivo na evolución dos protistas."[19]
Hai algunhas evidencias de que as plantas superiores e os animais tamén se viron afectadas por esta transferencia.[20] Richardson e Palmer (2007) afirmaron: "A transferencia horizontal de xenes (HGT) xogou un papel principal na evolución das bacterias e é moi común en certos eucariotas unicelulares. Porén, a prevalencia e importancia da HGT na evolución de eucariotas multicelulares permanece pouco clara."[21]
Debido á crecente cantidade de evidencias que suxiren a importancia deste fenómeno para a evolución (véxase máis abaixo) biólogos moleculares como Peter Gogarten consideraron a transferencia horizontal de xenes como "un novo paradigma para a bioloxía".[22]
O fenómeno pode ser un perigo agochado nas aplicacións da enxeñaría xenética, xa que podería permitir que ADN transxénico perigoso se espallase de especie a especie.[20]
Mecanismo
editarHai varios mecanismos para a transferencia horizontal de xenes:[23][24]
- A transformación xenética, é a alteración xenética dunha célula que resulta da introdución, captación e expresión de material xenético alleo (ADN ou ARN). Este proceso é relativamente común nas bacterias, pero menos nos eucariotas. A transformación utilízase a miúdo nos laboratorios para inserir novos xenes nunha bacteria para experimentación ou usos industriais ou aplicacións médicas.
- A transdución xenética é o proceso no cal o ADN é levado dunha bacteria a outra por un virus (un bacteriófago, ou fago).
- A conxugación bacteriana é o proceso no cal unha célula bacteriana transfire material xenético a outra célula por contacto célula con célula.
- Os axentes de transferencia de xenes, son elementos similares a virus codificados polo hóspede que se encontran nas alfaproteobacterias da orde Rhodobacterales.[25]
Virus
editarOs virus chamados mimivirus infectan amebas. Outros virus, chamados Sputnik (un virus satélite), tamén infectan amebas, pero non se poden reproducir a menos que un mimivirus infectase antes á mesma célula.[26] O coñecemento do xenoma de "Sputnik" serviu para unha mellor comprensión da súa bioloxía. Aínda que 13 dos seus xenes mostran poucas similitudes con calquera outro xene coñecido, tres deles están moi relacionados con xenes de mimivirus e mamavirus, e quizais foron canibalizados polos diminutos virus cando empaquetaban as súas partículas compoñentes nalgún momento da súa historia evolutiva. Isto suxire que o virus satélite podería realizar unha transferencia horizontal de xenes entre virus, en certo modo similar ao transporte de xenes feito por bacteriófagos entre as bacterias."[27]
Procariotas
editarA transferencia horizontal de xenes é común entre as bacterias, mesmo entre as que están moi pouco emparentadas. Este proceso crese que é unha causa significativa do incremento da resistencia aos fármacos[28] producida cando unha célula bacteriana adquiere resistencia e transfire rapidamente xenes de resistencia a moitas especies.[29][30] A transferencia horizontal de xenes tamén xoga un papel no espallamento de factores de virulencia, como exotoxinas e exoencimas, entre bacterias. Propuxéronse estratexias para combater certas infeccións bacterianas tomando como obxectivo factores de virulencia específicos e elementos xenéticos móbiles.[6]
Eucariotas
editar"As comparacións de secuencias suxiren a transferencia horizontal recente de moitos xenes entre diversas especies mesmo a través das fronteiras entre os "dominios" filoxenéticos. Deste xeito, a determinación da historia filoxenética dunha especie non pode facerse conclusivamente determinando as árbores evolutivas por medio de xenes únicos".[31]
- A análise de secuencias de ADN suxire que a transferencia horizontal de xenes ocorreu tamén entre os eucariotas desde as mitocondrias e cloroplastos ao xenoma nuclear. Como afirma a teoría endosimbiótica, os cloroplastos e mitocondrias probablemente se orixinaron como endosimbiontes bacterianos nun proxenitor das células eucariotas.[32]
- A transferencia horizontal de xenes desde as bacterias a certos fungos, especialmente ao lévedo Saccharomyces cerevisiae, está ben documentada.[33]
- Hai tamén evidencias de que a escaravello Callosobruchus chinensis adquiriu dalgún modo material xenético dos seus endosimbiontes bacterianos (non beneficiosos) Wolbachia.[34] Informouse recentemente de novos exemplos que demostran que Wolbachia representa unha importante fonte potencial de material xenético para os artrópodos e filarias (nematodos).[35]
- Hai tamén evidencias de transferencia horizontal de xenes mitocondriais a plantas parasitas da familia Rafflesiaceae procedentes dos seus hóspedes (outras plantas),[36][37] e desde os cloroplastos dunha planta aínda non identificada ás mitocondrias da faba Phaseolus,[38] e desde unha alga heteroconta ao seu predador, a lesma mariña Elysia chlorotica.[39]
- Striga hermonthica, unha eudicotiledónea, sufriu unha transferencia horizontal de xenes procedentes de Sorghum (Sorghum bicolor) ao seu xenoma nuclear.[40] Non se coñece a funcionalidade do xene.
- Investigadores da Universidade de Arizona atoparon que o xenoma do pulgón do chícharo (Acyrthosiphon pisum) contén moitos xenes que foron transferidos horizontalmente procedentes de fungos.[41][42] As plantas, fungos, e microorganismos poden sintetizar carotenoides, pero o toruleno producido polos áfidos do chícharo é o único carotenoide que se coñece que sexa sintetizado por un organismo do reino animal.[41]
- Suxeriuse recentemente que o patóxeno causante da malaria Plasmodium vivax adquiriu horizontalmente material xenético humano que podería facilitar a súa prolongada presenza no corpo.[43]
- Unha publicación de 2012 propuxo un novo mecanismo mediado por bacteriófagos de transferencia horizontal de xenes entre procariotas e eucariotas. Os autores sinalan a estendida presenza de sinais de localización nuclear nas proteínas terminais (TP) de bacteriófagos, que ceban a replicación do ADN e quedaron unidos covalentemente ao xenoma viral. Tendo en conta o papel coñecido de virus e bacteriófagos na transferencia horizontal de xenes en bacterias, os autores propoñen que os xenomas que conteñen TP poderían ser un vehículo para a transferencia de información xenética entre reinos no decurso da evolución.[44]
- O HhMAN1 é un xene do xenoma do escaravello Hypothenemus hampei que lembra a xenes bacterianos, e crese que foi transferido por unha bacteria do intestino do escaravello.[45][46]
Transferencia horizontal de xenes artificial
editarA enxeñaría xenética é esencialmente unha transferencia horizontal de xenes, aínda que con casetes de expresión sintéticos. O sistema transposón Bela dormente[47] (SB, Sleeping Beauty) foi desenvolvido como un axente de transferencia de xenes sintético que estaba baseado nas capacidades coñecidas dos transposóns Tc1/mariner de invadiren xenomas de especies extremadamente diversas.[48] O sistema SB utilizouse para introducir secuencias xenéticas nunha ampla variedade de xenomas animais.[49][50]
Importancia en evolución
editarA transferencia horizontal de xenes é un factor potrencial de confusión á hora de inferir árbores filoxenéticas baseadas na secuencia dun xene.[51] Por exemplo, se tomamos dúas bacterias pouco emparentadas que intercambiaran un xene, a árbore filoxenética que as inclúa mostrará que están moi emparentadas porque ese xene é o mesmo aínda que a maioría dos outros xenes sexan distintos. Por esta razón o ideal é a miúdo usar outra información para inferir unha filoxenia máis segura como a presenza ou ausencia de xenes ou, máis comunmente, incluír un rango de xenes o máis amplo posible para a análise filoxenética.
Por exemplo, o xene máis común usado para construír as relacións filoxenéticas entre procariotas é o xene do ARNr 16S, xa que as súas secuencias tenden a estar conservadas entre membros situados a distancias filoxenéticas curtas, pero é o suficientemente variable como para que se poidan medir as diferenzas. Porén, en anos recentes argumentouse que os xenes de ARNr 16S poden tamén transferirse horizontalmente. Aínda que isto pode ser infrecuente, fai que a validez das árbores filoxenéticas construídas a partir dos xenes de ARNr 16S deba ser reavaliada.[52]
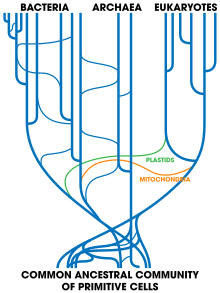
O biólogo Johann Peter Gogarten suxeriu que "a metáfora orixinal dunha árbore xa non cadra cos datos da recente investigación en xenomas" e, por tanto, "os biólogos deberían usar a metáfora dun mosaico para describir as diferentes historias combinadas en xenomas individuais e usar a metáfora dunha rede para visualizar o rico intercambio e efectos cooperativos da transferencia horizontal de xenes entre microbios."[22] Existen varios métodos para inferir esas redes filoxenéticas.
Usando marcadores filoxenéticos dun único xene, é difícil trazar a filoxenia dos organismos en presenza de transferencias horizontais de xenes. Combinar o modelo de coalescencia simple da cladoxénese cos eventos raros de transferencia horizontal de xenes suxire que non houbo un único antepasado común máis recente que contivese todos os xenes ancestrais que son compartidos entre os tres dominios da vida. Cada molécula contemporánea ten a súa propia historia e rastréase ata unha molécula indivudual cenancestral. Porén, estes devanceiros molecularess probablemente estaban presentes en diferentes organismos en tempos diferentes."[53]
Artigo en Scientific American (2000)
editarUprooting the Tree of Life de W. Ford Doolittle[54] é un artigo publicado en Scientific American en febreiro de 2000, que contén unha discusión sobre o último antepasado común universal e os problemas que xorden con ese concepto cando se considera a transferencia horizontal de xenes. O artigo cobre unha grande área, como a hipótese endosimbiótica para os eucariotas, o uso de pequenas subunidades de ARNr (SSU RNAr) como medida das distancias evolutivas (campo no que traballara Carl Woese cando formulou a primeira árbore da vida moderna no que se propuxo a existencia do dominio das Archaea) e outros tópicos relevantes. De feito, foi examinando ese novo terceiro dominio como se viu que a transferencia horizontal de xenes ía ser un asunto complicado. Por exemplo, Archaeoglobus fulgidus é citado no artigo como unha anomalía na súa árbore filoxenética baseada na codificación do encima HMGCoA redutase (o organismo en cuestión é unha arquea ben definida, con todos os lípidos celulares e maquinaria de transcrición xenética que se esperan nunha arquea, pero con xenes para a HMGCoA redutase que son de orixe bacteriana).[54]
O artigo continúa expoñendo que unha transferencia horizontal de xenes extensa implica que nunca houbo unha célula única que puidese denominarse o último antepasado común universal. Citan as palabras de Carl Woese, que dixo: "o antepasado non puido ser un organismo particular, unha soa liñaxe de organismos. Foi un conglomerado de células primitivas comunal, sen gran cohesión e diverso que evolucionou como unha unidade, e que finalmente se desenvolveu ata un estadio no que se fragmentou en varias comunidades distintas, que á súa vez se converteron nas tres liñas primarias de descendencia (bacteria, arquea e eucariotas)"[54]
Woese afirmou tamén: "En condicións de extrema transferencia horizontal de xenes, non hai unha "árbore" (de organismos). A evolución é basicamente reticulada."[55]
Artigo en Nature (2010)
editarAs formulacións anteriores foron despois contraditas por traballos posteriores. Por exemplo, no artigo A formal test of the theory of universal common ancestry publicado en Nature en maio de 2010, Douglas Theobald[56] argumenta que si houbo un último antepasado común universal a todas as formas de vida hoxe existentes e que a transferencia horizontal de xenes non nos impide inferir isto. En palabras de Theobald: "Entre un amplo rango de modelos biolóxicos que implican a ascendencia independente dos principais grupos taxonómicos, resultou que as probas de selección modelo apoian abrumadoramente ao antepasado común universal independentemente da presenza de transferencias horizontais de xenes e de eventos simbióticos de fusión. Estes resultados proporcionan unha poderosa evidencia estatística corroborando a monofilia de todas as formas de vida."[56]
Outros autores opinaron que o test de Theobald "non é suficiente para rexeitar a hipótese alternativa das orixes separadas da vida"[57] Despois Theobald insistiu en que os seus modelos estatísticos son os máis axeitados para distinguir entre esas hipóteses e que apoian a idea dun antepasado común universal.[58]
Xenes
editarExemplos de transferencias horizontais de xenes históricas das que hai evidencia son as dos seguintes xenes:
- Xene da licopeno ciclase, encima para a biosíntese de carotenoides, transferencia que ocorreu entre Chlorobi e Cyanobacteria.[59]
- Xene TetO que confire resistencia á tetraciclina, entre cepas de Campylobacter jejuni.[60]
Notas
editar- ↑ OECD, Safety Assessment of Transgenic Organisms, Volume 4: OECD Consensus Documents, 2010, pp.171-174
- ↑ Kay E, Vogel TM, Bertolla F, Nalin R, Simonet P (2002). "In situ transfer of antibiotic resistance genes from transgenic (transplastomic) tobacco plants to bacteria". Appl. Environ. Microbiol. 68 (7): 3345–51. PMC 126776. PMID 12089013. Arquivado dende o orixinal o 05 de xuño de 2020. Consultado o 10 de marzo de 2013.
- ↑ Koonin EV, Makarova KS, Aravind L (2001). "Horizontal gene transfer in prokaryotes: quantification and classification". Annu. Rev. Microbiol. 55: 709–42. PMID 11544372. doi:10.1146/annurev.micro.55.1.709. Arquivado dende o orixinal o 19 de setembro de 2019. Consultado o 10 de marzo de 2013.
- ↑ Nielsen KM (1998). "Barriers to horizontal gene transfer by natural transformation in soil bacteria". APMIS Suppl. 84: 77–84. PMID 9850687.
- ↑ McGowan C, Fulthorpe R, Wright A, Tiedje JM (1998). "Evidence for interspecies gene transfer in the evolution of 2,4-dichlorophenoxyacetic acid degraders". Appl. Environ. Microbiol. 64 (10): 4089–92. PMC 106609. PMID 9758850. Arquivado dende o orixinal o 19 de setembro de 2019. Consultado o 10 de marzo de 2013.
- ↑ 6,0 6,1 Keen, E. C. (2012). "Paradigms of pathogenesis: Targeting the mobile genetic elements of disease". Frontiers in Cellular and Infection Microbiology 2. doi:10.3389/fcimb.2012.00161 [1].
- ↑ Naik GA, Bhat LN, Chpoade BA, Lynch JM (1994). "Transfer of broad-host-range antibiotic resistance plasmids in soil microcosms". Curr. Microbiol. 28 (4): 209–215. doi:10.1007/BF01575963.
- ↑ Russell, Peter J. (2009). Biology : exploring the diversity of life (1st Canadian ed.). Toronto: Nelson Education. ISBN 0-17-644094-1.
- ↑ Lin Edwards (October 4, 2010). "Horizontal gene transfer in microbes much more frequent than previously thought". PhysOrg.com. Consultado o 2012-01-06.
- ↑ Carrie Arnold (April 18, 2011). "To Share and Share Alike: Bacteria swap genes with their neighbors more frequently than researchers have realized". Scientific American. Consultado o 2012-01-06.
- ↑ Victor J Freeman (1951). "Studies on the virulence of bacteriophage-infected strains of Corynebacterium Diphtheriae". Journal of Bacteriology 61 (6): 675–688. PMC 386063. PMID 14850426.
- ↑ Phillip Marguilies "Epidemics: Deadly diseases throughout history". Rosen, New York. 2005.
- ↑ André Lwoff (1965). "Interaction among Virus, Cell, and Organism". Nobel Lecture for the Nobel Prize in Physiology or Medicine.
- ↑ Ochiai K, Yamanaka T, Kimura K, Sawada, O (1959). "Inheritance of drug resistance (and its transfer) between Shigella strains and Between Shigella and E. coli strains". Hihon Iji Shimpor (en Japanese) 1861: 34.
- ↑ Akiba T, Koyama K, Ishiki Y, Kimura S, Fukushima T (1960). "On the mechanism of the development of multiple-drug-resistant clones of Shigella". Jpn. J. Microbiol. 4: 219–27. PMID 13681921.
- ↑ Syvanen M (1985). "Cross-species gene transfer; implications for a new theory of evolution" (PDF). J. Theor. Biol. 112 (2): 333–43. PMID 2984477. doi:10.1016/S0022-5193(85)80291-5.
- ↑ Jain R, Rivera MC, Lake JA (1999). "Horizontal gene transfer among genomes: The complexity hypothesis". Proc. Natl. Acad. Sci. U.S.A. 96 (7): 3801–6. Bibcode:1999PNAS...96.3801J. PMC 22375. PMID 10097118. doi:10.1073/pnas.96.7.3801.
- ↑ Rivera MC, Lake JA (2004). "The ring of life provides evidence for a genome fusion origin of eukaryotes" (PDF). Nature 431 (7005): 152–5. Bibcode:2004Natur.431..152R. PMID 15356622. doi:10.1038/nature02848. Arquivado dende o orixinal (PDF) o 27 de setembro de 2007. Consultado o 10 de marzo de 2013.
- ↑ Bapteste E, Susko E, Leigh J, MacLeod D, Charlebois RL, Doolittle WF (2005). "Do orthologous gene phylogenies really support tree-thinking?". BMC Evol. Biol. 5: 33. PMC 1156881. PMID 15913459. doi:10.1186/1471-2148-5-33.
- ↑ 20,0 20,1 Mae-Wan Ho (1999). "Cauliflower Mosaic Viral Promoter – A Recipe for Disaster?" (PDF). Microbial Ecology in Health and Disease 11: 194–7. Arquivado dende o orixinal (PDF) o 11 de setembro de 2008. Consultado o 2008-06-09.
- ↑ Richardson, Aaron O.; Palmer, Jeffrey D. (2007). "Horizontal Gene Transfer in Plants" (PDF). Journal of Experimental Botany 58 (1): 1–9. PMID 17030541. doi:10.1093/jxb/erl148. Arquivado dende o orixinal (PDF) o 27 de setembro de 2007. Consultado o 10 de marzo de 2013.
- ↑ 22,0 22,1 Gogarten, Peter (2000). "Horizontal Gene Transfer: A New Paradigm for Biology". Esalen Center for Theory and Research Conference. Arquivado dende o orixinal o 21 de xullo de 2012. Consultado o 2007-03-18.
- ↑ Kenneth Todar. "Bacterial Resistance to Antibiotics". The Microbial World: Lectures in Microbiology, Department of Bacteriology, University of Wisconsin-Madison. Arquivado dende o orixinal o 15 de xaneiro de 2012. Consultado o January 6, 2012.
- ↑ Stanley Maloy (July 15, 2002). "Horizontal Gene Transfer". San Diego State University. Consultado o January 6, 2012.
- ↑ Maxmen, A. (2010). "Virus-like particles speed bacterial evolution". Nature. doi:10.1038/news.2010.507. [2]
- ↑ La Scola B, Desnues C, Pagnier I, Robert C, Barrassi L, Fournous G, Merchat M, Suzan-Monti M, Forterre P, Koonin E, Raoult D (2008). "The virophage as a unique parasite of the giant mimivirus". Nature 455 (7209): 100–4. Bibcode:2008Natur.455..100L. PMID 18690211. doi:10.1038/nature07218.
- ↑ Pearson H (2008). "'Virophage' suggests viruses are alive". Nature 454 (7205): 677. Bibcode:2008Natur.454..677P. PMID 18685665. doi:10.1038/454677a.
- ↑ Barlow M (2009). "What antimicrobial resistance has taught us about horizontal gene transfer". Methods in Molecular Biology (Clifton, N.J.). Methods in Molecular Biology 532: 397–411. ISBN 978-1-60327-852-2. PMID 19271198. doi:10.1007/978-1-60327-853-9_23.
- ↑ Hawkey PM, Jones AM (2009). "The changing epidemiology of resistance". Journal of Antimicrobial Chemotherapy 64 (Suppl 1): i3–10. PMID 19675017. doi:10.1093/jac/dkp256.
- ↑ Francino, MP (editor) (2012). Horizontal Gene Transfer in Microorganisms. Caister Academic Press. ISBN 978-1-908230-10-2.
- ↑ "okstate.edu". Arquivado dende o orixinal o 27 de decembro de 2007. Consultado o 10 de marzo de 2013.
- ↑ Blanchard JL, Lynch M (2000). "Organellar genes: why do they end up in the nucleus?". Trends Genet. 16 (7): 315–20. PMID 10858662. doi:10.1016/S0168-9525(00)02053-9.
- ↑ Hall C, Brachat S, Dietrich FS (2005). "Contribution of Horizontal Gene Transfer to the Evolution of Saccharomyces cerevisiae". Eukaryotic Cell 4 (6): 1102–15. PMC 1151995. PMID 15947202. doi:10.1128/EC.4.6.1102-1115.2005. Arquivado dende o orixinal o 06/10/2008. Consultado o 10/03/2013. O artigo argumenta que ocorreu unha transferencia de ADN bacteriano a Saccharomyces cerevisiae.
- ↑ Kondo N, Nikoh N, Ijichi N, Shimada M, Fukatsu T (2002). "Genome fragment of Wolbachia endosymbiont transferred to X chromosome of host insect". Proc. Natl. Acad. Sci. U.S.A. 99 (22): 14280–5. Bibcode:2002PNAS...9914280K. PMC 137875. PMID 12386340. doi:10.1073/pnas.222228199. O artigo sostén que ADN de Wolbachia está no xenoma do insecto.
- ↑ Dunning Hotopp JC; Clark ME; Oliveira DC; et al. (2007). "Widespread lateral gene transfer from intracellular bacteria to multicellular eukaryotes". Science 317 (5845): 1753–6. Bibcode:2007Sci...317.1753H. PMID 17761848. doi:10.1126/science.1142490.
- ↑ Davis CC, Wurdack KJ (30 July 2004). "Host-to-parasite gene transfer in flowering plants: phylogenetic evidence from Malpighiales". Science 305 (5684): 676–8. Bibcode:2004Sci...305..676D. PMID 15256617. doi:10.1126/science.1100671.
- ↑ Daniel L Nickrent, Albert Blarer, Yin-Long Qiu, Romina Vidal-Russell and Frank E Anderson (2004). "Phylogenetic inference in Rafflesiales: the influence of rate heterogeneity and horizontal gene transfer". BMC Evolutionary Biology 4: 40. PMC 528834. PMID 15496229. doi:10.1186/1471-2148-4-40.
- ↑ Magdalena Woloszynska, Tomasz Bocer, Pawel Mackiewicz and Hanna Janska (2004). "A fragment of chloroplast DNA was transferred horizontally, probably from non-eudicots, to mitochondrial genome of Phaseolus". Plant Molecular Biology 56 (5): 811–20. PMID 15803417. doi:10.1007/s11103-004-5183-y.
- ↑ Rumpho ME; Worful JM; Lee J; et al. (2008). "Horizontal gene transfer of the algal nuclear gene psbO to the photosynthetic sea slug Elysia chlorotica". Proc. Natl. Acad. Sci. U.S.A. 105 (46): 17867–71. Bibcode:2008PNAS..10517867R. PMC 2584685. PMID 19004808. doi:10.1073/pnas.0804968105.
- ↑ Yoshida, Satoko; Maruyama, Shinichiro; Nozaki, Hisayoshi; Shirasu, Ken (28 May 2010). "Horizontal gene transfer by the parasitic plant Striga hermonthica". Science 328 (5982): 1128. Bibcode:2010Sci...328.1128Y. PMID 20508124. doi:10.1126/science.1187145.
- ↑ 41,0 41,1 Nancy A. Moran; Tyler Jarvik (2010). "Lateral Transfer of Genes from Fungi Underlies Carotenoid Production in Aphids". Science 328 (5978): 624–627. Bibcode 2010Sci...328..624M. doi:10.1126/science.1187113. PMID 20431015.
- ↑ Fukatsu T (2010). "Evolution. A fungal past to insect color". Science 328 (5978): 574–5. PMID 20431000. doi:10.1126/science.1190417.
- ↑ Bar D (16 February 2011). "Evidence of Massive Horizontal Gene Transfer Between Humans and Plasmodium vivax". Nature Precedings. doi:10.1038/npre.2011.5690.1.
- ↑ Redrejo-Rodríguez, M, Muñoz-Espín, D, Holguera, I, Mencía, M, Salas, M, (2012). "Functional eukaryotic nuclear localization signals are widespread in terminal proteins of bacteriophages". Proc. Natl. Acad. Sci. U.S.A. PMID 23091024.
- ↑ Lee Phillips, Melissa (2012). "Bacterial gene helps coffee beetle get its fix". Nature. doi:10.1038/nature.2012.10116.
- ↑ "Adaptive horizontal transfer of a bacterial gene to an invasive insect pest of coffee". PNAS. 2012. doi:10.1073/pnas.1121190109.
- ↑ Ivics Z., Hackett P.B., Plasterk R.H., Izsvak Z. (1997). "Molecular reconstruction of Sleeping Beauty, a Tc1-like transposon from fish, and its transposition in human cells". Cell 91 (4): 501–510. PMID 9390559. doi:10.1016/S0092-8674(00)80436-5.
- ↑ Plasterk RH (1996). "The Tc1/mariner transposon family". Curr. Top. Microbiol. Immunol. 204: 125–43. PMID 8556864.
- ↑ Izsvak Z., Ivics Z., Plasterk R.H. (2000). "Sleeping Beauty, a wide host-range transposon vector for genetic transformation in vertebrates". J. Mol. Biol. 302 (1): 93–102. PMID 10964563. doi:10.1006/jmbi.2000.4047.
- ↑ Kurtti TJ, Mattila JT, Herron MJ; et al. (2008). "Transgene expression and silencing in a tick cell line: A model system for functional tick genomics". Insect Biochem. Mol. Biol. 38 (10): 963–8. PMC 2581827. PMID 18722527. doi:10.1016/j.ibmb.2008.07.008.
- ↑ Graham Lawton Why Darwin was wrong about the tree of life New Scientist Magazine issue 2692 21 January 2009 Accessed February 2009
- ↑ "Copia arquivada". Arquivado dende o orixinal o 16 de abril de 2013. Consultado o 10 de marzo de 2013.
- ↑ "Cladogenesis Paper". Arquivado dende o orixinal (PDF) o 21 de xullo de 2012. Consultado o 10 de marzo de 2013.
- ↑ 54,0 54,1 54,2 Doolittle, Ford W. (2000). "Uprooting the Tree of Life". Scientific American 282 (2): 72–7. PMID 10710791. doi:10.1038/scientificamerican0200-90.
- ↑ Woese CR (2004). "A New Biology for a New Century". Microbiol. Mol. Biol. Rev. 68 (2): 173–86. PMC 419918. PMID 15187180. doi:10.1128/MMBR.68.2.173-186.2004.
- ↑ 56,0 56,1 Theobald, Douglas L. (13 May 2010). "A formal test of the theory of universal common ancestry". Nature 465 (7295): 219–222. Bibcode:2010Natur.465..219T. PMID 20463738. doi:10.1038/nature09014.
- ↑ Yonezawa T, Hasegawa M. Was the universal common ancestry proved? Nature. 2010 Dec 16;468(7326):E9; discussion E10. doi: 10.1038/nature09482. PMID 21164432. [3]
- ↑ Theobald DL. On universal common ancestry, sequence similarity, and phylogenetic structure: the sins of P-values and the virtues of Bayesian evidence. Biol Direct. 2011 Nov 24;6(1):60. doi: 10.1186/1745-6150-6-60. PMID 22114984. [4]
- ↑ D.A. Bryant & N.-U. Frigaard (2006). "Prokaryotic photosynthesis and phototrophy illuminated". Trends Microbiol. 14 (11): 488–96. PMID 16997562. doi:10.1016/j.tim.2006.09.001.
- ↑ Avrain L, Vernozy-Rozand C, Kempf I (2004). "Evidence for natural horizontal transfer of tetO gene between Campylobacter jejuni strains in chickens". J. Appl. Microbiol. 97 (1): 134–40. PMID 15186450. doi:10.1111/j.1365-2672.2004.02306.x.
Véxase tamén
editarOutros artigos
editar- Agrobacterium, bacteria que transfire xenes a plantas.
- Retrovirus endóxenos
- Integrón
- Provirus
- Retrotransposón
- Organismo modificado xeneticamente
- Elementos xenéticos móbiles
- Árbore da vida (ciencia)
- Árbore filoxenética
- Rede filoxenética
Bibliografía
editar- Salzberg SL, White O, Peterson J, Eisen JA (2001). "Microbial genes in the human genome: lateral transfer or gene loss?" (PDF). Science 292 (5523): 1903–6. Bibcode:2001Sci...292.1903S. PMID 11358996. doi:10.1126/science.1061036. Arquivado dende o orixinal (PDF) o 01 de setembro de 2006. Consultado o 10 de marzo de 2013.
- Woese CR (2002). "On the evolution of cells". Proc. Natl. Acad. Sci. U.S.A. 99 (13): 8742–7. Bibcode:2002PNAS...99.8742W. PMC 124369. PMID 12077305. doi:10.1073/pnas.132266999.
- Snel B, Bork P, Huynen MA (1999). "Genome phylogeny based on gene content". Nat. Genet. 21 (1): 108–10. PMID 9916801. doi:10.1038/5052.
- Patil PB, Sonti RV (2004). "Variation suggestive of horizontal gene transfer at a lipopolysaccharide (lps) biosynthetic locus in Xanthomonas oryzae pv. oryzae, the bacterial leaf blight pathogen of rice". BMC Microbiol. 4: 40. PMC 524487. PMID 15473911. doi:10.1186/1471-2180-4-40.
- Jin G, Nakhleh L, Snir S, Tuller T (2006). "Maximum likelihood of phylogenetic networks". Bioinformatics 22 (21): 2604–11. PMID 16928736. doi:10.1093/bioinformatics/btl452.
- Jain R, Rivera MC, Lake JA (1999). "Horizontal gene transfer among genomes: The complexity hypothesis". Proc. Natl. Acad. Sci. U.S.A. 96 (7): 3801–6. Bibcode:1999PNAS...96.3801J. PMC 22375. PMID 10097118. doi:10.1073/pnas.96.7.3801.
- Szpirer C, Top E, Couturier M, Mergeay M (1 December 1999). "Retrotransfer or gene capture: a feature of conjugative plasmids, with ecological and evolutionary significance". Microbiology (Reading, Engl.) 145 (Pt 12): 3321–9. PMID 10627031.
- Whitaker JW, McConkey GA, Westhead DR (2009). "The transferome of metabolic genes explored: analysis of the horizontal transfer of enzyme encoding genes in unicellular eukaryotes". Genome Biol. 10 (4): R36. PMC 2688927. PMID 19368726. doi:10.1186/gb-2009-10-4-r36. Arquivado dende o orixinal o 17 de xuño de 2013. Consultado o 10 de marzo de 2013.
Ligazóns externas
editar- Citizendium:Horizontal gene transfer
- Citizendium:Horizontal gene transfer in prokaryotes
- Citizendium:Horizontal gene transfer in plants
- Citizendium:Horizontal gene transfer (History)
- – Papers by Dr Michael Syvanen on Horizontal Gene Transfer
- Webfocus in Nature with free review articles
- Horizontal Gene Transfer – A New Paradigm for Biology Arquivado 21 de xullo de 2012 en Wayback Machine.
- Horizontal Gene Transfer (page 334 of Molecular Genetics by Ulrich Melcher)
- Report on horizontal gene transfer by Mae-Wan Ho, 22 de marzo de 1999.
- Recent Evidence Confirms Risks of Horizontal Gene Transfer
- Horizontal Gene Transfer at sciences.sdsu.edu
- PDF article on Horizontal Gene Transfer
- The New Yorker, 12 de xullo de 1999, pp. 44–61
- GMO Safety: Results of research into horizontal gene transfer