Piridina
| Piridina | |
|---|---|
| |
| Nome IUPAC | Piridina |
| Outros nomes | Azabenceno, Azina, py |
| Fórmula empírica | C5H5N |
| Masa molecular | 79,10 g/mol |
| Estado físico/Cor | Líquido/Incoloro |
| Número CAS | 110-86-1 |
| Propiedades | |
| Densidade | 0,9819 g/cm³ a 20 °C |
| Punto de fusión | –41,16 °C (232,0º K) |
| Punto de ebulición | 115,2 °C (388º K) |
| Solubilidade en auga | Miscíbel en auga |
| Información de seguridade | |
 
| |
| Frases R: R11-20, R21, R22
Frases S: S26-28 | |
| Exenciónes e Referencias[1][2][3] | |
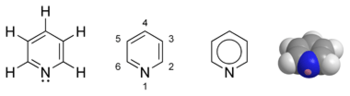
A piridina (fórmula molecular C5H5N, masa molecular: 79,10) é un líquido incoloro de olor desagradábel, similar ao do peixe en mal estado. Pertence á familia dos compostos heterocíclicos aromáticos, e está estruturalmente relacionada co benceno, sendo a única diferenza entre eles a substitución dun grupo CH do anel bencénico por un átomo de nitróxeno.
O olor pode chegar a ser nauseabundo e provocar esbirros.
Historia
editarA piridina impura foi sen dúbida preparada polos primeiros alquimistas ao quentaren ósos de animais e outras materias orgánicas,[4] pero a referencia documentada máis temperá adxudícaselle ao científico escocés Thomas Anderson.[5][6]
En 1849, Anderson examinou o contido do aceite obtido a través do qucemanto a altas temperaturas de ósos animais.[6] Entre outras substancias, separou do aceite un líquido incoloro de olor desagradábel, a partir do cal illou piridina pura dous anos despois. Describiuna como altamente solúbel en auga, facilmente solúbel en ácidos concentrados e en sales despois de quentala, e levemente solúbel en aceites. Debido á súa inflamabilidade, Anderson chamou á nova substancia piridina, do grego antigo πῦρ (pyr) que significa fogo. O sufixo -idina se engade de acordo coa nomenclatura química, como en toluidina, para indicar que un carbono do ciclo contén un átomo de nitróxeno.[7]
A estrutura química da piridina foi determinada décadas despois do seu descubrimento. Wilhelm Körner (1869)[8] e James Dewar (1871)[9] suxeriron independentemente que, analogamente á quinoleína e ao naftaleno, a estrutura da piridina derivaba do benceno mediante a substitución dn C-H por un átomo de nitróxeno.[10][11] A suxestión de Körner e Dewar foi despis confirmada experimentalmente cando a piridina foi reducida a piperidina con alcohol de sodio.
En 1876, William Ramsay combinou acetileno con cianuro de hidróxeno foemando piridina nun forno de aceiro ao vermello. Esta foi a primeira síntese dun composto heteroaromático.[12][13]
Os métodos contemporáneos de produción de piridina teñen un baixo rendemento e unha demanda crecente para o composto require da busca de novas rutas para sintetizala. Un punto de inflexión ocorreu en 1924 cando o químico ruso Alekséi Chichibabin desenvolveu a síntese de piridina de Chichibabin, a cal utiliza reactivos relativamente baratos.[14] Este método aínda se usa hoxe en día na produción industrial da piridina.[15]
Nomenclatura
editarO nome sistemático da piridina, dentro da nomenclatura de Hantzsch-Widman recomendada pola IUPAC, é azina. Porén, os nomes sistemáticos para compostos simples son raramente utilizados, polo que a nomenclatura dos heterociclos segue aos nomes comúns. A IUPAC non recomenda o uso de azina en vez de piridina.[16] A numeración dos átomos do anel da piridina comeza no nitróxeno. Tamén se utiliza a distribución das posicións dos carbonos segundo o alfabeto grego (α-γ) e cando se fala dos padróns de substitución en hidrocarburos aromáticos utilízase (orto, meta e para). Aquí α (orto), β (meta) e γ (para) refíerense ás posiciónes 2, 3 e 4 do anel, respectivamente. O nome sistemático dos derivados de piridina é piridinil, onde a posición do substituinte é precedida por un número. Poréno neste caso tamén a IUPAC non aconsella o uso, optando polo nome común piridil en vez do sistemático.[17] O derivado catiónico formado pola adición de un electrófilo ao nitróxeno chámase piridinio.
-
4-bromo
piridina -
2,2′-bipiridina
-
Ácido piridina-2,6-dicarboxílico (Ácido dipicolínico)
-
Catión piridinio
Existencia na natureza
editarA piridina encóntrase e numerosos compostos relacionados coa vida (pero non na súa forma pura), entre eles o NAD, a nicotina, a vitamina B3 ou niacina e a vitamina B6 ou piridoxina. Os derivados saturados da piridina, tales como a piperidina e as piperideínas, tamén se encontran presentes en compostos tales como a coniína, a manoxirimicina, a peletierina, a mimosina, a anabasina e a anaferina. Algunhas piridinas relacionadas co ácido nicotínico son os alcaloides da palma Areca catechu (arecolina, guvacina), a ricinina das sementes do rícino, a hermidina de Mercurialis annua, e a trigonelina da Trigonella foenum-graecum. Varias plantas da familia das celastráceas producen ésteres do ácido evonínico (ácido nicotínico enlazado cunha molécula de ácido 2-metilbutírico) e sesquiterpenos tipo agarofurano. Exemplos destes alcaloides son a maitolina, maitina, acantotamina, evonina, neoevonina, euonimina, as hipocratinas e as emarxinatinas. As betalaínas e as betaninas tamén conteñen aneis de piridina.
Porén, a piridina pura non está moi estendida na natureza. É unha substancia nociva se se inhala, inxire ou se se absorbe pola pel. Reduce a fertilidade masculina e feminina e está considerada como un carcinóxeno. Os síntomas de exposición máis comúns son: dor de cabeza, tose, dificultade respiratoria, larinxite, náuseas e vómitos.
Na natureza, na súa forma máis prexudicial, encóntrase nas follas e nasa raíces da beladona (Atropa belladonna),[18] e no malvarisco (Althaea officinalis).[19] Pero como quedou dito, os derivados da piridina encóntranse en certas biomoléculas como os nucleótidos de piridina e en alcaloides. Na vida diaria encóntranse trazas de piridina como compoñentes volátiles de compostos orgánicos que se xeran nos procesos de torrado e enlatado, como é o caso do polo frito,[20] sukiyaki,[21] bacon frito,[22] no queixo Beaufort,[23] o aroma do café,[24] o té negro[25] e o mel de xirasol.[26] O fume do tabaco,[27][28] e o da marihuana,[13] conteñen piridina.
Notas
editar- ↑ "Fichas internacionales de seguridad química (FISQ)". Arquivado dende o orixinal o 18 de decembro de 2008. Consultado o 14 de marzo de 2011.
- ↑ Fichas de datos de seguridade (FDS).
- ↑ Hazardous Substances Data Bank (HSDB)
- ↑ A. Weissberger (Ed.), A. Klingberg (ed.), R. A. Barnes, F. Brody, P. R. Ruby: Pyridine and its Derivatives, Volume 1, 1960. New York: Interscience Pub.
- ↑ Anderson, T. (1849): Transactions of Royal Society of Edinburg, 16: 123.
- ↑ 6,0 6,1 Von Anderson, Th. (1849). "Producte der trocknen Destillation thierischer Materien". Annalen der Chemie und Pharmacie 70: 32. doi:10.1002/jlac.18490700105.
- ↑ Anderson, Th. (1851). "Ueber die Producte der trocknen Destillation thierischer Materien". Annalen der Chemie und Pharmacie 80: 44. doi:10.1002/jlac.18510800104.
- ↑ Körner, W. (1869): Giorn. academ. Palermo, vol. 5.
- ↑ Dewar, J. (1871): Chem. News, 23: 38.
- ↑ Albert Ladenburg & Leonard Dobbin (2015): Lectures on the history of the development of chemistry since the time of Lavoisier. Newark, New Jersey: Palala Press. ISBN 978-1-3473-0859-2, pp. 283–287.
- ↑ Raj K. Bansal (2010): Heterocyclic Chemistry. 5th edition. New Delhi, India: New Age International Pvt. Ltd. ISBN 978-8-1224-3143-8, p. 216.
- ↑ "A. Henninger, aus Paris. 12. April 1877". Berichte der deutschen chemischen Gesellschaft 10: 727. 1877. doi:10.1002/cber.187701001202.
- ↑ 13,0 13,1 Pyridine, IARC Monogrpahs Vol. 77. Washington D.C.: OSHA 1985.
- ↑ Tscihtschibabin, A. E. (1924). "Über Kondensation der Aldehyde mit Ammoniak zu Pyridinebasen". Journal für praktische Chemie 107: 122. doi:10.1002/prac.19241070110.
- ↑ S. Shimizu, N. Watanabe, T. Kataoka, T. Shoji, N. Abe, S. Morishita & H. Ichimura "Pyridine and Pyridine Derivatives" en Ullmann's Encyclopedia of Industrial Chemistry, 2005, Wiley-VCH, Weinheim. doi 10.1002/14356007.a22_399
- ↑ Powell, W. H. (1983). "Revision of the extended Hantzsch-Widman system of nomenclature for hetero mono-cycles" (PDF). Pure and Applied Chemistry 55: 409–416. doi:10.1351/pac198855020409.
- ↑ D. Hellwinkel: Die systematische Nomenklatur der Organischen Chemie, 4th ed., p. 45, Belin: Springer, Berlin. ISBN 3-5406-3221-2.
- ↑ G. A. Burdock, ed. (1995): Fenaroli's Handbook of Flavor Ingredients, Vol. II, 3rd Edition. Boca Raton, Florida: CRC Press. ISBN 0-8493-2710-5.
- ↑ A. Täufel, W. Ternes, L. Tunger & M. Zobel (2005): Lebensmittel-Lexikon, 4th ed., p. 450, Behr. ISBN 3-8994-7165-2.
- ↑ Tang, Jian; Jin, Qi Zhang; Shen, Guo Hui; Ho, Chi Tang; Chang, Stephen S. (1983). "Isolation and identification of volatile compounds from fried chicken". Journal of Agricultural and Food Chemistry 31: 1287.
- ↑ Shibamoto, Takayuki; Kamiya, Yoko; Mihara, Satoru (1981). "Isolation and identification of volatile compounds in cooked meat: sukiyaki". Journal of Agricultural and Food Chemistry 29: 57.
- ↑ Ho, Chi Tang; Lee, Ken N.; Jin, Qi Zhang (1983). "Isolation and identification of volatile flavor compounds in fried bacon". Journal of Agricultural and Food Chemistry 31: 336.
- ↑ Dumont, Jean Pierre; Adda, Jacques (1978). "Occurrence of sesquiterpene in mountain cheese volatiles". Journal of Agricultural and Food Chemistry 26: 364.
- ↑ Aeschbacher, H. U.; Wolleb, U.; Löliger, J.; Spadone, J. C.; Liardon, R. (1989). "Contribution of coffee aroma constituents to the mutagenicity of coffee". Food and Chemical Toxicology 27 (4): 227–32.
- ↑ Vitzthum, Otto G.; Werkhoff, Peter; Hubert, Peter (1975). "New volatile constituents of black tea flavored". Journal of Agricultural and Food Chemistry 23: 999.
- ↑ A. Täufel, W. Ternes, L. Tunger & M. Zobel (2005): Lebensmittel-Lexikon, 4th ed., p. 226, Behr. ISBN 3-8994-7165-2.
- ↑ Curvall, Margareta; Enzell, Curt R.; Pettersson, Bertil (1984). "An evaluation of the utility of four in vitro short term tests for predicting the cytotoxicity of individual compounds derived from tobacco smoke". Cell Biology and Toxicology 1 (1): 173.
- ↑ Schmeltz, Irwin; Hoffmann, Dietrich (1977). "Nitrogen-containing compounds in tobacco and tobacco smoke". Chemical Reviews 77: 295.