Peróxido de hidróxeno
O peróxido de hidróxeno que, en solución acuosa, é coñecido comercialmente como auga osixenada, é un líquido claro de fórmula química H2O2. É un pouco máis viscoso que a auga, ten propiedades oxidantes fortes, é incoloro á temperatura ambiente e ten un característico sabor amargo. Ten propiedades oxidantes fortes, polo que é un axente branqueador moi poderoso. Emprégase como desinfectante, oxidante e como propelente en foguetes[3].
| Peróxido de hidróxeno | |
|---|---|
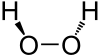
|

|
peróxido de hidróxeno | |
Outros nomes Dioxidano | |
| Identificadores | |
| Número CAS | 7722-84-1 |
| PubChem | 784 |
| ChemSpider | 763 |
| UNII | BBX060AN9V |
| Número CE | 231-765-0 |
| Número UN | 2015 (>60% soln.) 2014 (20–60% soln.) 2984 (8–20% soln.) |
| KEGG | D00008 |
| ChEBI | CHEBI:16240 |
| ChEMBL | CHEMBL71595 |
| Ligando IUPHAR | 2448 |
| Número RTECS | MX0900000 (>90% soln.) MX0887000 (>30% soln.) |
| Imaxes 3D Jmol | Image 1 |
| |
| |
| Propiedades | |
| Fórmula molecular | H2O2 |
| Masa molecular | 34,0147 g/mol |
| Aspecto | Cor azul moi clara; incoloro en solución |
| Densidade | 1,11 g/cm3 (20 °C, 30% (w/w) solución )[1] 1.450 g/cm3 (20 °C, puro) |
| Punto de fusión | −43 °C; −45 °F; 230 K |
| Punto de ebulición | 1 502 °C; 2 736 °F; 1 775 K |
| Solubilidade en auga | Miscible |
| Solubilidade | soluble en éter, alcohol insoluble en éter de petróleo |
| Presión de vapor | 5 mmHg (30 °C) |
| Acidez (pKa) | 11,75 |
| Índice de refracción (nD) | 1,4061 |
| Viscosidade | 1,245 cP (20 °C) |
| Momento dipolar | 2,26 D |
| Termoquímica | |
| Entalpía estándar de formación ΔfH |
−187,80 kJ/mol |
| Capacidade calorífica, C | 1,267 J/(g·K) (gas) 2,619 J/(g·K) (líquido) |
| Perigosidade | |
| Clasificación da UE | |
| Frases R | R5, R8, R20/22, R35 |
| Frases S | S1/2, S17, S26, S28, S36/37/39, S45 |
| NFPA 704 | |
| Punto de inflamabilidade | Non inflamable |
| LD50 | 1518 mg/kg 2000 mg/kg (oral, rato)[2] |
Se non se indica outra cousa, os datos están tomados en condicións estándar de 25 °C e 100 kPa. | |
O peróxido de hidróxeno é unha especie reactiva de osíxeno e é o peróxido máis simple, xa que ten un único enlace osíxeno-osíxeno. Decomponse a modo cando se expón á luz, e rapidamente na presenza de compostos orgánicos ou reactivos. Gárdase normalmente cun estabilizador nunha solución lixeiramente acídica nunha botella escura que impide o paso da luz. O peróxido de hidróxeno se atopa en sistemas biolóxicos, incluído o corpo humano. Enzimas que usan ou descompoñen o peróxido de hidróxeno se clasifican como peroxidasas.
Estrutura
editarO peróxido de hidróxeno e unha molécula non planar cunha simetría (retorta) C2; isto foi mostrado por primeira vez por Paul-Antoine Guiguère en 1950 usando espectroscopía de infravermellos[4][5]. Aínda que o enlace O-O é un enlace sinxelo, esta molécula ten unha barreira de rotación entre enantiómeros relativamente alta, de 386cm-1 (4.62 kJ/mol) mediante a configuración trans, e 2460 cm−1 (29.4 kJ/mol) mediante a configuración cis[6]. Crese que estas barreiras son causadas pola repulsión entre os pares solitarios de electróns dos átomos de osíxeno adxacentes e os efectos dipolares entre os enlaces O-H. Para comparar, a barreira rotacional do etano (C2H6) é 1040 cm−1 (12.4 kJ/mol).
O ángulo dihedral de aproximadamente 100° entre os dous enlaces O-H fai que esta molécula sexa quiral. Trátase do enantiómero máis pequeno e simple. Relacionado con isto, propúxose que as interaccións enantioespecíficas dun enantiómero en vez doutro puideran levar a amplificación dunha forma enantiomérica dos ácidos ribonucleicos, dando así á orixe da homoquiralidade no mundo do ARN[7].
Comparación con compostos análogos
editarO peróxido de hidróxeno ten varios análogos estruturais con tipos de enlace Hm-X-X-Hn (na táboa inferior se inclúe a auga para comparación). Ten o máis alto punto teórico de ebulición desta serie (X = O, N, S). O seu punto de fusión é tamén bastante alto, comparable ao da hidracina e auga: soamente hidroxilamina cristaliza máis rápido de forma significativa, indicando a gran forza das pontes de hidróxeno do peróxido de hidróxeno. Difosfano e disulfuro de hidróxeno posúen débiles pontes de hidróxeno e teñen pouca similitude química co peróxido de hidróxeno. Estruturalmente falando, estes análogos todos adoptan estruturas tortas similares, debido á repulsión entre os adxacentes pares solitarios de electróns.
| Nome | Fórmula | Peso molecular (g/mol) |
Punto de fusión (°C) |
Punto de ebulición (°C) |
|---|---|---|---|---|
| Peróxido de hidróxeno | HOOH | 34.01 | −0.43 | 150.2* |
| Auga | HOH | 18.02 | 0.00 | 99.98 |
| Disulfuro de hidróxeno | HSSH | 66.15 | −89.6 | 70.7 |
| Hidracina | H2NNH2 | 32.05 | 2 | 114 |
| Hidroxilamina | NH2OH | 33.03 | 33 | 58* |
| Difosfano | H2PPH2 | 65.98 | −99 | 63.5* |
Descubrimento
editarFoi descuberto por Louis Jacques Thénard en 1818 como resultado da mestura de peróxido de bario con ácido nítrico (tamén descubriu que, substituíndo o ácido nítrico con ácido clorhídrico, o proceso melloraba). O peróxido de hidróxeno fórmase conxuntamente co cloruro de bario, sendo ambos solubles en auga. O cloruro de bario pódese eliminar precipitándoo mediante o uso de ácido sulfúrico[8],[9].
A determinación da estrutura molecular do peróxido de hidróxeno resultou ser moi difícil. En 1892, o físico-químico italiano Giacomo Carrara (1864-1925) determinou o seu peso molecular por descenso crioscópico, o cal confirmou que a súa fórmula molecular era H2O2 [10]. Como mínimo media ducia de hipotéticas estruturas moleculares parecían consistentes coa evidencia dispoñible[11]. En 1934, o matemático inglés William Penny e o físico escocés Gordon Sutherland propuxeron a estrutura molecular do peróxido de hidróxeno que era moi similar á actualmente aceptada[12], [13].
Produción industrial
editarA día de hoxe, o peróxido de hidróxeno manufactúrase case de forma exclusiva polo proceso da antraquinona, que foi orixinalmente desenvolvido por BASF en 1939. Este proceso comeza pola redución dunha antraquinona (como a 2-etilantraquinona ou o 2-amil derivativo) á correspondente antrahidroquinona, típicamente por hidroxenación sobre un catalizador de paladio. Na presenza de osíxeno, a antrahidroquinona se autoxida: os átomos febles de hidróxeno dos grupos hidroxi transfírense á molécula de osíxeno, para dar lugar ao peróxido de hidróxeno, rexenerando á antraquinona neste proceso. A maioría dos procesos comerciais conseguen esta oxidación burbulleando aire comprimido a través dunha solución de antrahydroquinona. O peróxido de hidróxeno se extrae da solución e a antraquinona se recicla para repetir os ciclos de hidroxenación e oxidación[14],[15].
A reacción neta do proceso catalizado pola antraquinona é[16]:
O prezo do proceso depende moito da reciclaxe efectiva dos solventes de extracción, do catalista hidroxenador e da quinona, que adoita ser cara.
Dispoñibilidade
editarO peróxido de hidróxeno está normalmente dispoñible como unha solución en auga. Está normalmente dispoñible en farmacia a unha concentración 3 e 6% (peso/peso). Para o seu uso en laboratorio, as solucións máis comúns son de 30% (peso/peso, equivalente a 9.8M). Solucións de peróxido de hidróxeno con concentracións máis altas tamén están dispoñibles, pero dado o potencial de solucións maiores de 68% de convertirse en vapor de auga e oxíxeno, e a temperatura deste vapor incrementando canto máis alta sexa a concentración, estas solucións son moito máis perigosas de manipular e precisan de coidados especiais e do seu almacenamento en áreas dedicadas.
Produción e metabolismo do peróxido de hidróxeno celular
editarO peróxido de hidróxeno prodúcese en humanos e outros animais como un produto de relativa curta vida en procesos bioquímicos. A concentracións elevadas (>0.1μM) é tóxico para as células [17]. Isto débese á oxidación de proteínas, membranas lipídicas e ADN. Este dano pode deberse á reacción directa do peróxido de hidróxeno ou a súa decomposición (en presenza de metales) no radical hidroxilo (OH·), un composto altamente oxidante que oxida case calquera molécula que se atope arredor [18].
A principal fonte do peróxido de hidróxeno celular provén da dismutación do anión superóxido (O2–·), ben de forma espontánea ou catalizada pola enzima superóxido dismutasa (SOD).
2 O-·
2 + 2 H+
→ O
2 + H
2O
2
As principais fontes de produción do anión superóxido en humanos e outros animais son: (i) as NADPH oxidasas, presentes nas membranas celulares, e (ii) os complexos I e III da cadea de transporte de electróns mitocondrial[19],[20]. Ademais, existe produción directa de peróxido de hidróxeno no peroxisoma, que posúe enzimas que producen peróxido de hidróxeno a partir da oxidación de ácidos graxos, D-amino ácidos e xantina, entre outros compostos[21].
Hai dous grupos principais de enzimas que descompoñen o peróxido de hidróxeno:
(i) A catalasa, que descompón 2 moléculas de peróxido de hidróxeno en auga e osíxeno, grazas ao seu grupo hemo no sitio activo[22].
(ii) A tiol peroxidasa, que descompón 1 molécula de peróxido de hidróxeno en auga, grazas a un extremadamente reactivo grupo tiol do aminoácido cisteína no seu sitio activo (citación requirida). Neste proceso un dos átomos de oxíxeno se transfire ao grupo tiol (R-SH), xerando un intermediario coñecido como ácido sulfénico (R-SOH) (citación requirida). Este intermediario é de vida curta e tende a reaccionar cun grupo tiol veciño (outra cisteína da mesma proteína ou dunha proteína veciña), xerando un disulfuro (R-S-S-R') e liberando unha molécula de auga.[23].
(iii) A glutatión peroxidasa, que descompón 1 molécula de peróxido de hidróxeno en auga. O mecanismo é similar ao da tiol peroxidasa pero emprega un grupo selenol, do aminoácido non canónico selenocisteína[24].
Información xeral
editarO peróxido de hidróxeno gasoso aparece naturalmente en cantidades pequenas no aire. É inestábel e descomponse rapidamente en osíxeno e auga con liberación de calor. Aínda que non sexa inflamábel, é un axente oxidante poderoso que pode causar a combustión espontánea en contacto con materia orgánica ou algúns metais como o cobre ou o bronce.
Atópase en concentracións baixas (3-9%) en moitos produtos domésticos de uso medicinal e como clarexador da roupa e o cabelo. Na industria, o peróxido de hidróxeno emprégase en concentracións máis elevadas para clarexar tecidos e pasta de papel, como combustíbel para axuste e corrección nas traxectorias de naves espaciais. Na medicina utilízase como desinfectante ou axente esterilizante en autoclaves de plasma. Na área química úsase como compoñente da espuma de goma orgánica e outras substancias químicas. Tamén se utiliza para medir a actividade dalgunhas enzimas, como a catalase.
Tamén se lle fai actuar en diversos mecanismos de degradación de aminoácidos (en asociación con amino-oxidases), por causa do seu poder oxidante elevado. Pode actuar tamén na fotosíntese (ciclo do glioxilato) e na síntese de glicosa a partir de fontes que non conteñan carbohidratos (gliconeoxénese).
A auga osixenada utilízase tamén nos branqueamentos dentarios. Colócase na superficie dos dentes e actívase mediante un LED que facilita a penetración no esmalte dentario, actuando sobre os compostos cromóforos (confiren cor), quer da dentina, quer do esmalte, alterándoos ou eliminándoos.
O control do ASSET para probar vehículos non tripulados de reentrada atmosférica subescalados levaba propulsores de reacción de peróxido de hidróxeno.
Notas
editar- ↑ Easton, M. F.; Mitchell, A. G.; Wynne-Jones, W. F. K. (1952). "The behaviour of mixtures of hydrogen peroxide and water. Part 1.?Determination of the densities of mixtures of hydrogen peroxide and water". Transactions of the Faraday Society 48: 796. doi:10.1039/TF9524800796.
- ↑ "Hydrogen peroxide". Immediately Dangerous to Life and Health. National Institute for Occupational Safety and Health (NIOSH).
- ↑ Hill, C. N. (2001). A Vertical Empire: The History of the UK Rocket launch and Space Programme, 1950–1971. Imperial College Press. ISBN 978-1-86094-268-6.
- ↑ Giguère, Paul A. (1950). "The Infra‐Red Spectrum of Hydrogen Peroxide" (PDF). Journal of Chemical Physics. 18 (1):88. https://doi.org/10.1063/1.1747464. https://authors.library.caltech.edu/11457/1/GIGjcp50.pdf
- ↑ Giguère, Paul A. (1983). "Molecular association and structure of hydrogen peroxide". Journal of Chemical Education. 60 (5): 399–401. https://doi.org/10.1021/ed060p399
- ↑ Hunt, Robert H.; Leacock, Robert A.; Peters, C. Wilbur; Hecht, Karl T. (1965). "Internal-Rotation in Hydrogen Peroxide: The Far-Infrared Spectrum and the Determination of the Hindering Potential" (PDF). The Journal of Chemical Physics. 42 (6): 1931. https://doi.org/10.1063/1.1696228
- ↑ Ball, Rowena; Brindley, John (2016). "The Life Story of Hydrogen Peroxide III: Chirality and Physical Effects at the Dawn of Life". Origins of Life and Evolution of Biospheres. 46 (1): 81–93. https://doi.org/10.1007/s11084-015-9465-y
- ↑ L. J. Thénard (1818) "Observations sur des nouvelles combinaisons entre l’oxigène et divers acides," Annales de chimie et de physique, 2nd series, vol. 8, pages 306-312; a destacar a páxina 308. https://books.google.be/books?id=-N43AAAAMAAJ&pg=PA306&redir_esc=y#v=onepage&q&f=false
- ↑ Jones, C. W.; Clark, J. H. (1999). Applications of Hydrogen Peroxide and Derivatives. Royal Society of Chemistry. https://doi.org/10.1039/9781847550132-00001
- ↑ G. Carrara (1892) "Sul peso molecolare e sul potere rifrangente dell' acqua ossigenata", Atti della Reale Accademia dei Lincei, series 5, 1 (2) : 19–24. https://web.archive.org/web/20160904175937/https://books.google.com/books?id=Yk46AQAAMAAJ&pg=PA19#v=onepage&q&f=false
- ↑ W. C. Schumb, C. N. Satterfield, and R. L. Wentworth (1 December 1953) "Report no. 43: Hydrogen peroxide, Part two" at the Wayback Machine, Office of Naval Research, Contract No. N5ori-07819 On p. 178 https://hydrogen-peroxide.us/chemical-properties/MIT-Schumb_etal-hydrogen_Peroxide_ch5_n_ch6-1954.pdf. Os autores presentan seis modelos hipotéticos para a estrutura molecular do peróxido de hidróxeno. Na páxina 184, a presente estrutura considérase a máis próxima á correcta, aínda que se mantiña unha pequena dúbida ao respecto
- ↑ Penney, W. G.; Sutherland, G. B. B. M. (1934). "The theory of the structure of hydrogen peroxide and hydrazine". Journal of Chemical Physics. 2 (8): 492–498. https://doi.org/10.1063/1.1749518
- ↑ Penney, W. G.; Sutherland, G. B. B. M. (1934). "A note on the structure of H2O2 and H4N2 with particular reference to electric moments and free rotation". Transactions of the Faraday Society. 30: 898–902. https://doi.org/10.1039/tf934300898b
- ↑ Campos-Martin, Jose M.; Blanco-Brieva, Gema; Fierro, Jose L. G. (2006). "Hydrogen Peroxide Synthesis: An Outlook beyond the Anthraquinone Process". Angewandte Chemie International Edition. 45 (42): 6962–6984. https://doi.org/doi:10.1002/anie.200503779
- ↑ H. Riedl and G. Pfleiderer, U.S. Patent 2,158,525 (2 October 1936 in USA, and 10 October 1935 in Germany) to I. G. Farbenindustrie, Germany
- ↑ Campos-Martin, Jose M.; Blanco-Brieva, Gema; Fierro, Jose L. G. (2006). "Hydrogen Peroxide Synthesis: An Outlook beyond the Anthraquinone Process". Angewandte Chemie International Edition. 45 (42): 6962–6984. https://doi.org/doi:10.1002/anie.200503779
- ↑ Sies, H.; Jones, D.P (2020). Reactive oxygen species (ROS) as pleiotropic physiological signalling agents. Nature Reviews Molecular Cell Biology. 21: 363–383 https://doi.org/10.1038/s41580-020-0230-3
- ↑ Imlay J.(2008). Cellular defenses against superoxide and hydrogen peroxide. Annual Review of Biochemistry 77:755-76. https://doi.org/10.1146/annurev.biochem.77.061606.161055
- ↑ Chouchani E.T., Pell V.R., James A.M., Work L.M., Saeb-Parsy K., Frezza C., Krieg T., Murphy M.P. (2016). A Unifying Mechanism for Mitochondrial Superoxide Production during Ischemia-Reperfusion Injury. Cell Metabolism 23(2):254-263. https://doi.org/10.1016/j.cmet.2015.12.009.
- ↑ Hernasanz-Agustín,P.,Enríquez,J.A.(2021) Generation of Reactive Oxygen Species by Mitochondria.Antioxidants (Basel) 10(3):415. https://doi.org/10.3390/antiox10030415
- ↑ Schrader,M.; Fahimi H.,D (2006). Peroxisomes and oxidative stress. Biochimica et Biophysica Acta (BBA) - Molecular Cell Research. 1763(12):1755-1766. https://doi.org/10.1016/j.bbamcr.2006.09.006
- ↑ Chelikani P, Fita I, Loewen PC (January 2004). "Diversity of structures and properties among catalases". Cellular and Molecular Life Sciences. 61 (2): 192–208. https://doi.org/10.1007/s00018-003-3206-5
- ↑ Flohé, L., Toppo ,S., Cozza, G., and Ursini,F (2011) A Comparison of Thiol Peroxidase Mechanisms. Antioxidants & Redox Signaling. 2011.763-780.http://doi.org/10.1089/ars.2010.3397
- ↑ Flohé, L., Toppo ,S., Cozza, G., and Ursini,F (2011) A Comparison of Thiol Peroxidase Mechanisms. Antioxidants & Redox Signaling. 2011.763-780.http://doi.org/10.1089/ars.2010.3397
Este artigo sobre química é, polo de agora, só un bosquexo. Traballa nel para axudar a contribuír a que a Galipedia mellore e medre.
Existen igualmente outros artigos relacionados con este tema nos que tamén podes contribuír. |
