Ciclo do glioxilato
O ciclo do glioxilato é unha vía metabólica anabólica, considerada unha variante do ciclo do ácido cítrico, que ten lugar fundamentalmente nas plantas, bacterias (como por exemplo Escherichia coli), protistas, e fungos (por exemplo en lévedos). O ciclo do glioxilato consiste na conversión de acetil-CoA en succinato, o cal se pode usar para a síntese de carbohidratos por gliconeoxénese. Como o acetil-CoA procede xeralmente de lípidos, permite transformar lípidos en azucres.[1] En microorganismos, o ciclo do glioxilato permite ás células utilizar compostos carbonados simples como fonte de carbono cando as fontes máis complexas de glicosa non están dispoñibles.[2] O ciclo é especialmente activo nas sementes en xerminación que almacenan triglicéridos. En xeral, considérase que o ciclo non existe nos animais, con algunhas excepcións, como os nematodos nas fases embrionarias iniciais, pero ultimamente parece que podería existir en máis especies animais, o que está levando a discutir a evolución destes encimas en bacterias e animais.[3][1]
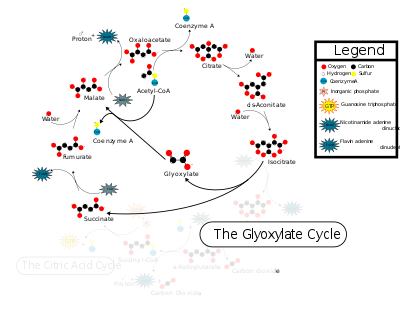
Semellanzas co ciclo do ácido cítrico
editarO ciclo do glioxilato utiliza tres dos cinco encimas do ciclo do ácido cítrico e comparte varias das súas reaccións intermedias. Os dous ciclos varían só en dúas reaccións, catalizadas pola isocitrato liase e a malato sintase. No ciclo do glioxilato a isocitrato liase (ICL) converte o isocitrato en glioxilato e succinato en vez de producirse unha conversión a α-cetoglutarato coma no ciclo do ácido cítrico.[1] Isto evita os pasos de descarboxilación que teñen lugar no ciclo do ácido cítrico (por iso aquí non se libera CO2), o que permite que compostos simples se usen en posteriores sínteses doutras moléculas como a glicosa.[2] O ciclo do glioxilato continúa, orixinando, a partir de glioxilato e acetil-CoA, malato, en reacción catalizada pola malato sintase (MS), que non actúa no ciclo do ácido cítrico.[1] En cada volta do ciclo do glioxilato incorpóranse dúas moléculas de acetil-CoA (no paso de oxalacetato a citrato común co ciclo do ácido cítrico, e no paso de glioxilato a malato específico do ciclo do glioxilato) e fórmase unha molécula de succinato e outra de NADH a partir de NAD+.
Nas plantas o ciclo do glioxilato ten lugar nos glioxisomas. O succinato formado no ciclo pode entrar no ciclo do ácido cítrico das mitocondrias, e os seus intermediarios poden orixinar fosfoenolpiruvato que entra na gliconeoxénese do citosol.
Reaccións do ciclo
editar1) O acetil-CoA (procedente da beta-oxidación dos ácidos graxos) reacciona co oxalacetato formando citrato. O encima que cataliza esta reacción é a citrato sintase, que tamén actúa no ciclo do ácido cítrico*.
2) O citrato transfórmase en isocitrato pola aconitase, que tamén actúa no ciclo do ácido cítrico*.
3) O isocitrato, por medio dunha reacción catalizada polo encima isocitrato liase, fragméntase en glioxilato e succinato. Este encima é específico do ciclo do glioxilato.
4) O acetil-CoA transfire un acetilo ao glioxilato producindo malato nunha reacción catalizada pola malato sintase, que non actúa no ciclo do ácido cítrico.
5) O malato sofre unha deshidroxenación para formar novamente oxalacetato nunha reacción catalizada pola malato deshidroxenase, tamén presente no ciclo do ácido cítrico.
*Os encimas citrato sintase e aconitase que interveñen no ciclo do glioxilato difiren estruturalmente dos seus homólogos da mitocondria, aínda que catalizan a mesma reacción.[4]
A ecuación global do ciclo:
Papel na gliconeoxénese
editarOs ácidos graxos dos lípidos son usados frecuentemente polos vertebrados como fontes de enerxía, degradándoos por medio da beta-oxidación a moléculas de acetato, unidas ao coencima A, formando acetil-CoA. Este entra no ciclo do ácido cítrico para ser completamente oxidado a dióxido de carbono e participar na produción de enerxía respiratoria. Así, as células obteñen enerxía das graxas. Para utilizar este acetil-CoA como fonte de carbonos para a biosíntese de carbohidratos utilízase o ciclo do glioxilato.
Os seres vivos que teñen paredes celulares, como as plantas, fungos e bacterias, requiren grandes cantidades de carbohidratos durante o seu crecemento para dedicalos á bisosíntese dos polisacáridos complexos das súas paredes, como a celulosa, glicanos, e quitina. Nestes organismos, en ausencia de carbohidratos dispoñibles (como sucede en certos ambientes microbianos ou durante a xerminación das sementes das plantas), o ciclo do glioxilato permite a síntese de glicosa a partir de lípidos utilizando o acetil-CoA xerado na β-oxidación dos ácidos graxos. As sementes que almacenan triglicéridos poden utilizar estes durante a xerminación para formar azucres por medio do cico do glioxilato.
O succinato que se libera no ciclo do glioxilato entra no ciclo do ácido cítrico, onde pode dar lugar a malato e oxalacetato. Estes despois poden ser desviados desviados á gliconeoxénese, transformándose primeiro en fosfoenolpiruvato e despois en glicosa. O resultado neto do funcionamento do ciclo do glioxilato é a produción de azucres a partir de graxas.[2]
Funcións en distintos organismos
editarPlantas
editarNas plantas o ciclo do glioxilato ten lugar fundamentalmente nos glioxisomas. Durante a xerminación a planta depende das súas reservas, xa que non empezou a facer aínda a fotosíntese. O ciclo permite que as sementes que almacenan triglicéridos usen estes para producir azucres, que se usarán en biosínteses ou para producir enerxía.
Ademais, grazas ao ciclo, as plantas e bacterias poden vivir con moléculas tan simples como o acetato (ou calquera fonte que poida orixinar acetil-CoA). O acetato é convertido en acetil-CoA, e usado como fonte de enerxía ou como fonte de carbono grazas ao ciclo do glioxilato. O acetil-CoA pode tamén reaccionar co glioxilato para producir coencimas reducidos, que se poden usar para producir enerxía na cadea de transporte electrónico e fosforilación oxidativa [5].
Fungos patóxenos
editarO ciclo do glioxilato pode servir tamén para un propósito completamente distinto en certas especies de fungos patóxenos. Nestes seres os niveis dos encimas do ciclo do ácido cítrico isocitrato liase e malato sintase increméntanse moito cando están en contacto co seu hóspede humano. Estudos con mutantes de certa especie de fungo que perderon a isocitrato liase demostraron que son significativamente menos virulentos comparados co tipo salvaxe. O vínculo exacto entre estas observacións aínda está sendo explorado, pero pode concluírse que o ciclo do glioxilato é un factor significativo na patoxénese destes microorganismos.[6]
Vertebrados
editarA opinión tradicional era que os vertebrados non tiñan ciclo do glioxilato, porque carecían dos encimas chave isocitrato liase e malato sintase. Pero hoxe isto non está tan claro, e podería ser que o ciclo puidese existir polo menos nalgúns vertebrados.[7] [8] Algúns estudos mostran evidencias de que os compoñentes do ciclo do glioxilato existen en cantidades significativas nos tecidos hepáticos dos polos [9]. Outros experimentos proporcionaron evidencias da presenza do ciclo en certos insectos e invertebrados mariños, o que se une ás xa coñecidas probas da súa existencia en nematodos. Porén, outros experimentos refutan esta idea [10]. Tamén hai moita controversia sobre a presenza do ciclo en mamíferos (algunhas publicacións citan que o ciclo está activo nos osos durante a hibernación e outras négano)[11][12]. Por outra parte, non se identificou ningún xene funcional relacionado coa isocitrato liase e malato sintase nos xenomas de mamíferos placentarios, mentres que nalgúns mamíferos non placentarios e outros vertebrados a malato sintase parece ser funcional.[1] A vitamina D podería regular esta vía metabólica nos vertebrados.[13][14] [15]
Intentouse, polo momento sen éxito, introducir por Enxeñaría Xenética os xenes dos encimas específicos do ciclo nalgúns mamíferos como as ovellas, para mellorar a produción de la, que se ve limitada pola dispoñibilidade de glicosa [1][16][17]. Por outra parte, o ciclo do glioxilato, presente en microorganismos patóxenos pero non en humanos, podería ser o branco para a preparación de antibióticos. O antibiótico mataría ao patóxeno sen danar aos humanos.[2]
Notas
editar- ↑ 1,0 1,1 1,2 1,3 1,4 1,5 Kondrashov, Fyodor A; Koonin, Eugene V; Morgunov, Igor G; Finogenova, Tatiana V; Kondrashova, Marie N (23 October 2006). "Evolution of glyoxylate cycle enzymes in Metazoa: evidence of multiple horizontal transfer events and pseudogene formation". Biology Direct 1: 31. PMC 1630690. PMID 17059607. doi:10.1186/1745-6150-1-31.
- ↑ 2,0 2,1 2,2 2,3 Lorenz, Michael; Fink, Gerald; (2002). "Life and Death in a Macrophage: Role of the Glyoxylate Cycle in Virulence". Eukaryotic Cell 1 (5): 657–662. doi:10.1128/EC.1.5.657-662.2002.
- ↑ Popov, EA; Moskalev, EA; Shevchenko, MU; Eprintsev, AT (2005). "Comparative analysis of glyoxylate cycle key enzyme isocitrate lyase from organisms of different systematic groups". Journal of Evolutionary Biochemistry and Physiology 41 (6): 631–639. doi:10.1007/s10893-006-0004-3.
- ↑ Mathews, Van Holde, Ahern (2003). "Procesos oxidativos: ciclo del ácido cítrico y ruta de las pentosas fosfato". En Addison Wesley. Bioquímica (3ª ed.). pp. 568-571. ISBN 84-7829-053-2.
- ↑ Berg JM, Tymoczko JL, Stryer L (2002). W. H. Freeman - New York, ed. Biochemistry.[1]
- ↑ Lorenz, Michael; Fink, Gerald (2001). "The Glyoxylate Cycle is Required for Fungal Virulence". Nature 412 (6842): 83–86. doi:10.1038/35083594.
- ↑ V. N. Popov, E. A. Moskalev, M. U. Shevchenko, A. T. Eprintsev (2005). "Comparative Analysis of Glyoxylate Cycle Key Enzyme Isocitrate Lyase from Organisms of Different Systematic Groups". Journal of Evolutionary Biochemistry and Physiology 41 (6).
- ↑ Davis WL, Goodman DB (1992). "Evidence for the glyoxylate cycle in human" 234 (4): 461–8. PMID 1456449. doi:10.1002/ar.1092340402.
- ↑ David, WL; Jones RG, Farmer GR, Dickerson T, Cortinas E, Cooper OJ, Crawford L, Goodman DB (1990). "Identification of Glyoxylate Cycle Enzmes in Chick Liver". PubMed 227: 271–284. PMID 2164796. doi:10.1002/ar.1092270302.
- ↑ Storrey Kenneth (2004). John Wiley and Sons, Inc., ed. Functional Metabolism: Regulation and Adaption. Hobocken, New Jersey. pp. 221–223. ISBN 9780471675570.
- ↑ Davis WL, Goodman DB, Crawford LA, Cooper OJ, Matthews JL (1990). "Hibernation activates glyoxylate cycle and gluconeogenesis in black bear brown adipose tissue". Biochim. Biophys. Acta 1051 (3): 276–8. PMID 2310778. doi:10.1016/0167-4889(90)90133-X.
- ↑ Jones JD, Burnett P, Zollman P (1999). "The glyoxylate cycle: does it function in the dormant or active bear?". Comp. Biochem. Physiol. B, Biochem. Mol. Biol. 124 (2): 177–9. PMID 10584301. doi:10.1016/S0305-0491(99)00109-1.
- ↑ Davis WL, Jones RG, Farmer GR, Dickerson T, Cortinas E, Cooper OJ, Crawford L, Goodman DB (1990). "Glyoxylate cycle in the rat liver: effect of vitamin D3 treatment". The Anatomical record 227 (3): 271–84. PMID 2164796. doi:10.1002/ar.1092270302.
- ↑ Davis WL, Matthews JL, Goodman DB (1989). "Identification of glyoxylate cycle enzymes in chick liver--the effect of vitamin D3: cytochemistry and biochemistry". FASEB 3 (5): 1651–5. PMID 2164796. doi:10.1002/ar.1092270302.
- ↑ Davis WL, Jones RG, Farmer GR, Cortinas E, Matthews JL, Goodman DB (1989). "The glyoxylate cycle in rat epiphyseal cartilage: the effect of vitamin-D3 on the activity of the enzymes isocitrate lyase and malate synthase". Bone 10 (3): 201–6. PMID 2553083. doi:10.1016/8756-3282(89)90054-9.
- ↑ Ward, Kevin A (2000-03). "Transgene-mediated modifications to animal biochemistry". Trends in Biotechnology (en inglés) 18 (3): 99–102. doi:10.1016/S0167-7799(99)01417-1.
- ↑ Ward, Kevin; C. D. Nancarrow (01). "The genetic engineering of production traits in domestic animals". Cellular and Molecular Life Sciences 47 (9): 913–922. doi:10.1007/BF01929882. Consultado o 31 March 2011.