Ácido lipoico
O ácido lipoico, tamén chamado ácido α-lipoico, é un composto organosulfurado derivado do ácido caprílico (ácido octanoico).[2] O ácido alfa-lipoico prodúcese de forma normal en animais e é esencial para o metabolismo aerobio. Tamén se fabrica e comercializa como suplemento dietético nalgúns países, onde se vende como antioxidante, e está dispoñible como fármaco noutros países. O lipoato é a base conxugada do ácido lipoico e a foma máis habitual de ácido lipoico en condicións fisiolóxicas.[2] Na natureza só existe o enantiómero (R)-(+) e é fundamental para o metabolismo aerobio porque é un cofactor esencial de moitos complexos encimáticos.[2]
| Ácido lipoico | |
|---|---|
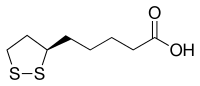 | |
 | |
 | |
Ácido (R)-5-(1,2-ditiolan-3-il)pentanoico | |
Outros nomes Ácido α-lipoico; ácido alfa-lipoico; ácido tióctico; ácido 6,8-ditiooctanoico | |
| Identificadores | |
| Número CAS | 1077-28-7 (racemato), 1200-22-2 (R) |
| PubChem | 6112 |
| ChemSpider | 5886 |
| UNII | 73Y7P0K73Y (racemato), VLL71EBS9Z (R) |
| DrugBank | DB00166 |
| KEGG | C16241 |
| MeSH | Lipoic+acid |
| ChEBI | CHEBI:30314 |
| ChEMBL | CHEMBL134342 |
| Ligando IUPHAR | 4822 |
| Imaxes 3D Jmol | Image 1 |
| |
| |
| Propiedades | |
| Fórmula molecular | C8H14O2S2 |
| Masa molar | 206,33 g mol−1 |
| Aspecto | Cristais aciculares amarelos |
| Punto de fusión | 60–62 °C; 140–144 °F; 333–335 K |
| Solubilidade en auga | Moi pouco soluble (0,24 g/L)[1] |
| Solubilidade en etanol 50 mg/mL | Soluble |
| Compostos relacionados | |
| Compostos relacionados | Lipoamida Ácido asparagúsico |
Se non se indica outra cousa, os datos están tomados en condicións estándar de 25 °C e 100 kPa. | |
Abreviaturas
editarÉ útil indicar as abreviaturas utilizadas en moitas das referencias proporcionadas e na literatura inglesa, aínda que non se usarán neste artigo. Son as seguintes: Ácido lipoico = LA ; ácido (R)-lipoico = RLA ; ácido (S)-lipoico = SLA ; mestura racémica dos dous enantiómeros = (R/S)-LA ; ácido alfa-lipoico = ALA ; ácido dihidrolipoico = DHLA.
Propiedades físicas e químicas
editarO ácido lipoico (ou ácido alfa-lipoico[2][3] ou ácido tióctico[4]) é un composto organosulfurado derivado do ácido octanoico.[2] Contén dous átomos de xofre (nas posicións C6 e C8) conectados por un enlace disulfuro e por iso se considera que está oxidado, añinda que cada un dos átomos de xofre pode existir en maiores estados de oxidación.[2]
O átomo de carbono C6 é quiral e a molécula ten dous posibles enantiómeros: ácido (R)-(+)-lipoico e ácido (S)-(-)-lipoico ou como mestura racémica ácido (R/S)-lipoico.
A súa aparencia física é a dun sólido amarelo e estruturalmente contén un grupo ácido carboxílico terminal e un anel ditiolano terminal.
Para o seu uso en produtos de suplemento dietético e fórmulas maxistrais de farmacias a USP estableceu unha monografía oficial para este ácido.[5][6]
A biodispoñibilidade é do 30% (oral) en humanos.[7]
Función biolóxica
editarO ácido lipoico é o cofactor de cinco encimas ou clases de encimas: piruvato deshidroxenase, alfa-cetoglutarato deshidroxenase, o sistema de clivaxe da glicina (GCS), a cetoácido de cadea ramificada deshidroxenase, e a alfa-oxo(ceto)adipato deshidroxenase. Os dous primeiros son esenciais no ciclo do ácido cítrico. O GCS regula as concentracións de glicina.[8]
Biosíntese e enlace
editarA maioría do ácido (R)-lipoico producido endoxenamente non está "libre" porque o seu precursor o ácido octanoico está ligado a complexos encimáticos antes da inserción encimática dos átomos de xofre. Como cofactor, o ácido (R)-lipoico está enlazado covalentemente por enlace amida a un residuo de lisina terminal dos dominios lipoíl do encima. O seu precursor o ácido octanoico prodúcese pola vía da biosíntese de ácidos graxos en forma de octanoíl-proteína portadora de acilos.[2] En eucariotas hai unha segunda vía para a biosíntese de ácidos graxos nas mitocondrias que se usa para este propósito.[2] O octanoato é transferido como tioéster da proteína portadora de acilos desde a vía biosintetica de ácidos graxos a unha amida da proteína con dominio lipoíl pola acción dun encima chamado octanoiltransferase.[2] Substitúense dous hidróxenos do octanoato por grupos xofre polo mecanismo do radical SAM durante a catálise realizada pola lipoíl sintase.[2] Como resultado, o ácido lipoico sintetízase unido a proteínas e non libre no medio. O ácido lipoico pode ser separado da proteína sempre que esta sexa degradada e pola acción do encima lipoamidase.[9] Algúns organismos poden usar o lipoato libre grazas a un encima chamado lipoato proteín ligase, que o une covalentemente á proteína correcta. Para a actividade ligase deste encima cómpre ATP.[10]
Transporte celular
editarXunto co sodio e as vitaminas biotina (B7) e ácido pantoténico (B5), o ácido lipoico entra nas células por medio do SMVT (transportador de multivitaminas dependente do sodio). Cada un dos compostos transportados polo SMVT é competitivo cos outros. Por exemplo, demostrouse que o incremento da captación de ácido lipoico[11] ou de ácido pantoténico[12] reduce a captación de biotina e as actividades de encimas dependentes da biotina.
Actividade encimática
editarO ácido lipoico é un cofactor de polo menos cinco sistemas encimáticos.[2] Dous destes forman parte do ciclo do ácido cítrico por medio do cal moitos organismos converten os nutrientes en enerxía. Os encimas lipoilados teñen ácido lipoico unido a eles covalentemente. O grupo lipoílo transfire grupos acilo nos complexos da 2-oxoácido deshidroxenase, e o grupo metilamina no complexo de clivaxe da glicina ou a glicina deshidroxenase.[2]
As reaccións de transferencia da 2-oxoácido deshidroxenase transfire ocorren por un mecanismo similar en:
- o complexo da piruvato deshidroxenase
- os complexos da α-cetoglutarato deshidroxenase ou 2-oxoglutarato deshidroxenase
- o complexo cetoácido de cadea ramificada deshidroxenase (BCDH)
- o complexo acetoín deshidroxenase.
O máis estudado destes é o complexo da piruvato deshidroxenase.[2] Estes complexos teñen tres subunidades centrais: E1-3, que son, respectivamente, a descarboxilase, a lipoíl transferase e a dihidrolipoamida deshidroxenase. Estes complexos teñen un núcleo central E2 e as outras subunidades rodean este núcleo formando o complexo completo. No oco entre estas dúas subunidades, o dominio lipoíl transfire intermediarios entre os sitios activos.[2] O propio dominio lipoíl está unido por un tramo flexible ao núcleo central E2 e o número de dominios lipoíl varía dun a tres dependendo do organismo. O número de dominios variouse experimentalmente e parece ter un efecto limitado sobre o crecemento ata a adición de nove dominios, aínda que máis de tres diminúen a actividade do complexo.[13]
O ácido lipoico serve como cofactor do complexo da acetoín deshidroxenase catalizando a conversión de acetoín (3-hidroxi-2-butanona) a acetaldehido e acetil coencima A.[2]
O sistema de clivaxe da glicina (GCS) difire dos outros complexos e ten unha nomenclatura diferente.[2] Neste sistema a proteína H é un dominio dependente de lipoato con hélices adicionais que é móbil e conmuta entre os outros substratos; a proteína L é unha dihidrolipoamida deshidroxenase; a proteína P é a descarboxilase, e a proteína T transfire a metilamina do lipoato ao tetrahidrofolato (THF) rendendo metileno-THF e amoníaco. O metileno-THF é despois utilizado pola serina hidroximethitransferase para sintetizar serina a partir de glicina. Este sistema forma parte da maquinaria da fotorrespiración das plantas.[14]
Fontes biolóxicas e degradación
editarO ácido lipoico está presente en moitos alimentos nos cales está unido á lisina nas proteínas,[2] pero hai unha pouca maior cantidade en alimentos como os riles, corazón, fígado, espinacas, brócoli e extracto de lévedos.[15] O ácido lipoico que aparece na natureza está sempre unido covalentemente e non está facilmente dispoñible a partir das fontes dietarias.[2] Ademais, a cantidade de ácido lipoico presente en fontes dietarias é baixa. Por exemplo, para a purificación de ácido lipoico para determinar a súa estrutura utilízanse unhas 10 toneladas de residuos de fígado, que en total só renden 30 mg de ácido lipoico.[16] Como resultado, todo o ácido lipoico dispoñible como suplemento é sintetizado quimicamente.
Os niveis de base (antes da suplementación) de ácido (R)-lipoico e de ácido (R)-dihidrolipoico non se detectan no plasma humano.[17] o ácido (R)-lipoico foi detectado na cantidade de 12,3−43,1 ng/mL despois dunha hidrólise ácida, a cal libera ácido lipoico unido a proteinas. A hidrólise encimática de ácido lipoico unido a proteínas libera 1,4−11,6 ng/mL e <1-38,2 ng/mL usando subtilisina e alcalase, respectivamente.[18][19][20]
Os encimas proteolíticos dixestivos cortan o residuo (R)-lipoillisina dos complexos encimáticos mitocondriais derivados dos alimentos, pero non poden cortar o enlace amida entre o ácido lipoico e a L-lisina.[21] Tanto a lipoamida sintética coma a (R)-lipoíl-L-lisina son rapidamente cortados polas lipoamidases séricas, que liberan ácido (R)-lipoico libre e ou ben L-lisina ou ben amoníaco.[2] Sábese pouco sobre a degradación e a utilización de sulfuros alifáticos como o ácido lipoico, excepto para a cisteína.[2]
O ácido lipoico metabolízase de diversas maneiras cando se lles dá un suplemento dietario a mamíferos.[2][22] Observáronse a degradación do ácido tetranorlipoico, a oxidación dun ou de ambos os átomos de xofre a sulfóxido e a S-metilación do sulfuro. A conxugación de ácido lipoico non modificado a glicina detectouse especialmente en ratos.[22] A degradación do ácido lipoico é similar en humanos, mais non está claro se os átomos de xofre quedan oxidados significativamente.[2][23] Aparentemente os mamíferos non poden utilizar o ácido lipoico como fonte de xofre.
Síntese química
editarO ácido (S)-lipoico non existía antes da súa síntese química en 1952.[24][25] O ácido (S)-lipoico prodúcese en igual cantidade que o ácido (R)-lipoico durante os procesos de fabricación aquiral. A forma racémica foi utilizada máis amplamente en medicina en Europa e o Xapón nas décadas de 1950 a 1960 malia que axiña se recoñeceu que as varias formas do ácido lipoico non son bioequivalentes.[26] Os primeiros procedementos sintéticos para os ácidos R e S lipoicos apareceron na metade da década de 1950.[27][28][29][30] Avances na química quiral trouxeron tecnoloxías máis eficientes para a fabricación de enantiómeros puros por medio de métodos de resolución clásica e síntese asimétrica e a demanda do ácido (R)-lipoico tamén creceu nesa época. No século XXI, pode dispoñerse de mesturas racémicas de ácido (R/S)-lipoico, así como de ácido (R)-lipoico e ácido (S)-lipoico con purezas químicas e ópticas altas en cantidades industriais. Actualmente, a maioría da subministración mundial de ácido (R/S)-lipoico e ácido (R)-lipoico fabrícase na China e menores cantidades en Italia, Alemaña e o Xapón. O ácido (R)-lipoico prodúcese por modificación dun proceso descrito primeiramente por Georg Lang nunha tese de doutoramento e posteriormente patentada por DeGussa.[31][32] Aínda que o ácido (R)-lipoico é o favorecido nutricionalmente debido ao seu papel “similar a unha vitamina” no metabolismo, tanto as formas R coma R/S están facilmente dispoñibles como suplementos dietarios. Sábese que in vivo ocorren reaccions tanto estereospecíficas coma non-estereoespecíficas que contribúen aos mecanismos de acción, pero as evidencias que hai ata agora indican que o ácido (R)-lipoico pode ser o eutómero (a forma preferida nutricional e terapeuticamente).[33][34]
Farmacoloxía
editarFarmacocinética
editarUn estudo de 2007 de farmacocinética humana de sal sódica de ácido lipoico demostrou que a máxima concentración no plasma e a biodispoñibilidade son significativamente máis grandes que a forma ácida libre e os niveis plasmáticos rivais acadados por administración intravenosa da forma ácida libre.[35] Adicionalmente, conseguíronse niveis plasmáticos altos comparables aos de modelos animais onde se activou o Nrf2.[35]
As varias formas do ácido lipoico non son bioequivalentes.[26] Moi poucos estudos comparan un enantiómeros determinado co ácido lipoico racémico. Non está claro se o dobre de ácido lipoico racémico pode substituír o ácido (R)-lipoico.[35]
A dose tóxica de ácido lipoico en gatos é moi inferior á dos humanos ou os cans e produce toxicidade hepatocelular.[36]
Farmacodinámica
editarO mecanismo e acción do ácido lipoico cando se subministra externamente nun organismo é controvertido. O ácido lipoico nunha célula parece que induce primariamente a resposta ao estrés oxidativo en vez de eliminar directamente os radicais libres. Este efecto é específico para o ácido (R)-lipoico.[3] Malia o medio fortemente redutor da célula, o ácido lipoico detéctase intracelularmente tanto na forma oxidada coma na reducida.[37] O ácido lipoico pode eliminar especies reactivas do oxíxeno e do nitróxeno nun ensaio bioquímico debido aos longos tempos de incubación, pero hai pouca evidencia de que isto ocurra dentro da célula ou que a eliminación de radicais contribúa aos mecanismos primarios de acción do ácido lipoico.[3][38] A actividade de eliminación de radicais relativamente boa do ácido lipoico cara ao ácido hipocloroso (un bactericida producido polos neutrófilos que pode producir inflamación e danos nos tecidos) débese á conformación tensionada do anel ditiolano de 5 membros, que se perde coa redución a ácido dihidrolipoico. Nas células o ácido lipoico redúcese a ácido dihidrolipoico, o cal é xeralmente considerado como a forma máis bioactiva do ácido lipoico e a forma responsable da maioría dos efectos antioxidantes e de rebaixar as actividades redox do ferro e cobre non enlazados.[39] Esta teoría foi posta en dúbida debido ao alto nivel de reactividade dos dous sulfhidrilos libres, a baixa concentración intracelular de ácido dihidrolipoico, a rápida metilación dun ou dos dous sulfhidrilos, a rápida oxidación da cadea lateral a metabolitos máis curtos e o rápido efluxo desde a célula. Aínda que tanto o ácido dihidrolipoico coma o ácido lipoico se encontraron dentro das células despois da súa administración, a maioría do ácido dihidrolipoico intracelular probablemente existe en forma de disulfuros mesturados con varios residuos de cisteína de proteínas citosólicas e mitocondriais.[33] Recentes descubrimentos indican que os efectos terapéuticos e antienvellecemento débense á modulación da transdución de sinais e a transcrición xénica, o cal mellora o status antioxidante da célula. Porén, isto ocorre probablemente por medio de mecanismos prooxidantes, non pola eliminación de radicais nin por efectos redutores.[3][38][40]
Todas as formas disulfuro do ácido lipoico (nas formas R/S, R e S) poden ser reducidas a ácido dihidrolipoico, aínda que en sistemas modelo se informou tanto de reducións específicas de tecido coma estereoselectivas (con preferencia por un dos enantiómeros). O ácido lipoico pode ser reducido polo menos por dous encimas citosólicos, a glutatión redutase (GR) e a tiorredoxina redutase (Trx1) e dous encimas mitocondriais, a lipoamida deshidroxenase e a tiorredoxina redutase (Trx2). O ácido (S)-lipoico é reducido estereoselectivamente pola GR citosólica, mentres que a Trx1, a Trx2 e a lipoamida deshidroxenase reducen estereoselectivamente o ácido (R)-lipoico. O ácido (R)-(+)-lipoico é reducido encimática ou quimicamente a ácido (R)-(-)-dihidrolipoico, mentres que o ácido (S)-(-)-lipoico é reducido a ácido (S)-(+)-dihidrolipoico.[41][42][43][44][45][46][47] O ácido dihidrolipoico pode formarse igualmente intracelularmente e extracelularmente por vía non encimática por reaccións de intercambio tiol disulfuro.[48]
O ácido (R)-lipoico pode funcionar in vivo como unha vitamina B e a altas doses como nutrientes derivados de plantas como a curcumina, sulforafano, resveratrol e outras substancias nutricionais que inducen encimas de detoxificación de fase II, actuando así como axentes citoprotectores.[40][49] Esta resposta ao estrés mellora indirectamente a capacidade antioxidante da célula.[3]
O enantiómero (S) do ácido lipoico mostrou ser tóxico cando se administraba a ratas deficientes en tiamina.[50][51]
Varios estudos demostraron que o ácido (S)-lipoico ten unha actividade máís baixa que o ácido (R)-lipoico ou interfire con efectos específicos do ácido (R)-lipoico por inhibición competitiva.[52][53][54][55][56]
Usos
editarOs ácidos R/S, R e S lipoicos están facilmente dispoñibles como suplemento nutricional que se pode mercar sen receita nos Estados Unidos en forma de cápsulas, pastillas e líquidos acuosos e foron comercializados como antioxidantes.[2]
Aínda que o corpo pode sintetizar o ácido lipoico, pode tamén absorbelo da dieta. Unha suplementación dietaria en doses de 200–600 mg é probable que proporcione ata 1000 veces a cantidade que se pode obter dunha dieta regular. A absorción gastrointestinal é variable e diminúe conforme os alimentos se van usando. Recoméndase, por tanto, que o ácido lipoico dietario se tome de 30 a 60 minutos antes ou polo menos 120 minutos despois dunha comida. Os niveis sanguíneos máximos de ácido lipoico conséguense de 30 a 60 minutos despois da suplementación dietaria e pénsase que é na súa maior parte metabolizado no fígado.[57]
En Alemaña o ácido lipoico foi aprobado como fármaco para o tratamento da neuropatía diabética desde 1966 e está dispoñible como un fármaco á venda sen receita.[58]
Investigación clínica
editarDe acordo coa Sociedade Americana do Cancro en 2013 "non hai probas científicas fiables neste momento de que o ácido lipoico preveña o desenvolvemento ou espallamento do cancro".[59] En 2015, a administración intravenosa de ácido alfa-lipoico non está aprobada en ningún país do mundo excepto en Alemaña e só para a neuropatía diabética, pero probouse que é razoablemente seguro e efectivo en catro ensaios clínicos; porén, outro grande ensaio que durou catro anos non atopou diferenza respecto ao placebo.[60] En 2012 non había boas evidencias de que o ácido alfa-lipoico axude aos pacientes de trastornos mitocondriais.[61] Un traballo de revisión de 2018 recomendou o ácido alfa lipoico como un suplemento antiobesidade a doses baixas (< 600 mg/día) durante un curto período de tempo (<10 semanas); porén, é moi caro para ser práctico como terapia complementaria para a obesidade.[62]
Outros ácidos lipoicos
editar- Ácido β-lipoico ; é un tiosulfato do ácido α-lipoico.
Notas
editar- ↑ "Lipoic Acid". Pubmed. NCBI. Consultado o 18 de outubro de 2018.
- ↑ 2,00 2,01 2,02 2,03 2,04 2,05 2,06 2,07 2,08 2,09 2,10 2,11 2,12 2,13 2,14 2,15 2,16 2,17 2,18 2,19 2,20 2,21 2,22 "Lipoic acid". Micronutrient Information Center, Linus Pauling Institute, Oregon State University, Corvallis. 1 de xaneiro de 2019. Consultado o 5 de novembro de 2019.
- ↑ 3,0 3,1 3,2 3,3 3,4 Shay, KP; Moreau, RF; Smith, EJ; Hagen, TM (xuño de 2008). "Is alpha-lipoic acid a scavenger of reactive oxygen species in vivo? Evidence for its initiation of stress signaling pathways that promote endogenous antioxidant capacity". IUBMB Life 60 (6): 362–7. PMID 18409172. doi:10.1002/iub.40.
- ↑ Reljanovic, M; Reichel, G; Rett, K; Lobisch, M; et al. (setembro de 1999). "Treatment of diabetic polyneuropathy with the antioxidant thioctic acid (alpha-lipoic acid): A two year multicenter randomized double-blind placebo-controlled trial (ALADIN II). Alpha Lipoic Acid in Diabetic Neuropathy". Free Radical Research 31 (3): 171–9. PMID 10499773. doi:10.1080/10715769900300721.
- ↑ USP32-NF27. p. 1042.
- ↑ "Pharmacopeial Forum" 34 (5): 1209.
- ↑ Teichert, J; Hermann, R; Ruus, P; Preiss, R (novembro de 2003). "Plasma kinetics, metabolism, and urinary excretion of alpha-lipoic acid following oral administration in healthy volunteers". The Journal of Clinical Pharmacology 43 (11): 1257–67. PMID 14551180. doi:10.1177/0091270003258654.
- ↑ Cronan, John E. (2020). "Progress in the Enzymology of the Mitochondrial Diseases of Lipoic Acid Requiring Enzymes". Frontiers in Genetics 11: 510. PMC 7253636. PMID 32508887. doi:10.3389/fgene.2020.00510.
- ↑ Jiang, Y; Cronan, JE (2005). "Expression cloning and demonstration of Enterococcus faecalis lipoamidase (pyruvate dehydrogenase inactivase) as a Ser-Ser-Lys triad amidohydrolase". Journal of Biological Chemistry 280 (3): 2244–56. PMID 15528186. doi:10.1074/jbc.M408612200.
- ↑ Cronan, JE; Zhao, X; Jiang, Y (2005). Poole, RK, ed. Function, attachment and synthesis of lipoic acid in Escherichia coli. Advances in Microbial Physiology 50. pp. 103–46. ISBN 9780120277506. PMID 16221579. doi:10.1016/S0065-2911(05)50003-1.
- ↑ Zempleni, J.; Trusty, T. A.; Mock, D. M. (1997). "Lipoic acid reduces the activities of biotin-dependent carboxylases in rat liver". The Journal of Nutrition 127 (9): 1776–81. PMID 9278559. doi:10.1093/jn/127.9.1776.
- ↑ Chirapu, S. R.; Rotter, C. J.; Miller, E. L.; Varma, M. V.; Dow, R. L.; Finn, M. G. (2013). "High specificity in response of the sodium-dependent multivitamin transporter to derivatives of pantothenic acid". Current Topics in Medicinal Chemistry 13 (7): 837–42. PMID 23578027. doi:10.2174/1568026611313070006.
- ↑ Machado, RS; Clark, DP; Guest, JR (1992). "Construction and properties of pyruvate dehydrogenase complexes with up to nine lipoyl domains per lipoate acetyltransferase chain". FEMS Microbiology Letters 79 (1–3): 243–8. PMID 1478460. doi:10.1111/j.1574-6968.1992.tb14047.x.
- ↑ Douce, R; Bourguignon, J; Neuburger, M; Rebeille, F (2001). "The glycine decarboxylase system: A fascinating complex". Trends in Plant Science 6 (4): 167–76. PMID 11286922. doi:10.1016/S1360-1385(01)01892-1.
- ↑ Durrani, AI; Schwartz, H; Nagl, M; Sontag, G (outubro de 2010). "Determination of free [alpha]-lipoic acid in foodstuffs by HPLC coupled with CEAD and ESI-MS". Food Chemistry 120 (4): 38329–36. doi:10.1016/j.foodchem.2009.11.045.
- ↑ Reed, LJ (outubro de 2001). "A trail of research from lipoic acid to alpha-keto acid dehydrogenase complexes". Journal of Biological Chemistry 276 (42): 38329–36. PMID 11477096. doi:10.1074/jbc.R100026200.
- ↑ Hermann, R; Niebch, G; Borbe, HO; Fieger, H; et al. (1996). "Enantioselective pharmacokinetics and bioavailability of different racemic formulations in healthy volunteers". European Journal of Pharmaceutical Sciences 4 (3): 167–74. doi:10.1016/0928-0987(95)00045-3.
- ↑ Teichert, J; Preiss, R (1997). High-performance Liquid Chromatography Methods for Determination of Lipoic and Dihydrolipoic Acid in Human Plasma. Methods in Enzymology 279. pp. 159–66. ISBN 9780121821807. PMID 9211267. doi:10.1016/S0076-6879(97)79019-0.
- ↑ Teichert, J; Preiss, R (outubro de 1995). "Determination of lipoic acid in human plasma by high-performance liquid chromatography with electrochemical detection". Journal of Chromatography B 672 (2): 277–81. PMID 8581134. doi:10.1016/0378-4347(95)00225-8.
- ↑ Teichert, J; Preiss, R (novembro de 1992). "HPLC-methods for determination of lipoic acid and its reduced form in human plasma". International Journal of Clinical Pharmacology, Therapy, and Toxicology 30 (11): 511–2. PMID 1490813.
- ↑ Biewenga, GP; Haenen, GR; Bast, A (setembro de 1997). "The pharmacology of the antioxidant lipoic acid". General Pharmacology 29 (3): 315–31. PMID 9378235. doi:10.1016/S0306-3623(96)00474-0.
- ↑ 22,0 22,1 Schupke, H; Hempel, R; Peter, G; Hermann, R; et al. (xuño de 2001). "New metabolic pathways of alpha-lipoic acid". Drug Metabolism and Disposition 29 (6): 855–62. PMID 11353754.
- ↑ Teichert, J; Hermann, R; Ruus, P; Preiss, R (novembro de 2003). "Plasma kinetics, metabolism, and urinary excretion of alpha-lipoic acid following oral administration in healthy volunteers". Journal of Clinical Pharmacology 43 (11): 1257–67. PMID 14551180. doi:10.1177/0091270003258654.
- ↑ Hornberger, CS; Heitmiller, RF; Gunsalus, IC; Schnakenberg, GHF; et al. (1953). "Synthesis of DL—lipoic acid". Journal of the American Chemical Society 75 (6): 1273–7. doi:10.1021/ja01102a003.
- ↑ Hornberger, CS; Heitmiller, RF; Gunsalus, IC; Schnakenberg, GHF; et al. (1952). "Synthetic preparation of lipoic acid". Journal of the American Chemical Society 74 (9): 2382. doi:10.1021/ja01129a511.
- ↑ 26,0 26,1 Kleeman, A; Borbe, HO; Ulrich, H (1991). "Thioctic Acid-Lipoic Acid". En Borbe, HO; Ulrich, H. Thioctsäure: Neue Biochemische, Pharmakologische und Klinische Erkenntnisse zur Thioctsäure [Thioctic Acid. New Biochemistry, Pharmacology and Findings from Clinical Practice with Thioctic Acid]. Symposium at Wiesbaden, DE, 16–18 febreiro de 1989. Frankfurt, DE: Verlag. pp. 11–26. ISBN 9783891191255.
- ↑ Fontanella, L (1955). "Preparation of optical antipodes of alpha-lipoic acid". Il Farmaco; Edizione Scientifica 10 (12): 1043–5. PMID 13294188.
- ↑ Walton, E; Wagner, AF; Bachelor, FW; Peterson, LH; et al. (1955). "Synthesis of (+)-lipoic acid and its optical antipode". Journal of the American Chemical Society 77 (19): 5144–9. doi:10.1021/ja01624a057.
- ↑ Acker, DS; Wayne, WJ (1957). "Optically active and radioactive α-lipoic acids". Journal of the American Chemical Society 79 (24): 6483–6487. doi:10.1021/ja01581a033.
- ↑ Deguchi, Y; Miura, K (xuño de 1964). "Studies on the synthesis of thioctic acid and its related compounds. XIV. Synthesis of (+)-thioctamide". Yakugaku Zasshi 84 (6): 562–3. PMID 14207116. doi:10.1248/yakushi1947.84.6_562.
- ↑ Lang, G (1992). In Vitro Metabolism of a-Lipoic Acid Especially Taking Enantioselective Bio-transformation into Account (Tese). Münster, DE: University of Münster.
- ↑ US patent 5281722], Blaschke, G; Scheidmantel, U & Bethge, H et al., "Preparation and use of salts of the pure enantiomers of alpha-lipoic acid", expedida o 1994-01-25, asignada a DeGussa.
- ↑ 33,0 33,1 Carlson, DA; Young, KL; Fischer, SJ; Ulrich, H. "Ch. 10: An Evaluation of the Stability and Pharmacokinetics of R-lipoic Acid and R-Dihydrolipoic Acid Dosage Forms in Plasma from Healthy Human Subjects". Lipoic Acid: Energy Production, Antioxidant Activity and Health Effects. pp. 235–70. En Packer & Patel 2008.
- ↑ Packer, L; Kraemer, K; Rimbach, G (outubro de 2001). "Molecular aspects of lipoic acid in the prevention of diabetes complications". Nutrition 17 (10): 888–95. PMID 11684397. doi:10.1016/S0899-9007(01)00658-X.
- ↑ 35,0 35,1 35,2 Carlson, DA; Smith, AR; Fischer, SJ; Young, KL; et al. (decembro de 2007). "The plasma pharmacokinetics of R-(+)-lipoic acid administered as sodium R-(+)-lipoate to healthy human subjects" (PDF). Alternative Medicine Review 12 (4): 343–51. PMID 18069903. Arquivado dende o orixinal (PDF) o 08 de agosto de 2017. Consultado o 30 de xullo de 2022. Arquivado 08 de agosto de 2017 en Wayback Machine.
- ↑ Hill, AS; Werner, JA; Rogers, QR; O'Neill, SL; et al. (abril de 2004). "Lipoic acid is 10 times more toxic in cats than reported in humans, dogs or rats". Journal of Animal Physiology and Animal Nutrition 88 (3–4): 150–6. PMID 15059240. doi:10.1111/j.1439-0396.2003.00472.x.
- ↑ Packer, L; Witt, EH; Tritschler, HJ (agosto de 1995). "Alpha-lipoic acid as a biological antioxidant". Free Radical Biology and Medicine 19 (2): 227–50. PMID 7649494. doi:10.1016/0891-5849(95)00017-R.
- ↑ 38,0 38,1 Shay, KP; Moreau, RF; Smith, EJ; Smith, AR; et al. (outubro de 2009). "Alpha-lipoic acid as a dietary supplement: Molecular mechanisms and therapeutic potential". Biochimica et Biophysica Acta (BBA) - General Subjects 1790 (10): 1149–60. PMC 2756298. PMID 19664690. doi:10.1016/j.bbagen.2009.07.026.
- ↑ Haenen, GRMM; Bast, A (1991). "Scavenging of hypochlorous acid by lipoic acid". Biochemical Pharmacology 42 (11): 2244–6. PMID 1659823. doi:10.1016/0006-2952(91)90363-A.
- ↑ 40,0 40,1 Shay, KP; Shenvi, S; Hagen, TM. "Ch. 14 Lipoic Acid as an Inducer of Phase II Detoxification Enzymes Through Activation of Nr-f2 Dependent Gene Expression". Lipoic Acid: Energy Production, Antioxidant Activity and Health Effects. pp. 349–71. In Packer & Patel 2008.
- ↑ Arnér, ES; Nordberg, J; Holmgren, A (agosto de 1996). "Efficient reduction of lipoamide and lipoic acid by mammalian thioredoxin reductase". Biochemical and Biophysical Research Communications 225 (1): 268–74. PMID 8769129. doi:10.1006/bbrc.1996.1165.
- ↑ Biaglow, JE; Ayene, IS; Koch, CJ; Donahue, J; et al. (abril de 2003). "Radiation response of cells during altered protein thiol redox". Radiation Research 159 (4): 484–94. Bibcode:2003RadR..159..484B. PMID 12643793. doi:10.1667/0033-7587(2003)159[0484:RROCDA]2.0.CO;2.
- ↑ Haramaki, N; Han, D; Handelman, GJ; Tritschler, HJ; et al. (1997). "Cytosolic and mitochondrial systems for NADH- and NADPH-dependent reduction of alpha-lipoic acid". Free Radical Biology and Medicine 22 (3): 535–42. PMID 8981046. doi:10.1016/S0891-5849(96)00400-5.
- ↑ Constantinescu, A; Pick, U; Handelman, GJ; Haramaki, N; et al. (xullo de 1995). "Reduction and transport of lipoic acid by human erythrocytes". Biochemical Pharmacology 50 (2): 253–61. PMID 7632170. doi:10.1016/0006-2952(95)00084-D.
- ↑ May, JM; Qu, ZC; Nelson, DJ (xuño de 2006). "Cellular disulfide-reducing capacity: An integrated measure of cell redox capacity". Biochemical and Biophysical Research Communications 344 (4): 1352–9. PMID 16650819. doi:10.1016/j.bbrc.2006.04.065.
- ↑ Jones, W; Li, X; Qu, ZC; Perriott, L; et al. (xullo de 2002). "Uptake, recycling, and antioxidant actions of alpha-lipoic acid in endothelial cells". Free Radical Biology and Medicine 33 (1): 83–93. PMID 12086686. doi:10.1016/S0891-5849(02)00862-6.
- ↑ Schempp, H; Ulrich, H; Elstner, EF (1994). "Stereospecific reduction of R(+)-thioctic acid by porcine heart lipoamide dehydrogenase/diaphorase". Zeitschrift für Naturforschung C 49 (9–10): 691–2. PMID 7945680. doi:10.1515/znc-1994-9-1023.
- ↑ Biewenga, GP; Haenen, GRMM; Bast, A (1997). "Ch. 1: An Overview of Lipoate Chemistry". En Fuchs, J; Packer, L; Zimmer, G. Lipoic Acid In Health & Disease. CRC Press. pp. 1–32. ISBN 9780824700935.
- ↑ Lii, CK; Liu, KL; Cheng, YP; Lin, AH; et al. (maio de 2010). "Sulforaphane and alpha-lipoic acid upregulate the expression of the pi class of glutathione S-transferase through c-jun and Nrf2 activation". Journal of Nutrition 140 (5): 885–92. PMID 20237067. doi:10.3945/jn.110.121418.
- ↑ Gal, EM; Razevska, DE (agosto de 1960). "Studies on the in vivo metabolism of lipoic acid. 1. The fate of DL-lipoic acid-S35 in normal and thiamine-deficient rats". Archives of Biochemistry and Biophysics 89 (2): 253–61. PMID 13825981. doi:10.1016/0003-9861(60)90051-5.
- ↑ Gal, EM (xullo de 1965). "Reversal of selective toxicity of (-)-alpha-lipoic acid by thiamine in thiamine-deficient rats". Nature 207 (996): 535. Bibcode:1965Natur.207..535G. PMID 5328673. doi:10.1038/207535a0.
- ↑ US patent 6271254, Ulrich, H; Weischer, CH & Engel, J et al., "Pharmaceutical compositions containing R-alpha-lipoic acid or S-alpha.-lipoic acid as active ingredient", issued 2001-08-07, assigned to ASTA Pharma.
- ↑ Kilic, F; Handelman, GJ; Serbinova, E; Packer, L; et al. (outubro de 1995). "Modelling cortical cataractogenesis 17: In vitro effect of a-lipoic acid on glucose-induced lens membrane damage, a model of diabetic cataractogenesis". Biochemistry and Molecular Biology International 37 (2): 361–70. PMID 8673020.
- ↑ Artwohl, M; Schmetterer, L; Rainer, G; et al. (setembro de 2000). Modulation by antioxidants of endothelial apoptosis, proliferation, & associated gene/protein expression. 36th Annual Meeting of the European Association for the Study of Diabetes, 17–21 de setembro de 2000, Jerusalem, Israel. Diabetologia 43 (Suppl 1) (agosto de 2000). Abs 274. PMID 11008622.
- ↑ Streeper, RS; Henriksen, EJ; Jacob, S; Hokama, JY; et al. (xullo de 1997). "Differential effects of lipoic acid stereoisomers on glucose metabolism in insulin-resistant skeletal muscle". AJP: Endocrinology and Metabolism 273 (1 Pt 1): E185–91. PMID 9252495. doi:10.1152/ajpendo.1997.273.1.E185.
- ↑ Frölich, L; Götz, ME; Weinmüller, M; Youdim, MB; et al. (marzo de 2004). "(r)-, but not (s)-alpha lipoic acid stimulates deficient brain pyruvate dehydrogenase complex in vascular dementia, but not in Alzheimer dementia". Journal of Neural Transmission 111 (3): 295–310. PMID 14991456. doi:10.1007/s00702-003-0043-5.
- ↑ McIlduff, Courtney E; Rutkove, Seward B (2011-01-01). "Critical appraisal of the use of alpha lipoic acid (thioctic acid) in the treatment of symptomatic diabetic polyneuropathy". Therapeutics and Clinical Risk Management 7: 377–385. ISSN 1176-6336. PMC 3176171. PMID 21941444. doi:10.2147/TCRM.S11325.
- ↑ Ziegle, D.; Reljanovic, M; Mehnert, H; Gries, F. A. (1999). "α-Lipoic acid in the treatment of diabetic polyneuropathy in Germany". Experimental and Clinical Endocrinology & Diabetes 107 (7): 421–30. PMID 10595592. doi:10.1055/s-0029-1212132.
- ↑ "Lipoic Acid". American Cancer Society. novembro de 2008. Arquivado dende o orixinal o 24 de abril de 2015. Consultado o 5 de outubro de 2013.
- ↑ Javed, S; Petropoulos, IN; Alam, U; Malik, RA (xaneiro de 2015). "Treatment of painful diabetic neuropathy.". Therapeutic Advances in Chronic Disease 6 (1): 15–28. PMC 4269610. PMID 25553239. doi:10.1177/2040622314552071.
- ↑ Pfeffer G, Majamaa K, Turnbull DM, Thorburn D, Chinnery PF (abril de 2012). "Treatment for mitochondrial disorders". Cochrane Database Syst Rev (4): CD004426. PMC 7201312. PMID 22513923. doi:10.1002/14651858.CD004426.pub3.
- ↑ Namazi, Nazli; Larijani, Bagher; Azadbakht, Leila (2018). "Alpha-lipoic acid supplement in obesity treatment: A systematic review and meta-analysis of clinical trials". Clinical Nutrition 37 (2): 419–428. ISSN 0261-5614. PMID 28629898. doi:10.1016/j.clnu.2017.06.002.
Véxase tamén
editarLigazóns externas
editar| Wikimedia Commons ten máis contidos multimedia na categoría: Ácido lipoico |