Lipocalina
As lipocalinas constitúen unha familia de proteínas que transportan moléculas hidrófobas pequenas como os esteroides, bilinas, retinoides, así como lípidos, e a maioría das lipocalinas poden unirse ao ferro en complexos (por medio de sideróforos[2] ou flavonoides[3]) e ao hemo.[4] As lipocalinas comparten o feito de ter rexións limitadas con homoloxía de secuencias e unha arquitectura da estrutura terciaria común.[5][6][7][8][9] Esta é un barril beta antiparalelo de oito febras cunha topoloxía + 1 repetida que encerra un sitio de unión a ligando interno.[7][8]
 | |||||||||
| Identificadores | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| Símbolo | Lipocalina | ||||||||
| Pfam | PF00061 | ||||||||
| Pfam clan | CL0116 | ||||||||
| InterPro | IPR000566 | ||||||||
| PROSITE | PDOC00187 | ||||||||
| SCOPe | 1hms / SUPFAM | ||||||||
| OPM superfamily | 50 | ||||||||
| OPM protein | 1kt6 | ||||||||
| |||||||||
| Lipocalina | |||||||||
|---|---|---|---|---|---|---|---|---|---|
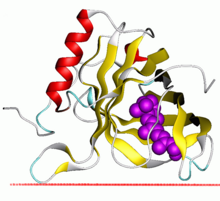
 Estrutura da lipocalina de Escherichia coli.[1] | |||||||||
| Identificadores | |||||||||
| Símbolo | Lipocalina_2 | ||||||||
| Pfam | PF08212 | ||||||||
| Pfam clan | CL0116 | ||||||||
| InterPro | IPR013208 | ||||||||
| |||||||||
Estas proteínas encóntranse en bacterias gramnegativas, células de vertebrados e de invertebrados e en plantas. As lipocalinas foron asociadas con moitos procesos biolóxicos, entre eles a resposta inmunitaria, o transporte de feromonas, a síntese biolóxica de prostaglandinas, a unión de retinoides e as interaccións das células cancerosas.
Función
editarResposta inmunitaria
editarAs proteínas lipocalinas están implicadas en procesos de inflamación e detoxificación causados pola activación do sistema inmunitario en mamíferos. Son alérxenos respiratorios para ratos, gatos, cabalos e outros animais. Exemplos de proteínas lipocalinas implicadas nas respostas do sistema inmunitario son a alfa-1-microglobulina, a orosomucoide (ou glicoproteína alfa-1-ácida) e a C8gamma. Disponse de información estrutural de moitas lipocalinas que inflúen en sistemas inmunitarios, pero o seu papel exacto nos sistemas biolóxicos aínda non está de todo claro. Os alérxenos de tipo lipocalina provocan unha resposta inmune desviada de células Th2, importante para a sensibilización alérxica, cando se aplican na súa forma apo (cun cálice baleiro desprovisto de ligandos), mentres que a forma holo parece ter propiedades inmunosupresoras in vitro.[10]
Transporte de feromonas
editarA familia das lipocalinas foi vinculada co transporte de feromonas de mamíferos debido ás interaccións facilmente observables proteína-feromona. As lipocalinas son comparativamene pequenas en tamaño e así é menos complicado estudalas. Poden unirse tamén a varios ligandos con diferentes propósitos. Foron detectadas como proteínas transportadores de importantes feromonas no moco nasal de roedores. As proteínas urinarias maiores, unha subfamilia de lipocalinas, encóntranse na urina de ratos e ratas e elas mesmas poden actuar como feromonas proteicas.[11]
Síntese de prostaglandinas
editar- Artigo principal: Prostaglandina.
Est familia de proteínas desempeña un papel na síntese biolóxica de prostaglandinas.
Unión do retinoide
editarO retinol, (vitamina A), é un importante micronutriente que afecta a vista, diferenciación celular, funcionamento do sistema inmunitario, crecemento óseo e supresión de tumores. A absorción e metabolismo do retinol depende de lipocalinas que actúan como proteínas de unión. Os retinil ésteres (presentes na carne) e os beta-carotenos (presentes en plantas) son as dúas fontes principais de retinoides da dieta. Despois da súa inxestión, son convertidos en retinol, son metabolizados sucesivamente, e finalmente unidos a proteínas de unión ao retinol (lipocalinas) no plasma sanguíneo.
Interaccións en células cancerosas
editarComo as lipocalinas son proteínas extracelulares, os seus efectos intracelulares non son obvios e necesítanse maiores estudos. Porén, os ligandos lipófilos, presentes como substituíntes das lipocalinas, teñen a capacidade de entrar na célula, onde poden actuar como inhibidores das proteases dos tumores. Esta investigación suxire outra posible ruta nas investigacións proteína-tumor.
Alérxenos
editarAlgunhas das proteínas desta familia son alérxenos. As alerxias son reaccións de hipersensibilidade do sistema inmunitario a substancias específicas chamadas alérxenos (como o pole, veleno de picadas, drogas ou alimentos) que, na maioría das persoas, non producen síntomas. Estableceuse un sistema de nomenclatura para os antíxenos (alérxenos) que causan alerxias atópicas mediadas por IgE en humanos.[12] Este sistema de nomenclatura é unha designación composta das tres primeiras letras do xénero, un espazo, a primeira letra do nome da especie, un espazo e un número arábigo. No caso de que dous nomes de especies teñan designacións idénticas, son diferenciadas engadindo unha letra ou máis á designación de cada unha das especies.
Os alérxenos nesta familia inclúen alérxenos coas seguintes designacións: Bla g 4, Bos d 2, Bos d 5, Can f 1, Can f 2, Fel d 4, Equ c 1, e Equ c 2.
Hormona
editarA LCN2 (Lipocalina 2) actúa como unha hormona derivada do óso que pode cruzar a barreira hematoencefálica e actúa sobre o núcleo paraventricular do hipotálamo do cerebro.
Estrutura
editarAínda que as lipocalinas son unha ampla familia de proteínas moi variadas, as súas estruturas tridimensionais son unha característica que as unifica. As lipocalinas teñen un pregamento de barril β de oito febras antiparalelas e simétricas, que é, en esencia, unha folla beta que se enrolou orixinando unha forma cilíndrica. Dentro deste barril localízase un sitio de unión a ligando, que xoga un importante papel na clasificación das lipocalinas como proteínas de transporte. Se as lipocalinas son alteradas por enxeñaría xenética intentando modificar as súas propiedades de unión, denomínanse anticalinas.
Membros da familia
editarO nome "lipocalina" foi o proposto[5] para esta familia proteica, mais as proteínas que se unen a ácidos graxos citosólicas tamén están incluídas nela. As secuencias da maioría dos membros da familia, as lipocalinas centrais que forman o núcleo da familia, caracterízanse por ter tres tramos curtos conservados, mentres que outras, o grupo das lipocalinas adicionais, comparten só un ou dous deles.[8][13] Proteínas que pertencen a esta familia inclúen a alfa-1-microglobulina (proteína HC); proteínas urinarias maiores; a glicoproteína alfa-1-ácida (orosomucoide);[14] a afrodisina; a apolipoproteína D; a beta-lactoglobulina; a cadea gamma do compoñente C8 do complemento;[15] a crustacianina;[16] a proteína de unión ao ácido retinoico epididimal (E-RABP);[17] a insectacianina; a proteína de unión odorante (OBP); a alfa-2 globulina asociada o embarazo humana (PAEP); a probasina (PB), unha proteína prostática; a prostaglandina D sintase;[18] a purpurina; a proteína da glándula de Von Ebner (VEGP);[19] e a proteína IV secretoria epididimal de lagarto (LESP IV).[20]
Entre as proteínas humanas que conteñen o dominio de lipocalina están:
Notas
editar- ↑ Campanacci V, Nurizzo D, Spinelli S, Valencia C, Tegoni M, Cambillau C (marzo de 2004). "The crystal structure of the Escherichia coli lipocalin Blc suggests a possible role in phospholipid binding". FEBS Letters 562 (1-3): 183–188. PMID 15044022. doi:10.1016/S0014-5793(04)00199-1.
- ↑ Goetz DH, Holmes MA, Borregaard N, Bluhm ME, Raymond KN, Strong RK (novembro de 2002). "The neutrophil lipocalin NGAL is a bacteriostatic agent that interferes with siderophore-mediated iron acquisition". Molecular Cell 10 (5): 1033–1043. PMID 12453412. doi:10.1016/s1097-2765(02)00708-6.
- ↑ Roth-Walter F, Pacios LF, Bianchini R, Jensen-Jarolim E (decembro de 2017). "Linking iron-deficiency with allergy: role of molecular allergens and the microbiome". Metallomics 9 (12): 1676–1692. PMID 29120476. doi:10.1039/c7mt00241f.
- ↑ Matz JM, Drepper B, Blum TB, van Genderen E, Burrell A, Martin P, et al. (xullo de 2020). "A lipocalin mediates unidirectional heme biomineralization in malaria parasites". Proceedings of the National Academy of Sciences of the United States of America 117 (28): 16546–16556. PMC 7368307. PMID 32601225. doi:10.1073/pnas.2001153117.
- ↑ 5,0 5,1 Pervaiz S, Brew K (setembro de 1987). "Homology and structure-function correlations between alpha 1-acid glycoprotein and serum retinol-binding protein and its relatives". FASEB Journal 1 (3): 209–214. PMID 3622999. doi:10.1096/fasebj.1.3.3622999.
- ↑ Igarashi M, Nagata A, Toh H, Urade Y, Hayaishi O (xuño de 1992). "Structural organization of the gene for prostaglandin D synthase in the rat brain". Proceedings of the National Academy of Sciences of the United States of America 89 (12): 5376–5380. Bibcode:1992PNAS...89.5376I. PMC 49294. PMID 1608945. doi:10.1073/pnas.89.12.5376.
- ↑ 7,0 7,1 Cowan SW, Newcomer ME, Jones TA (1990). "Crystallographic refinement of human serum retinol binding protein at 2A resolution". Proteins 8 (1): 44–61. PMID 2217163. doi:10.1002/prot.340080108.
- ↑ 8,0 8,1 8,2 Flower DR, North AC, Attwood TK (maio de 1993). "Structure and sequence relationships in the lipocalins and related proteins". Protein Science 2 (5): 753–761. PMC 2142497. PMID 7684291. doi:10.1002/pro.5560020507.
- ↑ Godovac-Zimmermann J (febreiro de 1988). "The structural motif of beta-lactoglobulin and retinol-binding protein: a basic framework for binding and transport of small hydrophobic molecules?". Trends in Biochemical Sciences 13 (2): 64–66. PMID 3238752. doi:10.1016/0968-0004(88)90031-X.
- ↑ Roth-Walter F, Pacios LF, Gomez-Casado C, Hofstetter G, Roth GA, Singer J, et al. (agosto de 2014). "The major cow milk allergen Bos d 5 manipulates T-helper cells depending on its load with siderophore-bound iron". PLOS ONE 9 (8): e104803. Bibcode:2014PLoSO...9j4803R. PMC 4130594. PMID 25117976. doi:10.1371/journal.pone.0104803.
- ↑ Chamero P, Marton TF, Logan DW, Flanagan K, Cruz JR, Saghatelian A, et al. (decembro de 2007). "Identification of protein pheromones that promote aggressive behaviour". Nature 450 (7171): 899–902. Bibcode:2007Natur.450..899C. PMID 18064011. doi:10.1038/nature05997. Resumo divulgativo – BBC News.
- ↑ [WHO/IUIS Allergen Nomenclature Subcommittee King T.P., Hoffmann D., Loewenstein H., Marsh D.G., Platts-Mills T.A.E., Thomas W. Bull. World Health Organ. 72:797-806(1994)]
- ↑ Flower DR, North AC, Attwood TK (outubro de 1991). "Mouse oncogene protein 24p3 is a member of the lipocalin protein family". Biochemical and Biophysical Research Communications 180 (1): 69–74. PMID 1834059. doi:10.1016/S0006-291X(05)81256-2.
- ↑ Kremer JM, Wilting J, Janssen LH (marzo de 1988). "Drug binding to human alpha-1-acid glycoprotein in health and disease". Pharmacological Reviews 40 (1): 1–47. PMID 3064105.
- ↑ Haefliger JA, Peitsch MC, Jenne DE, Tschopp J (1991). "Structural and functional characterization of complement C8 gamma, a member of the lipocalin protein family". Molecular Immunology 28 (1-2): 123–131. PMID 1707134. doi:10.1016/0161-5890(91)90095-2.
- ↑ Keen JN, Caceres I, Eliopoulos EE, Zagalsky PF, Findlay JB (abril de 1991). "Complete sequence and model for the A2 subunit of the carotenoid pigment complex, crustacyanin". European Journal of Biochemistry 197 (2): 407–417. PMID 2026162. doi:10.1111/j.1432-1033.1991.tb15925.x.
- ↑ Newcomer ME (setembro de 1993). "Structure of the epididymal retinoic acid binding protein at 2.1 A resolution". Structure 1 (1): 7–18. PMID 8069623. doi:10.1016/0969-2126(93)90004-Z.
- ↑ Peitsch MC, Boguski MS (outubro de 1991). "The first lipocalin with enzymatic activity". Trends in Biochemical Sciences 16 (10): 363. PMID 1723819. doi:10.1016/0968-0004(91)90149-P.
- ↑ Kock K, Ahlers C, Schmale H (maio de 1994). "Structural organization of the genes for rat von Ebner's gland proteins 1 and 2 reveals their close relationship to lipocalins". European Journal of Biochemistry 221 (3): 905–916. PMID 7514123. doi:10.1111/j.1432-1033.1994.tb18806.x.
- ↑ Morel L, Dufaure JP, Depeiges A (maio de 1993). "LESP, an androgen-regulated lizard epididymal secretory protein family identified as a new member of the lipocalin superfamily". The Journal of Biological Chemistry 268 (14): 10274–10281. PMID 8486691. doi:10.1016/S0021-9258(18)82200-1.
Véxase tamén
editarBibliografía
editar- Paine K, Flower DR (outubro de 2000). "The lipocalin website". Biochimica et Biophysica Acta 1482 (1-2): 351–352. PMID 11058775. doi:10.1016/S0167-4838(00)00166-7.
- Virtanen T, Zeiler T, Mäntyjärvi R (decembro de 1999). "Important animal allergens are lipocalin proteins: why are they allergenic?". International Archives of Allergy and Immunology 120 (4): 247–258. PMID 10640908. doi:10.1159/000024277.
- Bratt T (outubro de 2000). "Lipocalins and cancer". Biochimica et Biophysica Acta 1482 (1-2): 318–326. PMID 11058772. doi:10.1016/S0167-4838(00)00154-0.
- Charron JB, Ouellet F, Pelletier M, Danyluk J, Chauve C, Sarhan F (decembro de 2005). "Identification, expression, and evolutionary analyses of plant lipocalins". Plant Physiology 139 (4): 2017–2028. PMC 1310578. PMID 16306142. doi:10.1104/pp.105.070466.
- Novotny MV (febreiro de 2003). "Pheromones, binding proteins and receptor responses in rodents". Biochemical Society Transactions 31 (Pt 1): 117–122. PMID 12546667. doi:10.1042/BST0310117.
Ligazóns externas
editar- Lipocalinas na base de datos SCOP Arquivado 03 de marzo de 2016 en Wayback Machine.
Este artigo incorpora textos en dominio público procedentes de Pfam e InterPro IPR000566