Beta-lactoglobulina
A β-lactoglobulina é unha proteína do leite de moitos mamíferos e é a principal proteína no soro lácteo de vaca e ovella (~3 g/L), coa notable excepción do leite humano, que non a contén. A súa estrutura, propiedades e funcións biolóxicas foron revisadas varias veces, xa que non se coñecen ben.[1][2][3]
Estrutura e función
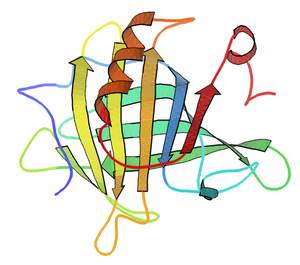
editarA diferenza da outra proteína importante do soro lácteo, a alfa-lactoalbumina, non se identificou claramente a función da β-lactoglobulina, aínda que se sabe que se une a moléculas hidrofóbicas, o que suxire que xoga un papel no seu transporte. A idea máis común é que esta molécula funciona principalmente como unha fonte de alimento proteica para o animal lactante. Identificáronse varias variantes xenéticas, as principais no leite de vaca son as denominadas A e B. Debido á súa abundancia e facilidade de purificación, fixéronse con ela numerosos estudos biofísicos. A súa estrutura foi determinada varias veces por cristalografía de raios X e resonancia magnética nuclear (RMN). Unha desas estruturas é a que se mostra na imaxe (procedente de PDB 3BLG). A β-lactoglobulina ten un grande interese para a industria alimenticia, xa que as súas propiedades poden ser vantaxosas ou desvantaxosas nos produtos lácteos e no seu procesamento.[4]
A β-lactoglobulina bovina é unha proteína relativamente pequena de 162 aminoácidos, cun peso molecular de 18,4 kDa. En condicións fisiolóxicas é predominantemente dimérica, pero disóciase en monómeros por debaixo do pH 3. Non obstante, o seu estado nativo permanece case intacto a pH máis baixos, como se determinou utilizando RMN.[5] A beta-lactoglobulina A bovina ten un grupo tiol libre no residuo de cisteína 121 agochado na estrutura da proteína entre o barril beta e a hélice alfa do extremo C-terminal.[6]
As solucións de β-lactoglobulina forman xeles en varias condicións, cando a estrutura nativa se desestabiliza o suficiente como para permitir a agregación.[7] Cun quentamento prolongado a pH baixo e forza iónica baixa, fórmase un xel transparente de "febras finas", no cal as moléculas de proteína se ensamblan en longas fibras ríxidas.
Os intermediarios de pregamento desta proteína poden estudarse utilizando espectroscopia de luz e desnaturalización. Tales experimentos mostran a formación dun infrecuente pero importante intermediario composto soamente de hélices alfa, a pesar de que a súa estrutura nativa é fundamentalmente de tipo folla beta. A evolución probablemente seleccionou o intermediario helicoidal para evitar a agregación durante o proceso de pregamento.[8]
Como é un compoñente do leite que é un alérxeno coñecido na Unión Europea está incluída no Anexo IIIa da Directiva 2000/13/EC, e os produtores deben probar a presenza ou ausencia de β-lactoglobulina para asegurar que o seu etiquetado satisfai as esixencias de dita directiva. Os laboratorios que analizan o leite poden utilizar a técnica ELISA (enzyme linked immunosorbent assay, ensaio de inmunoabsorbencia de encima unido) para identificar e cuantificar a β-lactoglobulina nos produtos alimenticios.
A polimerización no laboratorio da β-lactoglobulina por transglutaminases microbianas reduce a súa alerxenicidade en nenos e adultos que teñen alerxia ao leite mediada por IgE.[9]
Notas
editar- ↑ Hambling, S. G., A. S. McAlpine, and L. Sawyer. 1992. Advanced Dairy Chemistry: 1. Proteins, chapter: Beta-lactoglobulin. Elsevier Applied Science, 141–190.
- ↑ Sawyer, L., and G. Kontopidis. 2000. The core lipocalin, bovine beta-lactoglobulin. Biochim Biophys Acta 1482:136–48.
- ↑ Kontopidis, G., C. Holt, and L. Sawyer. 2004. Invited review: beta-lactoglobulin: binding properties, structure, and function. J Dairy Sci 87:785–96.
- ↑ Jost, R. 1993. Functional characteristics of dairy proteins. Trends in Food Science & Technology 4:283–288.
- ↑ Uhrinova, S., M. H. Smith, G. B. Jameson, D. Uhrin, L. Sawyer, and P. N. Barlow. 2000. Structural changes accompanying ph-induced dissociation of the beta-lactoglobulin dimer. Biochemistry 39:3565–74.
- ↑ Sakai K, Sakurai K, Sakai M, Hoshino M, Goto Y. Conformation and stability of thiol-modified bovine beta-lactoglobulin. Protein Sci. 2000 Sep;9(9):1719-29. PMID 11045618.
- ↑ Bromley, E. H. C., M. R. H. Krebs, and A. M. Donald. 2005. Aggregation across the length scales in beta-lactoglobulin. Faraday Discussions. 128:13–27.
- ↑ Kuwajima K., Yamaya H. & Sugai S. 1996. The Burst-phase Intermediate in the Refolding of beta-Lactoglobulin Studied by Stopped-flow Circular Dichroism and Absorption Spectroscopy. Journal of Molecular Biology, 264:806-822.
- ↑ Olivier CE, Lima RP, Pinto DG, Santos RA, Silva GK, Lorena SL, Villas-Boas MB, Netto FM, Zollner Rde L: In search of a tolerance-induction strategy for cow's milk allergies: significant reduction of beta-lactoglobulin allergenicity via transglutaminase/cysteine polymerization. Clinics (Sao Paulo) 2012, 67(10):1171-1179.PDF