Inmunoglobulina E
A inmunoglobulina E (IgE) é un tipo de anticorpo (ou isotipo de inmunoglobulina) que se encontra só en mamíferos. A IgE existe en forma de monómero formado por dúas cadeas pesadas ε e dúas lixeiras; a cadea pesada ε contén catro dominios constantes de tipo inmunoglobulina (Cε1-Cε4).[1] A principal función da IgE é intervir na inmunidade ante parasitos como poden ser os vermes parasitos[2] como Schistosoma mansoni, Trichinella spiralis, e Fasciola hepatica.[3][4][5] A IgE pode tamén ser importante durante a defensa inmune contra certos protozoos parasitos como o Plasmodium falciparum da malaria.[6]
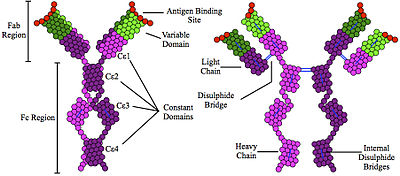


A IgE tamén xoga un papel esencial na hipersensibilidade de tipo I,[7] a cal orixina varias doenzas alérxicas, como a asma alérxica, rinite alérxica, alerxias alimentarias, e algúns tipos de urticaria crónica e dermatite atópica. A IgE tamén xoga un papel central noutras condicións alérxicas como as reaccións anafilácticas a certas drogas, picadas das abellas, e preparacións de antíxenos usadas en inmunoterapia de desensibilización.
A IgE é normalmente o isotipo menos abundante de inmunoglobulina, xa que os seus niveis no soro sanguíneo nun individuo normal ("non-atópico") son só do 0,05% da concentración de Ig,[8] comparado cos 10 mg/ml das IgGs (o isotipo responsable da maioría das respostas inmunitarias adaptativas clásicas). Pero malia súa baixa concentración, a IgE pode desencadear as reaccións inflamatorias máis potentes.
A IgE descubriuna en 1966 a parella de científicos xaponeses Teruko e Kimishige Ishizaka.[9]
Receptores
editarA IgE prepara a resposta alérxica mediada por IgE ao unirse aos receptores Fc que se encontran na superficie dos mastocitos e basófilos. Os receptores Fc tamén se encontran en eosinófilos, monocitos, macrófagos e plaquetas nos humanos. Hai dous tipos de receptores Fcε:
- FcεRI (tipo I de receptor Fcε), o receptor IgE de alta afinidade.
- FcεRII (tipo II de receptor Fcε), tamén chamado CD23, o receptor IgE de baixa afinidade.
A IgE pode regular á alza a expresión de ambos os tipos de receptores Fcε. O FcεRI exprésase nos mastocitos, basófilos, e nas células dendríticas presentadoras de antíxenos tanto en ratos coma en humanos. A unión dos antíxenos a IgEs que xa estaban unidas previamente ao FcεRI nos mastocitos causa que se formen enlaces cruzados entre as IgE unidas e a agregación do FcεRI subxacente, o que dará lugar á desgranulación e liberación de mediadores almacenados nesas células. Os basófilos, ao producirse a unión dos antíxenos ás IgE da súa superficie, liberan citocinas de tipo 2 como a interleucina-4 (IL-4) e a interleucina-13 (IL-13) e outros mediadores inflamatorios. O receptor de baixa afinidade (FcεRII) exprésase sempre nas células B, pero a súa expresión pode ser inducida nas superficies dos macrófagos, eosinófilos, plaquetas, e algunhas células T pola IL-4.[10][11]
Fisioloxía
editarHai moita especulación sobre os beneficios fisiolóxicos aos que contribúe a IgE, e, ata agora, a evidencia circunstancial en modelos animais e as tendencias estatísticas na poboación humana dan a entender que a IgE pode ser beneficiosa na loita contra os parasitos intestinais como o verme platihelminto Schistosoma mansoni, pero isto non foi probado concluintemente en humanos.
Aínda que non se comprende aínda ben, a IgE pode xogar un importante papel no recoñecemento polo sistema inmunitario do cancro,[12] no cal sería beneficiosa a estimulación de fortes respostas citotóxicas contra as células que mostran só pequenas cantidades de marcadores do cancro temperáns. Se isto se comprobase que é así, os tratamentos anti-IgE como omalizumab (para a asma) poderían ter efectos secundarios indesexados. Porén, un estudo recente, que foi realizado baseándose nunha análise combinada utilizando datos exhaustivos de 67 ensaios clínicos do omalizumab en fases I a IV en varias indicacións, concluíron que é improbable unha relación causal entre a terapia con omalizumab e a malignidade tumoral.[13]
Papel en enfermidades
editarOs individuos atópicos poden ter ata 10 veces o nivel normal de IgE no seu sangue (como ocorre en pacientes de síndrome hiper-IgE). Porén, isto pode non ser un requirimento para que aparezan os síntomas como se viu en asmáticos con niveis normais de IgE no seu sangue, e investigacións recentes indicaron que pode haber produción local de IgE na mucosa nasal.[14]
As IgEs que poden recoñecer especificamente un "alérxeno" (normalmente unha proteína, como a DerP1 do ácaro do po, a Fel d 1 do gato, ou da herba, pole etc.) teñen unha interacción de longa duración co seu receptor de alta afinidade FcεRI. Isto fai que os basófilos e mastocitos, con capacidade de mediar nas reaccións inflamatorias, sexan "cebados", e queden preparados para liberar substancias químicas como a histamina, leucotrienos, e certas interleucinas. Estes produtos causan moitos dos síntomas asociados coas alerxias, como a constrición das vías aéreas na asma, inflamación local no eccema, incremento da secreción de mucus na rinite alérxica, e incremento da permeabilidade vascular, que se supón que permiten que outras células inmunitarias poidan acceder aos tecidos, pero que tamén poden orixinar unha potencialmente mortal baixada da presión arterial como na anafilaxe. Aínda que o mecanismo exacto de cada resposta é bastante descoñecido, o descubrimento de por que algúns pacientes alérxicos desenvolven unhas sensibilidades moi fortes mentres que outros simplemente teñen goteo nasal, non está entre os temas máis investigados na ciencia médica. A regulación dos niveis de IgE por medio do control da diferenciación das células B en células plasmáticas secretoras de anticorpos pénsase que implica o receptor de "baixa afinidade" FcεRII, ou CD23.[15] O CD23 pode tamén permitir a presentación de antíxenos facilitada, que é un mecanismo dependente de IgE polo cal as células B que expresan o CD23 poden presentar alérxenos e estimular a linfocitos T axudantes específicos, causando a perpetuación da resposta dos Th2, e un dos sinais disto é a produción de máis anticorpos.[16]
Papel na diagnose
editarA diagnose da alerxia faise xeralmente realizando probas de IgE específicas na pel ou no sangue baseándose no historial do paciente que dan resultado positivo para a presenza de IgE alérxicas específicas.[17] As probas de IgE específicas son as utilizadas para a detección de alerxias, xa que a evidencia non mostra que facer unha batería indiscriminada de probas de IgE ou de IgG sirva para a diagnose da alerxia.[18]
Drogas dirixidas contra as vías das IgE
editarActualmente, as enfermidades alérxicas e a asma trátanse xeralmente con algunhas destas drogas: (1) antihistamínicos e antileucotrienos, que son antagonistas dos mediadores inflamatorios histamina e leucotrienos, (2) corticosteroides locais ou sistémicos (orais ou inxectables), que suprimen un amplo espectro de mecanismos inflamatorios, e (3) broncodilatadores de acción curta ou longa, que relaxan o músculo liso das vías aéreas constrinxidas no asma. Os usos a longo prazo de corticosteroides causan moitos efectos secundarios graves e xeralmente se evitan se hai unha terapia alternativa dispoñible.
As IgE, así como a vía de síntese das IgE, e a vía alérxica/inflamatoria mediada por IgE son todas obxectivos importantes para interferir os procesos patolóxicos da alerxia e a asma. As vías de maduración e diferenciación dos linfocitos B que finalmente xeran células plasmáticas secretoras de IgE pasan polas fases intermedias de linfoblastos B que expresan IgE e implican a interacción con células B de memoria que expresan IgE. A compañía Tanox de Texas, propuxo en 1987 que tomando como obxectivo da terapia as IgE unidas a membrana (mIgE) en linfoblastos B e células B de memoria, esas células poden ser lisadas ou reguladas á baixa, atinguindo así a inhibición da produción de IgE específicas de antíxeno e, por tanto, un cambio no equilibrio inmune cara a mecanismos que non usan as IgE.[19] A droga anti-IgE omalizumab recoñece as IgE que non están unidas aos seus receptores e utilízase para neutralizar ou varrer as IgE existentes no plasma e previr que se unan aos receptores dos mastocitos e basófilos. Preparáronse e están en desenvolvemento clínico para o tratamento da alerxia e a asma anticorpos específicos para un dominio de 52 residuos de aminácidos, denominados CεmX ou M1 prime, presentes só nas IgE unidas a membrana humanas das células B e que non se atopan nas IgE solubles libres.[20][21]
En 2002, os investigadores da Randall Division of Cell and Molecular Biophysics do King's College de Londres determinaron a estrutura detallada da IgE, que é atípica con respecto a outros isotipos porque é moi pregada e asimétrica.[22] A comprensión desta estrutura e da interacción da IgE co receptor FcεRI permitirá o desenvolvemento dunha nova xeración de drogas alérxicas que interfiran coa interacción IgE-receptor. Poderían así deseñarse tratamentos máis baratos ca os anticorpos monoclonais (por exemplo, con drogas máis pequenas) que usen un enfoque similar para inhibir a unión da IgE ao seu receptor.
Notas
editar- ↑ Antibody structure: http://www.cartage.org.lb/en/themes/Sciences/LifeScience/GeneralBiology/Immunology/Recognition/AntigenRecognition/Antibodystructure/Antibodystructure.htm Arquivado 06 de setembro de 2008 en Wayback Machine.
- ↑ Erb KJ (2007). "Helminths, allergic disorders and IgE-mediated immune responses: where do we stand?". Eur J Immunol 37 (5): 1170–1173. PMID 17447233. doi:10.1002/eji.200737314.
- ↑ Fitzsimmons C, McBeath R, Joseph S, Jones F, Walter K, Hoffmann K, Kariuki H, Mwatha J, Kimani G, Kabatereine N, Vennervald B, Ouma J, Dunne D (2007). "Factors affecting human IgE and IgG responses to allergen-like Schistosoma mansoni antigens: Molecular structure and patterns of in vivo exposure". Int. Arch. Allergy Immunol. 142 (1): 40–50. PMID 17019080. doi:10.1159/000095997.
- ↑ Watanabe N, Bruschi F, Korenaga M (2005). "IgE: a question of protective immunity in Trichinella spiralis infection". Trends Parasitol. 21 (4): 175–178. PMID 15780839. doi:10.1016/j.pt.2005.02.010.
- ↑ Pfister K, Turner K, Currie A, Hall E, Jarrett EE (1983). "IgE production in rat fascioliasis". Parasite Immunol 5 (6): 587–593. PMID 6657297. doi:10.1111/j.1365-3024.1983.tb00775.x.
- ↑ Duarte J, Deshpande P, Guiyedi V, Mécheri S, Fesel C, Cazenave P, Mishra G, Kombila M, Pied S (2007). "Total and functional parasite specific IgE responses in Plasmodium falciparum-infected patients exhibiting different clinical status". Malar. J. 6: 1. PMC 1781948. PMID 17204149. doi:10.1186/1475-2875-6-1.
- ↑ Gould H; et al. (2003). "The biology of IGE and the basis of allergic disease". Annu Rev Immunol 21: 579–628. PMID 12500981. doi:10.1146/annurev.immunol.21.120601.141103.
- ↑ Winter, WE; Hardt, NS; Fuhrman, S (2000). "Immunoglobulin E: importance in parasitic infections and hypersensitivity responses". Archives of pathology & laboratory medicine 124 (9): 1382–5. PMID 10975945. doi:10.1043/0003-9985(2000)124<1382:IE>2.0.CO;2.
- ↑ Ishizaka K, Ishizaka T, Hornbrook MM (1966). "Physico-chemical properties of human reaginic antibody. IV. Presence of a unique immunoglobulin as a carrier of reaginic activity". J. Immunol. 97 (1): 75–85. PMID 4162440.
- ↑ Joseph T Belleau, Radha K Gandhi, Holly M McPherson, and D Betty Lew. Research Upregulation of CD23 (FcεRII) Expression in Human Airway Smooth Muscle Cells (huASMC) in Response to IL-4, GM-CSF, and IL-4/GM-CSF. Clin Mol Allergy. 2005; 3: 6. doi: 10.1186/1476-7961-3-6. PMCID: PMC1173127. [1]
- ↑ William E. Paul . Fundamental Immunology. Google books [2]
- ↑ Karagiannis S; et al. (2003). "Activity of human monocytes in IgE antibody-dependent surveillance and killing of ovarian tumor cells". Eur J Immunol 33 (4): 1030–1040. PMID 12672069. doi:10.1002/eji.200323185.
- ↑ Busse W, Buhl R, Fernandez Vidaurre C, Blogg M, Zhu J, Eisner MD, Canvin J (2012). "Omalizumab and the risk of malignancy: results from a pooled analysis". J. Allergy Clin. Immunol. 129 (4): 983–9.e6. PMID 22365654. doi:10.1016/j.jaci.2012.01.033.
- ↑ Takhar P; et al. (2005). "Allergen drives class switching to IgE in the nasal mucosa in allergic rhinitis". J Immunol 174 (8): 5024–32. PMID 15814733.
- ↑ Conrad DH, Ford JW, Sturgill JL, Gibb DR (2007). "CD23: an overlooked regulator of allergic disease". Curr Allergy Asthma Rep. 7 (5): 331–7. PMID 17697638. doi:10.1007/s11882-007-0050-y.
- ↑ Holm J, Willumsen N, Würtzen PA, Christensen LH, Lund K (2011). "Facilitated antigen presentation and its inhibition by blocking IgG antibodies depends on IgE repertoire complexity". J. Allergy Clin. Immunol. 127 (4): 1029–37. PMID 21377718. doi:10.1016/j.jaci.2011.01.062.
- ↑ Cox, L.; Williams, B.; Sicherer, S.; Oppenheimer, J.; Sher, L.; Hamilton, R.; Golden, D.; American College Of Allergy, A. I. T. T. F. et al. (2008). "Pearls and pitfalls of allergy diagnostic testing: Report from the American College of Allergy, Asthma and Immunology/American Academy of Allergy, Asthma and Immunology Specific IgE Test Task Force". Annals of allergy, asthma & immunology : official publication of the American College of Allergy, Asthma, & Immunology 101 (6): 580–592. doi:10.1016/S1081-1206(10)60220-7. PMID 19119701.
- ↑ American Academy of Allergy, Asthma, and Immunology. Five Things Physicians and Patients Should Question (PDF). Choosing Wisely: an initiative of the ABIM Foundation (American Academy of Allergy, Asthma, and Immunology). Arquivado dende o orixinal (PDF) o 03 de novembro de 2012. Consultado o 15 febreiro 2013.
- ↑ Chang TW, Wu PC, Hsu CL, Hung AF (2007). "Anti-IgE antibodies for the treatment of IgE-mediated allergic diseases". Adv Immunol. 93: 63–119. PMID 17383539. doi:10.1016/S0065-2776(06)93002-8.
- ↑ Chen JB, Wu PC, Hung AF, Chu CY, Tsai TF, Yu HM, Chang HY, Chang TW (2010). "Unique epitopes on C epsilon mX in IgE-B cell receptors are potentially applicable for targeting IgE-committed B cells". J Immunol. 184 (4): 1748–56. PMID 20083663. doi:10.4049/jimmunol.0902437.
- ↑ Brightbill HD, Jeet S, Lin Z, Yan D, Zhou M, Tan M, Nguyen A, Yeh S, Delarosa D, Leong SR, Wong T, Chen Y, Ultsch M, Luis E, Ramani SR, Jackman J, Gonzalez L, Dennis MS, Chuntharapai A, DeForge L, Meng YG, Xu M, Eigenbrot C, Lee WP, Refino CJ, Balazs M, Wu LC (2010). "Antibodies specific for a segment of human membrane IgE deplete IgE-producing B cells in humanized mice". J Clin Invest. 120 (6): 2218–29. PMID 20458139. doi:10.1172/JCI40141.
- ↑ Wan T; et al. (2002). "The crystal structure of IgE Fc reveals an asymmetrically bent conformation". Nat Immunol 3 (7): 681–686. PMID 12068291. doi:10.1038/ni811.
Véxase tamén
editarOutros artigos
editar- Anticorpo
- Inmunoglobulina M (IgM)
- Inmunoglobulina A (IgA)
- Inmunoglobulina D (IgD)
- Inmunoglobulina G (IgG)