Quinase dependente de ciclina
As quinases dependentes de ciclina ou CDKs (ás veces Cdk, do inglés Cyclin-Dependent Kinase) son unha familia de proteína quinases que se descubriu primeiramente polo seu papel na regulación do ciclo celular. Están tamén implicadas na regulación da transcrición, procesamento do ARNm, e na diferenciación das células nerviosas.[1] Están presentes en todos os eucariotas estudados, e as súas funcións reguladoras no ciclo celular foron conservadas evolutivamente. De feito, as células de lévedos poden proliferar normalmente cando os seus xenes CDK son substituídos polos xenes homólogos humanos.[1][2] As CDKs son proteínas relativamente pequenas, con pesos moleculares entre 34 e 40 kDa, e o seu dominio de quinase comprende practicamente toda a proteína.[1] As CDK actúan sempre asociándose a unha proteína reguladora chamada ciclina. Sen a ciclina, a CDK ten pouca actividade de quinase; soamente o complexo ciclina-CDK é unha quinase activa. As CDKs fosforilan os seus substratos en residuos de serina ou treonina, polo que son serina/treonina quinases.[1] A secuencia consenso para o sitio de fosforilación na secuencia de aminoácidos dun substrato da CDK é [S/T*]PX[K/R], onde S/T* é a serina ou treonina fosforiladas, P a prolina, X é calquera aminoácido, K é lisina, e R é arxinina.[1]
Tipos
editarTáboa 1: CDKs coñecidas, as súas ciclinas asociadas, e as súas funcións no ser humano [3] e as consecuencias da súa deleción en ratos.[4]
| CDK | Ciclina asociada | Función | Fenotipo de deleción en ratos |
|---|---|---|---|
| Cdk1 | Ciclina B | Fase M | Ningún. ~E2.5. |
| Cdk2 | Ciclina E | Transición G1/S | Tamaño reducido, proliferación da célula proxenitora neural. Viable, pero tanto os machos coma as femias son estériles. |
| Cdk2 | Ciclina A | Fase S, fase G2 | |
| Cdk3 | Ciclina C | Fase G1 ? | Ningún defecto. Viable, fértil. |
| Cdk4 | Ciclina D | Fase G1 | Tamaño reducido, diabete deficiente en insulina. Viable, pero tanto os machos coma as femias son infértiles. |
| Cdk5 | p35 | Transcrición | Defectos neurolóxicos graves. Morte inmediata despois de nacer. |
| Cdk6 | Ciclina D | Fase G1 | |
| Cdk7 | Ciclina H | Quinase activadora de CDK, transcrición | |
| Cdk8 | Ciclina C | Transcrición | Letal en fase embrionaria |
| Cdk9 | Ciclina T | Transcrición | Letal en fase embrionaria |
| Cdk11 | Ciclina L | ? | Defectos mitóticos. E3.5. |
| ? | Ciclina F | ? | Defectos en tecidos extraembrionais. E10.5. |
| ? | Ciclina G | ? |
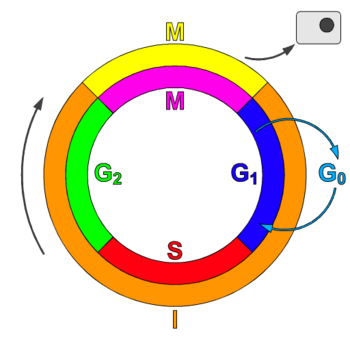
As CDKs e as ciclinas no ciclo celular
editarA maioría dos complexos ciclina-CDK coñecidos regulan a progresión do ciclo celular. As células animais conteñen polo menos nove CDKs, catro das cales, CDK1, 2, 3, e 4, están directamente implicadas na regulación do ciclo celular.[1] En células de mamíferos, a CDK1, coas súas ciclinas A2 e B asociadas, pode el só impulsar o ciclo celular.[4] Outra, a CDK7, está implicada indirectamente como unha quinase activadora de CDK.[1] Os complexos ciclina-CDK fosforilan substratos apropiados para a fase concreta do ciclo celular.[3] Os complexos ciclina-CDK da fase temperá do ciclo celular axudan a activar os complexos ciclina-CDK na fase tardía.[1]
Táboa 2: Ciclinas e CDKs segundo a fase do ciclo celular
| Fase | Ciclina | CDK |
|---|---|---|
| G0 | C | Cdk3 |
| G1 | D, E | Cdk4, Cdk2, Cdk6 |
| S | A, E | Cdk2 |
| G2 | A | Cdk2, Cdk1 |
| M | B | Cdk1 |
Táboa 3: Quinases dependentes de ciclina que controlan o ciclo celular en organismos modelo.[1]
| Especie | Nome | Nome orixinal | Tamaño (aminoácidos) | Función |
|---|---|---|---|---|
| Saccharomyces cerevisiae | Cdk1 | Cdc28 | 298 | Todas as fases do ciclo celular |
| Schizosaccharomyces pombe | Cdk1 | Cdc2 | 297 | Todas s fases do ciclo celular |
| Drosophila melanogaster | Cdk1 | Cdc2 | 297 | M |
| Cdk2 | Cdc2c | 314 | G1/S, S, posiblemente M | |
| Cdk4 | Cdk4/6 | 317 | G1, promove o crecemento | |
| Xenopus laevis | Cdk1 | Cdc2 | 301 | M |
| Cdk2 | 297 | S, posiblemente M | ||
| Homo sapiens | Cdk1 | Cdc2 | 297 | M |
| Cdk2 | 298 | G1, S, posiblemente M | ||
| Cdk4 | 301 | G1 | ||
| Cdk6 | 326 | G1 |
Unha lista de CDKs coa súa proteína reguladora, ciclina ou outra:
- CDK1; ciclina A, ciclina B
- CDK2; ciclina A, ciclina E
- CDK3; ciclina C
- CDK4; ciclina D1, ciclina D2, ciclina D3
- CDK5; CDK5R1, CDK5R2. Ver tamén CDKL5.
- CDK6; ciclina D1, ciclina D2, ciclina D3
- CDK7; ciclina H
- CDK8; ciclina C
- CDK9; ciclina T1, ciclina T2a, ciclina T2b, ciclina K
- CDK10
- CDK11 (CDC2L2) ; ciclina L
- CDK12; ciclina L
- CDK13 (CDC2L5) ; ciclina L
Regulación da actividade das CDK
editarOs niveis das CDKs permanecen relativamente constantes ao longo do ciclo celular e a maioría da súa regulación é postraducional. A maior parte dos coñecementos sobre a estrutura e función das CDKs está baseado nas CDKs de S. pombe (Cdc2), S. cerevisiae (CDC28), e de vertebrados (CDC2 e CDK2). Os catro principais mecanismos de regulación das CDKs son a unión a ciclinas, a fosforilación pola CAK, a fosforilación inhibidora reguladora, e a unión a subunidades inhibidoras de CDK (CKIs).[5]
Unión a ciclinas
editarO sitio activo, ou sitio para a unión do ATP, de todas as quinases é unha fenda situada entre un pequeno lobo amino terminal e outro meirande carboxi-terminal.[1] A estrutura da Cdk2 humana indica que as CDKs teñen un sitio de unión ao ATP modificado que pode ser regulado pola unión de ciclinas.[1] A fosforialción pola quinase activadora de CDK (CAK) da Thr 161 do bucle T incrementa a actividade do complexo. Sen ciclina, un bule flexible chamado bucle de activación ou bucle T bloquea a fenda, e a posición de varios residuos de aminoácidos clave non é a óptima para a unión do ATP.[1] Coa unión da ciclina, dúas hélices alfa cambian de posición para permitir a unión do ATP. Unha delas, a hélice L12 que está xusto despois do bucle T na secuencia primaria, convértese nunha folla beta e axuda a rearranxar o bucle T, polo que este xa non bloquea o sitio activo.[1] A outra hélice alfa chamada hélice PSTAIRE rearránxase e axuda a cambiar a posición de residuos de aminoácidos clave no sitio activo.[1]
A unión da ciclina coa CDK presenta unha considerable especificidade.[3] Ademais, a unión da ciclina determina a especificidade do complexo ciclina-CDK por substratos particulares.[3] As ciclinas poden unirse directamente ao substrato ou localizan a CDK nunha área subcelular na que se encontra o substrato. A especificidade de substrato das ciclinas S débese ao lote hidrofóbico de aminoácidos (centrado na secuencia MRAIL), que ten afinidade por proteínas substrato que conteñen un motivo RXL hidrofóbico (ou Cy). As ciclinas B1 e B2 poden localizar a Cdk1 no núcleo e no complexo de Golgi, respectivamente, por medio dunha secuencia de localización situada fóra da rexión de unión á CDK.[1]
Fosforilación
editarPara que haxa unha actividade de quinase plena é necesaria unha fosforilación activadora nunha treonina adxacente ao sitio activo.[1] A identidade da quinase activadora de CDK (CAK) que realiza esta fosforilación varía segundo o organismo modelo estudado.[1] O momento en que se produce esta fosforilación varfía tamén. En células de mamífero, a fosforilación activadora ocorre despois da unión da ciclina.[1] En células de lévedos, ocorre antes da unión da ciclina.[1] A actividade da CAK non está regulada por vías do ciclo celular coñecidas e a unión da ciclina é o paso limitante da activación da CDK.[1]
A diferenza da fosforilación activadora, a fosforilación inhibidora de CDK é vital para a regulación do ciclo celular. Varias quinases e fosfatases regulan o seu estado de fosforilación. Unha das quinases que coloca o fosfato da tirosina é Wee1, unha quinase conservada en todos os eucariotas.[1] O lévedo de fisión tamén contén unha segunda quinase Mik1, que pode fosforilar a tirosina.[1] Os vertebrados conteñen unha segunda quinase diferente chamada Myt1, que está relacionada con Wee1 pero pode fosforilar tanto a treonina coma a tirosina.[1] As fosfatases da familia de Cdc25 desfosforilan tanto a treonina coma a tirosina.[1]
Inhibidores da CDK
editarUn inhibidor da quinase dependente de ciclina (CKI) é unha proteína que interacciona cun complexo ciclina-CDK para bloquear a actividade de quinase, xeralmente durante a fase G1 ou en resposta a sinais procedentes do ambiente ou do ADN danado.[1] En células animais, hai dúas familias principais de CKIs: a familia INK4 e a familia CIP/KIP.[1] As proteínas da familia INK4 son estritamente inhibidoras e únense a monómeros de CDK. As estruturas cristalinas dos complexos CDK6-INK4 mostran que a unión de INK4 retorce a CDK, o que distorsiona a unión da ciclina e a actividade de quinase. As proteínas da familia CIP/KIP únense tanto á ciclina coma á CDK dun complexo e poden ser inhibidoras ou activadoras. As proteínas da familia CIP/KIP activan a ciclina D e os complexos CDK4 ou CDK6 ao favoreceren a formación do complexo.[1]
En lévedos e Drosophila, os CKIs son inhibidores fortes das CDK S e M, pero non inhiben a CDKs G1/S. Durante a fase G1, os altos niveis de CKIs impiden que os eventos do ciclo celular ocorran incorrectamente, pero non impiden a transición a través do punto de control Inicio (Start), que comeza por medio de CDKs G1/S. Unha vez que se inicia o ciclo celular, a fosforilación por CDKs G1/S temperás leva á destrución dos CKIs, o que alivia a inhibición das transicións do ciclo celular posteriores. En células de mamíferos, a regulación de CKI funciona de diferente xeito. A proteína p27 de mamíferos (chamada Dacapo en Drosophila) inhibe as CDKs G1/S e S, pero non inhibe as CDKs S e M.[1]
Suk1 ou Cks
editarAs CDKs que interveñen directamente na regulación do ciclo celular asócianse con pequenas proteínas de 9 a 13 kDa chamadas Suk1 ou Cks.[3] Estas proteínas son necesarias para o funcionamento das CDKs, pero o papel preciso que exercen non se coñece.[3] Cks1 únese ao lobo carboxi da CDK, e recoñece residuos fosforilados. Pode axudar ao complexo ciclina-CDK con substratos que teñen múltiples sitios de fosforilación ao incrementar a afinidade polo substrato.[3]
Activadores das CDKs que non son ciclinas
editarCiclinas virais
editarOs virus poden codificar proteínas con homoloxía de secuencias coas ciclinas. Un exemplo moi estudado é a chamada ciclina K (ou ciclina v) do herpesvirus do sarcoma de Kaposi, que activa CDK6. Os complexos ciclina viral-CDK teñen diferentes especificidades de substrato e sensibilidades de regulación.[6]
Activdores de CDK5
editarAs proteínas p35 e p39 activan a CDK5. Aínda que carecen de homoloxía de secuencias coas ciclinas, as estruturas cristalinas mostran que a p35 se prega dun modo similar ao das ciclinas. Con todo, a activación de CDK5 non require a fosforilación do bucle de activación.[6]
RINGO/Speedy
editarProteínas con ningunha homoloxía coas ciclinas poden ser activadores directos das CDKs.[7] Unha familia deses activadores é a familia RINGO/Speedy,[7] que foi descuberta orixinalmente en Xenopus. Os cinco membros descubertos ata agora activan todos directamente a Cdk1 e Cdk2, pero o complexo RINGO/Speedy-CDK2 recoñece diferentes substratos que o complexo ciclina A-CDK2.[6]
Historia
editarLeland H. Hartwell, R. Timothy Hunt, e Paul M. Nurse recibiron o Premio Nobel de Medicina ou Fisioloxía de 2001 pola completa descrición que fixeron das ciclinas e mecanismos das quinases depenentes de ciclinas, que son básicos para a regulación do ciclo celular.
Importancia médica
editarAs CDKs considéranse unha diana potencial para os medicamentos anticancro. Se é posible interromper selectivamente a regulación do ciclo celular en células cancerosas interferindo coa acción das CDKs, a célula cancerosa morre. Algúns inhibidores de CDHs como seliciclib están xa en fase de ensaios clínicos. Aínda que foi desenvolvido orixinalmente como un potencial fármaco anticanceroso, seliciclib tamén induce a apoptose en neutrófilos, os cales son mediadores na inflamación.[8] Isto significa que se poderían desenvolver novos fármacos para o tratamento de doenzas inflamatorias crónicas como a artrite e a fibrose quística.
O primeiro inhibidor de CDKs que se probou en ensaios clínicos foi o flavopiridol (alvocidib) despois de que fora identificado nun exame (screen) de axentes anticancerosos en 1992. Compite polo sitio para o ATP das CDKs.[9]
Porén, cómpre facer máis investigacións porque a alteración da vía mediada polas CDK ten potencialmente graves consecuencias; aínda que os inhibidores das CDKs parecen prometedores, debe determinarse como se poden limitar os efectos secundarios para que só sexan afectadas as células diana. Como este tipo de doenzas son xeralmente tratadas con glicocorticoides, os cales teñen tamén graves efectos secundarios, incluso un éxito menor dos novos fármacos podería ser un avance.
Entre as complicacións para o desenvolvemento dun fármaco CDK están que moitas CDKs non están implicadas no ciclo celular, senón noutros procesos comoa transcrición, fisioloxía neural, e a homeostase da glicosa.[10]
Táboa 4: Fármacos inhibidores das quinases dependentes de ciclina [10]
| Fármaco | CDKs inhibidas |
|---|---|
| Flavopiridol (alvocidib) | 1, 2, 4, 6, 7, 9 |
| Olomoucine | 1, 2, 5 |
| Roscovitine | 1, 2, 5 |
| Purvalanol | 1, 2, 5 |
| Paullones | 1, 2, 5 |
| Butriolactona | 1, 2, 5 |
| Palbociclib | 4, 6 |
| Tio/oxoflavopiridois | 1 |
| Oxindois | 2 |
| Aminotiazois | 4 |
| Benzocarbazois | 4 |
| Pirimidinas | 4 |
| Seliciclib | ? |
Notas
editar- ↑ 1,00 1,01 1,02 1,03 1,04 1,05 1,06 1,07 1,08 1,09 1,10 1,11 1,12 1,13 1,14 1,15 1,16 1,17 1,18 1,19 1,20 1,21 1,22 1,23 1,24 1,25 1,26 1,27 Morgan, David O. (2007). The Cell Cycle: Principles of Control. London: New Science Press, 1st ed.
- ↑ Lee, Melanie; Nurse, Paul. (1987). "Complementation used to clone a human homologue of the fission yeast cell cycle control gene cdc2." Nature 327:31-35.
- ↑ 3,0 3,1 3,2 3,3 3,4 3,5 3,6 Morgan, David O. (1997) "Cyclin-Dependent Kinase: Engines, Clocks, and Microprocessors." Annual Review of Cell and Developmental Biology. 13:261-291.
- ↑ 4,0 4,1 Satyanarayana, A; Kaldis. (2009). “Mammalian cell-cycle regulation: several Cdks, numerous cyclins, and diverse compensatory mechanisms” “Oncogene” 28:2925-2939
- ↑ Morgan, David O. (1995). “Principles of CDK regulation.” “Nature” 374:131-133.
- ↑ 6,0 6,1 6,2 Nebreda, Angel R. (2006) “CDK activation by non-cyclin proteins.” “Current Opinion in Cell Biology.” 18:192-198
- ↑ 7,0 7,1 Mouron, Silvana; de Carcer, Guillermo; Seco, Esther; Fernandez-Miranda, Gonzalo; Malumbres, Marcos; Nebreda, Angel. (2010). "RINGO C is required to sustain the spindle assembly checkpoint." Journal of Cell Science. 123:2586-2595.
- ↑ Rossi, Adriano G.; Sawatzky, Deborah A.; Walker, Annemieke; Ward, Carol; Sheldrake, Tara A.; Riley, Nicola A.; Caldicott, Alison; Martinez-Losa, Magdalena; Walker, Trevor R.; Duffin, Roger; Gray, Mohini; Crescenzi, Elvira; Martin, Morag C.; Brady, Hugh J; Savill, John S.; Dransfield, Ian & Haslett, Christopher (2006): Cyclin-dependent kinase inhibitors enhance the resolution of inflammation by promoting inflammatory cell apoptosis. Nature Medicine 12 (in print). doi 10.1038/nm1468
- ↑ Senderowicz, AM. “Flavopiridol: the first cyclin-dependent kinase inhibitor in human clinical trials” “Invest New Drugs” 17(3):313-20
- ↑ 10,0 10,1 Sausville, Edward A. (2002) “Complexities in the development of cyclin-dependent kinase inhibitor drugs” “Trends in Molecular Medicine” 8:S32-S37
Véxase tamén
editarLigazóns externas
editar- Cyclin-Dependent Kinases Medical Subject Headings (MeSH) na Biblioteca Nacional de Medicina dos EUA.
- EC 2.7.11.22
- KEGG - Ciclo celular humano Arquivado 03 de novembro de 2008 en Wayback Machine.
- Loyer P, Trembley J, Katona R, Kidd V, Lahti J (2005). "Role of CDK/cyclin complexes in transcription and RNA splicing". Cell Signal 17 (9): 1033–51. PMID 15935619. doi:10.1016/j.cellsig.2005.02.005.