Proteína quinase
Unha proteína quinase[1] é un encima de tipo quinase que modifica outras proteínas engadíndolles quimicamente grupos fosfato (fosforilación). A fosforilación xeralmente ten como resultado un cambio funcional na proteína diana (o substrato) ao modificar a súa actividade encimática catalítica, a súa localización celular ou a súa asociación con outras proteínas. O xenoma humano contén uns 560 xenes de proteína quinase, que constitúen un 2% de todos os xenes humanos.[2] Aproximadamente un 30% de todas as proteínas humanas poden ser modificadas pola actividade quinase, e as quinases regulan a maioría das vías celulares, especialmente as implicadas na transdución de sinais. As proteína quinases tamén se encontran en bacterias e plantas, e inclúen a subfamilia das pseudoquinases. As pseudoquinases mostran características pouco comúns,[3] como a unión a nucleótidos atípicos e unha actividade catalítica débil ou nula [4] e forman parte dun grupo máis grande de pseudoencimas (é dicir, de proteínas relacionadas con encimas "degradados") que se encontran en todos os tipos de organismos, nos que teñen unha activa participación na mecánica da sinalización celular.[5]
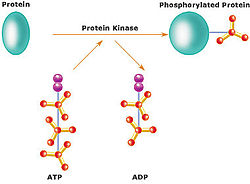
Actividade química
editarA actividade química dunha quinase consiste na transferencia dun grupo fosfato desde un nucleósido trifosfato (xeralmente o adenosín trifosfato, ATP) e a súa unión covalente a un aminoácido específico que teña un grupo hidroxilo libre. A maioría das quinases actúan tanto sobre o aminoácido serina coma sobre a treonina (son serina/treonina quinases), outras actúan sobre a tirosina (son tirosina quinases), e algunhas actúan sobre calquera dos tres aminoácidos (son quinases de especificidade dual).[6] Hai tamén proteína quinases que fosforilan outros aminoácidos, como as histidina quinases que fosforilan residuos de histidina.[7]
Regulación
editarComo as proteína quinases teñen profundos efectos sobre a célula, a súa actividade está moi regulada. As quinases son activadas ou inactivadas tamén por fosforilación (ás veces pola cis-fosforilación/autofosforilación pola propia quinase), ao unírense a proteínas activadoras ou proteínas inhibidoras ou pequenas moléculas, ou controlando a súa localización na célula en relación coa dos seus substratos.
Estrutura
editar- Artigo principal: Dominio de proteína quinase.
As subunidades catalíticas de moitas proteína quinases están moi conservadas, e varias das súas estruturas foron xa resoltas.[8][9]
As proteína quinases eucarióticas son encimas que pertencen a unha familia moi extensa de proteínas que comparten un núcleo catalítico conservado.[10][11][12][13] No seu dominio catlítico hai varias rexións conservadas. No extremo N-terminal do dominio catalítico hai un tramo rico en residuos de glicina ao lado dunha lisina, a cal está implicada na unión do ATP. Na parte central do dominio catalítico, hai un ácido aspártico conservado, que é importante para a actividade catalítica do encima.[14]
Grupos de proteína quinases
editarA familia humana da proteína quinase está dividida nos seguintes grupos:
- AGC quinases, que conteñen PKA, PKC e PKG.
- CaM quinases, que conteñen as proteína quinases dependentes de calcio/calmodulina.
- CK1, que contén o grupo da caseína quinase 1.
- CMGC, que conteñen as quinases CDK, MAPK, GSK3 e CLK.
- STE, que conteñen os homólogos dos lévedos as quinases Sterile 7, Sterile 11 e Sterile 20.
- TK, que contén as tirosina quinases.
- TKL, que contén o grupo das quinases similares ás tirosina quinases.
Proteína quinases específicas de serina/treonina
editar- Artigo principal: Proteína quinase específica de serina/treonina.
As serina/treonina proteína quinases (EC 2.7.11.1) fosforilan o grupo OH da serina ou treonina (que teñen cadeas laterais similares). A actividade destas proteína quinases pode ser regulada por eventos específicos (por exemplo, danos no ADN), e diversos sinais químicos, como o AMPc/GMPc, diacilglicerois e Ca2+/calmodulina. Un grupo moi importatne de proteína quinases son as MAPK (acrónimo de: "proteína quinase activada por mitóxeno" en inglés). Subgrupos importantes son as quinases da subfamilia ERK, activadas por sinais mitoxénicos específicos, e as proteína quinases activadas polo estrés JNK e p38. Aínda que as quinases MAP son específicas de serina/treonina, son activadas pola fosforilación combinada en residuos de serina/treonina e tirosina. A actividade das quinases MAP está restrinxida por varias proteínas fosfatases, que retiran os grupos fosfato que foron engadidos en residuos específicos de serina ou treonina da quinase, os cales son necesarias para manter a quinase nunha conformación activa. Son dous os factores principais que inflúen na actividade das quinases MAP: a) Sinais que activan receptores transmembrana (sexan ligandos naturais ou axentes de interconexión) e proteínas asociadas con eles (mutacións que simulan o estado activo). b) Sinais que inactivan as fosfatases que restrinxen unha determinada quinase MAP. Tales sinais inclúen o estrés oxidativo.[15]
Proteína quinases específicas de tirosina
editar- Artigo principal: Tirosina quinase.
As proteína quinases específicas de tirosina (EC 2.7.10.1 e EC 2.7.10.2) fosforilan residuos do aminoácido tirosina, e igual que as proteína quinases específicas de serina/treonina utilízanse na transdución de sinais. Actúan principalmente como receptores de factores e crecemento e na sinalización augas abaixo de factores de crecemento;[16] algúns exemplos son:
- Receptor do factor de crecemento derivado de plaquetas (PDGFR)
- Receptor do factor de crecemento epidérmico (EGFR)[17]
- Receptor da insulina e receptor do factor de crecemento similar á insulina 1 (IGF1R)
- Receptor do factor de célula troncal (SCF) (tamén chamado c-kit).
Tirosina quinases receptoras
editarEstas quinases constan dun receptor transmembrana cun dominio de tirosina quinase que se asoma no lado do citoplasma. Xogan un importante papel na regulación da división celular, diferenciación celular e morfoxénese. Coñécense máis de 50 tirosina quinases receptoras en mamíferos.
Estrutura
editarO dominio extracelular serve como parte da molécula que se une ao ligando. Pode ser unha unidade separada que se une ao resto do receptor por unha ponte disulfuro. O mesmo mecanismo pode utilizarse para unir dous receptores para formar un homo- ou heterodímero. O elemento transmembrana é unha soa hélice α. O dominio intracelular ou citoplasmático é responsable da actividade de quinase (altamente conservada), así como varias funcións reguladoras.
Regulación
editarA unión do ligando causa dúas reaccións:
- A dimerización de dúas quinases receptoras monómeras ou a estabilización dun dímero debilmente unido. Moitos ligandos ou receptores de tirosina quinases son multivalentes. Algunhas quinases receptoras de tirosina (por exemplo, o receptor do factor de crecemento derivado de plaquetas) poden formar heterodímeros con outras quinases similares pero non idénticas da mesma subfamilia, o que permite unha resposta moi variada aos sinais extracelulares.
- A trans-autofosforilación da quinase (fosforilación polas outras quinases que forman parte do dímero ou complexo de orde máis alto).
A autofosforilación do bucle de activación causa que os dous subdominios da quinase intrínseca se movan, abrindo o dominio quinase para a unión do ATP. Na forma inactiva, dos subdominios de quinase están aliñados para que o ATP non poida acadar o centro catalítico da quinase. Cando están presentes varios aminoácidos adecuados para a fosforilación no dominio quinase (por exemplo, o receptor do factor de crecemento similar á insulina), a actividade da quinase pode incrementarse co número de aminoácidos fosforilados.
As estruturas dalgúns complexos de autofosforilación de quinases receptoras de tirosina (e outras quinases) coñécense polo estudo de cristais de proteína quinases nos cales o sitio de fosforilación (Ser, Thr ou Tyr) dun monómero do cristal está sobre o sitio activo doutro monómero do cristal a modo de substrato.[18] As estruturas coñecidas da autofosforilación RTK inclúen os sitios de fosforilación nos bucles de activación do IGF1R (tanto Y1165 coma Y1166), as rexións de inserción da quinase de FGFR1 e FGFR3, e as colas N ou C-terminais de KIT, EPHA2, CSF1R e FGFR2.
Transdución de sinais
editarA tirosina quinase activa fosforila proteínas diana específicas, as cales á súa vez son tamén encimas. Unha importante diana é a cadea de transdución de sinais da proteína ras.
Tirosina quinases asociadas a receptor
editarAs tirosina quinases recrutadas nun receptor despois da unión dunha hormona son tirosina quinases asociadas a receptor e están implicadas en varias fervenzas de sinalización, en particular as implicadas na sinalización de citocinas (pero tamén outras, como a hormona do crecemento). Unha desas tirosina quinases asociadas a receptor é a quinase Janus (JAK), moitos de cuxos efectos están mediados polas proteínas STAT. (como na vía JAK-STAT.)
Proteína quinases específicas de histidina
editar- Artigo principal: Histidina quinase.
As histidina quinases son estruturalmente distintas da maioría das outras proteína quinases e encóntranse principalmente en procariotas como parte dun mecanismo de transdución de sinais de dous compoñentes.[19] Primeiro engádese un grupo fosfato do ATP a un residuo de histidina da quinase, e posterioremnte é transferido a un residuo de aspartato nun 'dominio receptor' dunha proteína diferente ou ás veces da propia quinase. O residuo aspartil fosfato é entón activo na sinalización.
As histidina quinases encóntranse en plantas, fungos, animais e outros eucariotas. A familia da piruvato dehidroxenase das quinases animais está estruturalmente relacionada coas histidina quinases, pero diferénciase en que fosforila residuos de serina e probablemente non usa un intermediario fosfo-histidina.
Quinases con actividade mixta
editarAlgunhas quinases teñen actividades quinase mixtas. Por exemplo, a MEK (MAPKK), que está implicada na fervenza da quinase MAP, é unha serina/treonina e tirosina quinase mixta e, por tanto, é unha quinase de especificidade dual.
Inhibidores
editarA actividade quinase desregulada é unha causa frecuente de enfermidade, en especial cancro, mentres que as quinases regulan moitos aspectos que controlan o crecemento, movemento e morte celulares. Estanse desenvolvendo fármacos que inhiben quinases específicas para tratar varias doenzas, e algunhas están actualmente en uso clínico, como o Gleevec (imatinib) e Iressa (gefitinib). Entre estes inhibidores están:
Ensaios e perfil de quinases
editarO desenvolvemento de fármacos inhibidores das quinases é facilitado por ensaios de quinases, e despois os principais compostos son xeralmente perfilados para a súa especificidade antes de pasar a facer máis probas. Disponse de moitos servizos de perfilado que utilizan ensaios baseados na fluorescencia como o ensaio de termoforese a microescala para deteccións baseadas en radioisótopos e ensaios de unión por competición.
Notas
editar- ↑ Dicionario de Bioloxía. Xunta de Galicia 2010. ISBN 978-84-453-4973-1 . Páxina 142. proteína quinase
- ↑ Manning G, Whyte DB, et al. (2002). "The protein kinase complement of the human genome". Science 298 (5600): 1912–1934. PMID 12471243. doi:10.1126/science.1075762.
- ↑ Reiterer V, Eyers PA, Farhan H (2014). "Day of the dead: pseudokinases and pseudophosphatases in physiology and disease.". Trends in Cell Biology 24 (9): 489–505. PMID 24818526. doi:10.1016/j.tcb.2014.03.008.
- ↑ Murphy JM, et al. (2014). "A robust methodology to subclassify pseudokinases based on their nucleotide-binding properties". Biochemical Journal 457 (2): 323–334. PMID 24107129. doi:10.1042/BJ20131174.
- ↑ Eyers PA, Murphy JM (2016). "The evolving world of pseudoenzymes: proteins, prejudice and zombies.". BMC Biology 14 (1): 98. PMID 27835992. doi:10.1186/s12915-016-0322-x.
- ↑ Dhanasekaran N, Premkumar Reddy E (September 1998). "Signaling by dual specificity kinases". Oncogene 17 (11 Reviews): 1447–55. PMID 9779990. doi:10.1038/sj.onc.1202251.
- ↑ Besant PG, Tan E, Attwood PV (March 2003). "Mammalian protein histidine kinases". Int. J. Biochem. Cell Biol. 35 (3): 297–309. PMID 12531242. doi:10.1016/S1357-2725(02)00257-1.
- ↑ Stout TJ, Foster PG, Matthews DJ (2004). "High-throughput structural biology in drug discovery: protein kinases". Curr. Pharm. Des. 10 (10): 1069–82. PMID 15078142. doi:10.2174/1381612043452695.
- ↑ van Linden OP, Kooistra AJ, Leurs R, de Esch IJ, de Graaf C (2013). "KLIFS: A knowledge-based structural database to navigate kinase-ligand interaction space". J. Med. Chem. 57 (2): 249–77. PMID 23941661. doi:10.1021/jm400378w.
- ↑ Hanks SK (2003). "Genomic analysis of the eukaryotic protein kinase superfamily: a perspective". Genome Biol. 4 (5): 111. PMC 156577. PMID 12734000. doi:10.1186/gb-2003-4-5-111. Arquivado dende o orixinal o 19 de abril de 2015. Consultado o 04 de setembro de 2017.
- ↑ Hanks SK, Hunter T (May 1995). "Protein kinases 6. The eukaryotic protein kinase superfamily: kinase (catalytic) domain structure and classification". FASEB J. 9 (8): 576–96. PMID 7768349.
- ↑ Hunter T (1991). "Protein kinase classification". Meth. Enzymol. Methods in Enzymology 200: 3–37. ISBN 9780121821012. PMID 1835513. doi:10.1016/0076-6879(91)00125-G.
- ↑ Hanks SK, Quinn AM (1991). "Protein kinase catalytic domain sequence database: identification of conserved features of primary structure and classification of family members". Meth. Enzymol. Methods in Enzymology 200: 38–62. ISBN 9780121821012. PMID 1956325. doi:10.1016/0076-6879(91)00126-H.
- ↑ Knighton DR, Zheng JH, Ten Eyck LF, Ashford VA, Xuong NH, Taylor SS, Sowadski JM (July 1991). "Crystal structure of the catalytic subunit of cyclic adenosine monophosphate-dependent protein kinase". Science 253 (5018): 407–14. PMID 1862342. doi:10.1126/science.1862342.
- ↑ Vlahopoulos S, Zoumpourlis VC (August 2004). "JNK: a key modulator of intracellular signaling". Biochemistry. Biokhimiia 69 (8): 844–54. PMID 15377263. doi:10.1023/B:BIRY.0000040215.02460.45.
- ↑ Higashiyama, Shigeki; Iwabuki, Hidehiko; Morimoto, Chie; Hieda, Miki; Inoue, Hirofumi; Matsushita, Natsuki (February 2008). "Membrane-anchored growth factors, the epidermal growth factor family: Beyond receptor ligands". Cancer Science 99 (2): 214–20. PMID 18271917. doi:10.1111/j.1349-7006.2007.00676.x.
- ↑ Carpenter, Graham (August 2000). "The EGF receptor: a nexus for trafficking and signaling". BioEssays 22 (8): 697–707. PMID 10918300. doi:10.1002/1521-1878(200008)22:8<697::AID-BIES3>3.0.CO;2-1.
- ↑ Xu, Q.; Malecka, K. L.; Fink, L.; Jordan, E. J.; Duffy, E.; Kolander, S.; Peterson, J. R.; Dunbrack, R. L., Jr. (1 December 2015). "Identifying three-dimensional structures of autophosphorylation complexes in crystals of protein kinases". Science Signaling 8 (405): rs13–rs13. PMID 26628682. doi:10.1126/scisignal.aaa6711.
- ↑ Wolanin PW, Thomason PA, Stock JB (2002). "Histidine protein kinases: key signal transducers outside the animal kingdom". Genome Biology 3 (10): reviews3013.1–3013.8. PMC 244915. PMID 12372152. doi:10.1186/gb-2002-3-10-reviews3013. Arquivado dende o orixinal o 26 de agosto de 2015. Consultado o 04 de setembro de 2017.
Véxase tamén
editarLigazóns externas
editar- The Protein Kinase Ontology (ProKinO): Recurso unificado sobre proteína quinases
- Lista de bases de datos de fosforilacion de proteínas e outros recursos relacionados
- The Protein Kinase Resource[Ligazón morta]: Estruturas de proteína quinases e outros datos relacionados
- Proteína quinases de rato e humanas: clasificación e índice
- The Kinase Knowledgebase (KKB): Datas de estrutura, actividade e síntese química de quinases.
- Kinase.Com Arquivado 26 de decembro de 2020 en Wayback Machine.: Xenónimca, evolución e análise a grande escala de proteína quinases (non comercial).
- Kinase/TIP: Base de datos con miles de proteínas, co-complexos e modelos do Human Kinome.
- AurSCOPE Kinase Database
- Kinasecentral: Información sobre inhibidores de quinases en desenvolvemento
- Kinase-Ligand Interaction Fingerprints and Structure database (KLIFS)
- Colección de proteína quinases específicas de Ser/Thr/Tyr e secuencias similares
- KinMutBase: Rexistro de mutacións que causan doenzas en dominios de proteína quinases
- Human kinome de Manning et al.
- OPM - Universidade de Míchigan - familia-superfamily 63 - Orientacións dos dominios C1 de proteína quinases en membranas
- OPM - Universidade de Míchigan - familia-superfamilia 47 - Orientacións dos dominios C2 de proteína quinases e outras proteínas nas membranas
- Huaxian Chen, et al. A Cell Based Immunochemical Assay for Monitoring Kinase Signaling Pathways and Drug Efficacy (PDF) Analytical Biochemistry 338 (2005) 136-142
- MAP Kinase Resource Arquivado 15 de abril de 2021 en Wayback Machine.