Serina/treonina proteína quinase
Unha serina/treonina proteína quinase (EC 2.7.11.1) é un encima quinase que fosforila o grupo OH dos aminoácidos serina ou treonina (que teñen cadeas laterais similares). Polo menos 125 das máis de 500 proteína quinases humanas son serina/treonina quinases (STK).[2]
| Serina/treonina proteína quinase non específica | |||||||||
|---|---|---|---|---|---|---|---|---|---|

| |||||||||
| Quinase Aurora Humana PDB 1mq4 | |||||||||
| Identificadores | |||||||||
| Número EC | 2.7.11.1 | ||||||||
| Número CAS | 9026-43-1 | ||||||||
| Bases de datos | |||||||||
| IntEnz | vista de IntEnz | ||||||||
| BRENDA | entrada de BRENDA | ||||||||
| ExPASy | vista de NiceZyme | ||||||||
| KEGG | entrada de KEGG | ||||||||
| MetaCyc | vía metabólica | ||||||||
| PRIAM | perfil | ||||||||
| Estruturas PDB | RCSB PDB PDBe PDBj PDBsum | ||||||||
| Gene Ontology | AmiGO / EGO | ||||||||
| |||||||||

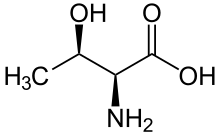
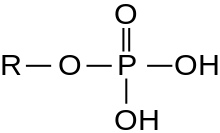
En encimoloxía, o termo serina/treonina proteína quinase non específica designa unha clase de enimas que pertencen ao grupo das transferases, especificamente as proteína-serina/treonina quinases (que é outro dos nomes que reciben). Estes encimas transfiren fosfatos ao átomo de oxíxeno dunha cadea lateral de serina ou treonina en proteínas. Este proceso denomínase fosforilación. A fosforilación de proteínas en especial xoga un importante papel en multitude de procesos celulares e é unha modificación postraducional moi importante.[3][4][5][6][7][8][9]
A reacción química realizada por estes encimas pode escribirse así:
- ATP + unha proteína ADP + unha fosfoproteína
Así, os dous substratos deste encima son o ATP e unha proteína, e os seus dous produtos son o ADP e a fosfoproteína.
O nome sistemático desta clase de encimas é ATP:proteína fosfotransferase (non específica).
Regulación editar
Os receptores da serina/treonina quinase xogan un importante papel na regulación da proliferación celular, morte celular programada, diferenciación celular e desenvolvemento embrionario.
Selectividade editar
Aínda que todas as serina/treonina quinases fosforilan residuos de serina ou treonina nos seus substratos, non fosforilan calquera residuo de serina ou treonina senón que seleccionan residuos específicos que flanquean o sitio fosfoaceptor, o cal en conxunto comprende a secuencia de consenso. Como os residuos da secuencia de consenso dun substrato diana só fan contacto con varios aminoácidos clave dentro da fenda catalítica da quinase (xeralmente por medio de forzas hidrofóbicas e enlaces iónicos), unha quinase xeralmente non é específica para un só substrato, senón que pode fosforilar unha completa "familia de substratos" que comparten secuencias de recoñecemento comúns. De aí que se denominen non específicas (pero si son específicas da serina/treonina). Aínda que o dominio catalítico destas quinases está moi conservado, a variación da secuencia que se observa no quinoma (quinoma ou kinome é o conxunto de xenes do xenoma que codifica quinases) proporciona a posibilidade de recoñecer distintos substratos. A maioría das quinases son inhibidas por un pseudosubstrato que se une á quinase como un substrato real, pero carece do aminoácido para ser fosforilado. Cando se retira o pseudosubstrato, a quinase pode realizar a súa función normal.
Número EC editar
Moitas serina/treonina proteína quinases non teñen o seu propio número EC individual e utilizan en conxunto o "2.7.11.1". Anteriormente estaban incluídas no número EC "2.7.1.37", que era un número EC xeral para calquera encima que fosforilase proteínas á vez que convertía ATP en ADP (é dicir, ATP:proteína fosfotransferases.)
Tipos editar
Os tipos comprenden aqueles que actúan directamente sobre receptores (proteína receptora serina/treonina quinase) e péptidos e proteínas de sinalización intracelular. Dentro destes últimos os tipos son:
| Número EC | Nome | Descrición |
|---|---|---|
| EC 2.7.11.1 | CK2, tamén coñecida polo nome pouco apropiado de caseína quinase 2 | descuberta en 1954 por Burnett e Kennedy. |
| EC 2.7.11.1 | Proteína quinase A | consta de dous dominios, un pequeno dominio con varias estruturas en folla β e un dominio máis grande que contén varias hélices α. Os sitios de unión para o substrato e o ATP están localizados na fenda catlítica entre os dominios (ou lobos). Cando se unen o ATP e o substrato, os dous lobos rotan para que o grupo fosfato terminal (gamma) do ATP e o aminoácido diana do substrato se movan ás posicións correctas para que teña lugar a reacción catalítica. |
| EC 2.7.11.1 | Proteína quinase C ('PKC') | en realidade é unha familia de proteína quinases que consta de ~10 isocimas. Divídense en tres subfamilias: convencional (ou clásica), nova, e atípica, baseándose nos segundos mensaxeiros que necesiten. |
| EC 2.7.11.1 | Mos/quinases Raf | forman parte da familia das quinases MAPKK e son activadas por factores de crecemento. O encima funciona estimulando o crecemento das células. A inhibición de Raf converteuse no obxectivo para o desenvolvemento de novos fármacos anticancerosos, xa que inhiben a fervenza da MAPK e reducen a proliferación celular. |
| EC 2.7.11.1 | Proteína quinases activadas por mitóxeno (MAPK) | responden a estímulos extracelulares (os mitóxenos) e regulan varias actividades celulares, como a expresión xénica, mitose, diferenciación celular e a supervivencia celular/apoptose. |
| EC 2.7.11.17 | Proteína quinase dependente do Ca2+/calmodulina ou quinases CaM | son reguladas primariamente polo complexo Ca2+/calmodulina. |
| EC 2.7.11.19 | Fosforilase quinase | foi a primeira Ser/Thr proteína quinase que se descubriu (en 1959 por Krebs et al.). |
| EC 2.7.1.37 | Proteína quinase B, tamén coñecida como quinase AKT | o xene v-akt foi identificado como o oncoxene do retrovirus AKT8. O xene codifica unha proteína quinase. Os homólogos humanos da proteína oncoxénica AKT8 foron identificados en 1987. En 1995 atopárase que as quinases Akt funcionan como quinases activadas por mitóxeno augas abaixo da ruta desde os receptores da superficie celular que activan a fosfoinosítido 3-quinase. Nos humanos hai tres xenes akt. As tres quinases Akt regulan a proliferación celular e a Akt2 é especialmente importante para as accións da insulina nas células. Unha diana principal das quinases Akt é a glicóxeno sintase quinase-3. |
| EC 2.7.1.37 | Pelle | é unha serina/treonina quinase que pode autofosforilarse, e tamén Tube e Toll. |
Importancia clínica editar
Algúns exemplos da importancia clínica das serina/treonina proteína quinases son:
A expresión das serina/treonina quinases (STK) está alterada en moitos tipos de cancro.[2]
A serina/treonina proteína quinase p90-kDa quinase S6 ribosómica (RSK) está implicada no desenvolvemento dalgúns cancros de próstata.[10]
A inhibición de Raf é a diana de novos fármacos contra o cancro metastático, xa que inhiben a fervenza da MAPK e reducen a proliferación celular.
Notas editar
- ↑ Nowakowski, J.; Cronin, C. N.; McRee, D. E.; Knuth, M. W.; Nelson, C. G.; Pavletich, N. P.; Rogers, J.; Sang, B. C.; Scheibe, D. N.; Swanson, R. V.; Thompson, D. A. (2002). "Structures of the cancer-related Aurora-A, FAK, and EphA2 protein kinases from nanovolume crystallography". Structure 10 (12): 1659–1667. PMID 12467573. doi:10.1016/S0969-2126(02)00907-3.
- ↑ 2,0 2,1 http://cancerres.aacrjournals.org/cgi/content/full/66/16/8147 "Frequent Alterations in the Expression of Serine/Threonine Kinases in Human Cancers" Capra et al. Cancer Research. 2006
- ↑ Damuni Z, Reed LJ (1988). "Purification and properties of a protamine kinase and a type II casein kinase from bovine kidney mitochondria". Arch. Biochem. Biophys. 262 (2): 574–84. PMID 2835010. doi:10.1016/0003-9861(88)90408-0.
- ↑ Baggio B, Pinna LA, Moret V, Siliprandi N (1970). "A simple procedure for the purification of rat liver phosvitin kinase". Biochim. Biophys. Acta 212 (3): 515–7. PMID 5456997. doi:10.1016/0005-2744(70)90261-5.
- ↑ Jergil B, Dixon GH (1970). "Protamine kinase from rainbow trout testis. Partial purification and characterization". J. Biol. Chem. 245 (2): 425–34. PMID 4312674.
- ↑ Langan TA (1969). "Action of adenosine 3',5'-monophosphate-dependent histone kinase in vivo". J. Biol. Chem. 244 (20): 5763–5. PMID 4310608.
- ↑ Takeuchi M, Yanagida M (1993). "A mitotic role for a novel fission yeast protein kinase dsk1 with cell cycle stage dependent phosphorylation and localization". Mol. Biol. Cell 4 (3): 247–60. PMC 300923. PMID 8485317. doi:10.1091/mbc.4.3.247.
- ↑ NF; Lützelberger, M; Weigmann, H; Klingenhoff, A; Shenoy, S; Käufer, NF (1997). "Functional analysis of the fission yeast Prp4 protein kinase involved in pre-mRNA splicing and isolation of a putative mammalian homologue". Nucleic Acids Res. 25 (5): 1028–35. PMC 146536. PMID 9102632. doi:10.1093/nar/25.5.1028.
- ↑ Wang Y, Hofmann TG, Runkel L, Haaf T, Schaller H, Debatin K, Hug H (2001). "Isolation and characterization of cDNAs for the protein kinase HIPK2". Biochim. Biophys. Acta 1518 (1–2): 168–72. PMID 11267674. doi:10.1016/S0167-4781(00)00308-0.
- ↑ http://cancerres.aacrjournals.org/cgi/content/abstract/65/8/3108 "The Serine/Threonine Protein Kinase, p90 Ribosomal S6 Kinase, Is an Important Regulator of Prostate Cancer Cell Proliferation" Cancer Research. 2005
Ligazóns externas editar
- protein-serine-threonine kinases Medical Subject Headings (MeSH) na Biblioteca Nacional de Medicina dos EUA.
