Toxoplasma gondii
- Para a enfermidade producida por este parasito ver toxoplasmose.
| Toxoplasma gondii | |||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 taquizoítos de T. gondii | |||||||||||||||||||||||
| Clasificación científica | |||||||||||||||||||||||
| |||||||||||||||||||||||
| Nome binomial | |||||||||||||||||||||||
| 'Toxoplasma gondii' (Nicolle & Manceaux, 1908) | |||||||||||||||||||||||
Toxoplasma gondii é unha especie de protozoos parasitos intracelulares obrigados que causan a enfermidade chamada toxoplasmose.[1] Os hóspedes definitivos do parasito son os félidos, como os gatos.
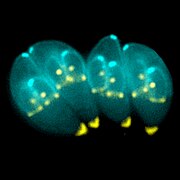
T. gondii encóntrase en todo o mundo e pode infectar virtualmente a todos os animais de sangue quente.[2] En humanos, é un dos parasitos máis comúns;[3] Os estudos serolóxicos estiman que ata un terzo da poboación global foi exposta a este protozoo e pode estar infectado cronicamente por T. gondii, aínda que as taxas de infección difiren significativamente dun país a outro.[4] Aínda que as infeccións son leves, poden ocasionalmente darse síntomas similares aos dun arrefriado durante as primeiras semanas despois da exposición, pero xeralmente non producen síntomas nos adultos humanos con boa saúde.[5][6] Polo contrario, nos nenos pequenos, pacientes de VIH/SIDA, e outros con inmunidade feble, a infección pode causar unha enfermidade grave e ocasionalmente mortal chamada toxoplasmose.[5][6] É posible a transmisión conxénita de nai a feto.
Modos de transmisión e factores de risco
editarA infección nos humanos e outros animais de sangue quente pode ocorrer das seguintes maneiras:
- Ao consumir carne crúa ou pouco cociñada que conteña quistes dos tecidos de T. gondii.[7]
- Ao inxerir auga, terra, verduras ou calquera outra cousa contaminada con ooquistes do parasito, que foron liberados nas feces por un animal infectado (gatos, por exemplo).[7]
- Por transmisión dunha nai preñada ao seu feto, especialmente cando T. gondii se contrae xusto durante o embarazo.[7]
Aínda que T. gondii pode infectar, ser transmitido, e reproducirse asexualmente en humanos e virtualmente en todos os animais de sangue quente, o parasito só pode reproducirse sexualmente no intestino de gatos e outros félidos.[8] Os félidos son definidos como os hóspedes definitivos, e os outros animais infectados como hóspedes intermedios.
Os seguintes factores foron identidicados como de risco para a infección por T. gondii en humanos:
- Exposición ou consumo de carne crúa ou pouco cociñada.[9][10][11][12]
- Beber leite de cabra non pasteurizada.[10]
- Contacto co solo.[7][11]
- Comer verduras ou froitas sen lavar.[9]
- Limpar as caixas para gatos.[9]
As augas residuais foron tamén identificadas como un medio de transporte para o microorganismo.[13][14][15][16]
Existen numerosos estudos que indicaron que o simple feito de vivir cun gato doméstico non é un factor de risco significativo para a infección por T. gondii,[9][11][17] pero vivir con varios gatos ten certa significancia.[18]
Cambios no comportamento do hóspede inducidos pola infección
editarT. gondii altera o comportamento de roedores infectados de xeitos que se cre incrementan as posibilidades de que os roedores sexan capturados polos seus depredadores, como os gatos.[19][20][21] Como os gatos e outros félidos son os únicos hóspedes nos que T. gondii pode reproducirse sexualmente e completar o seu ciclo de vida, estas manipulacións no comportamento pénsase que son adaptacións evolutivas para incrementar a eficacia biolóxica reprodutiva do parasito,[21] e isto é un exemplo do que o biólogo evolutivo Richard Dawkins chama "fenotipo estendido" ou ampliado. Aínda que existen numerosas hipóteses que se están a investigar, non se coñece polo momento o mecanismo polo que T. gondii induce este cambio de comportamento nos roedores infectados.[22]
Varios estudos suxeriron que nos humanos infectados hai tamén uns cambios sutís de comportamento ou personalidade,[23] e a infección por este parasito foi recentemente asociada con varios trastornos neurolóxicos, especialmente a esquizofrenia.[20] Con todo, as probas dunha relación causal son limitadas.[20]
Ciclo de vida
editarO ciclo de vida de T. gondii comprende unha fase de reprodución sexual que ocorre nos felidos (en gatos domésticos ou en moitos félidos salvaxes) e unha fase de reprodución asexual, que ocorre en practicamente todos os animais de sangue quente, incluídos humanos, gatos, e paxaros.[24] Como T. gondii só pode reproducirse sexualmente en felinos, estes son os seus hóspedes definitivos, e os demais hóspedes, onde ten lugar a reprodución asexual, considéranse hóspedes intermedios.
Reprodución sexual nos félidos
editarCando un félido se infecta con T. gondii (por exemplo, ao consumir un rato infectado con quistes do parasito), o parasito sobrevive ao paso polo seu estómago, e infecta as células do epitelio do seu intestino delgado.[25] Dentro das células intestinais, o parasito experimenta un desenvolvemento e reprodución sexual, producindo millóns de quistes que conteñen os cigotos de paredes grosas, que se denomimas ooquistes.
Liberación de ooquistes polos félidos
editarAs células epiteliais infectadas poden finalmente romper e liberar ooquistes no lume intestinal, polo que se mesturan coas feces do gato.[26] Os ooquistes poden así liberarse no solo, auga, comida ou calquera cousa que se poida contaminar coas feces do gato. Os ooquistes son moi resistentes e poden sobrevivir e permanecer infectivos durante moitos meses en climas fríos e secos.[27]
A inxestión de ooquistes polos humanos ou outros animais de sangue quente é unha das rutas máis comúns de infección.[8] Os humanos poden ser expostos aos ooquistes, por exemplo, ao consumiren verduras sen lavar ou auga contaminada, ou por manipular as feces (ou as caixas) de gatos infectados.[9][24] Aínda que os gatos poden tamén ser infectados polos ooquistes, son moito menos sensibles a eles que os hóspedes intermedios.[28][29]
Infección inicial no hóspede intermedio
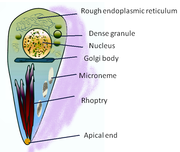
editarCando un humano ou outro animal de sangue quente inxire un ooquiste ou un quiste dos tecidos, a resistente parede do quiste disólvese pola acción de encimas proteolíticos no estómago e intestino delgado, liberando células de T. gondii infecciosas que invaden as células do seu hóspede.[8] Os parasitos invaden primeiro as células do epitelio intestinal que os rodean, e dentro das células, convértese en taquizoítos, que son o estadio motil e de rápida multiplicación celular de T. gondii.[25]
Reprodución asexual no hóspede intermedio
editarDentro das células hóspedes, os taquizoítos replícanse no interior de vacúolos especializados (chamadas vacúolos parasitóforos) formados durante a entrada do parasito na célula.[30] Os taquizoítos multiplícanse dentro deste vacúolo ata que a célula hóspede morre e rompe, liberando e esparexendo os taquizoítos a través da corrente circulatoria sanguínea a todos os órganos e tecidos do corpo, incluíndo o cerebro.[31]
Formación de quistes nos tecidos
editarDespois do período inicial de infección caracterizado pola proliferación de taquizoítos por todo o corpo, a presión exercida polas defensas inmunitarias do hóspede causa que os taquizoítos de T. gondii se convertan en bradizoítos, que é o estadio semi-dormente de reprodución celular lenta do parasito.[32] Dentro das células hóspedes, as agrupacións destes bradizoítos denomínanse quistes dos tecidos. A parede do quiste está formada pola membrana do vacúolo parasitóforo.[33] Aínda que os quistes dos tecidos que conteñen bradizoítos poden formarse en practicamente todos os órganos, son máis comúns e persistentes no cerebro, os ollos, e o músculo estriado (incluíndo o corazón).[33] Porén, os tropismos específicos de tecido poden variar dunha especie hóspede a outra; así, nos porcos, a maioría dos quistes dos tecidos atópanse no tecido muscular, mentres que nos ratos, a maioría están no cerebro.[34]
O tamaño dos quistes xeralmente está entre 5 e 50 µm de diámetro,[35] (como comparación, 50 µm son 2/3 do diámetro dun cabelo humano).[36]
A inxestión de carne con quistes é un dos xeitos principais de transmisión da infección por T. gondii, tanto en humanos coma noutros carnívoros de sangue quente.[37] Os humanos adoitan inxerir os quistes dos tecidos cando consomen carne crúa ou mal cociñada (xeralmente de porco e cordeiro).[38] A inxestión de quistes dos tecidos é tamén a forma principal pola que se infectan os gatos.[39]
Infección crónica
editarOs quistes dos tecidos poden manterse nos tecidos do hóspede durante toda a vida do animal.[40] Pero a presenza continua de quistes parece que se debe a un proceso periódico de rotura de quistes e reenquistamento, e non a que os quistes ou os bradozoítos teñen unha duración da vida moi prolongada.[40] En calquera momento dado nun hóspede infectado cronicamente, están rompendo unha pequena cantidade de quistes,[41] aínda que non se sabe a causa exacta desta rotura.[42]
Teoricamente, T. gondii pode transmitirse entre hóspedes intermedios indefinidamente por medio dun ciclo de consumo de carne con quistes dos tecidos. Porén, o ciclo de vida do parasito empeza e complétase só cando o parasito se transmite a un hóspede félido, que é o único onde o parasito pode realizar a reprodución sexual.[8]
Estadios celulares
editarDurante os diferentes períodos do seu ciclo de vida, o parasito vai pasando por distintos estadios celulares, caracterizados por unha diferente morfoloxía, bioquímica, e comportamento. Estes estadios son: taquizoíto, merozoíto, bradozoíto (que é a forma que se encontra nos quistes dos tecidos), e esporozoíto (que se encontra nos ooquistes).
Taquizoítos
editarOs taquizoítos son móbiles e de multiplicación rápida, e son os responsables de expandir a poboación de parasitos por todo o hóspede.[43] Cando un hóspede inxire un quiste dos tecidos (que contén bradizoítos) ou un ooquiste (que contén esporozoítos), os bradizoítos ou esporozoítos infectan o epitelio intestinal do hóspede e convértense en taquizoítos.[44] Durante o período de infección agudo inicial, os taquizoítos esténdense polo corpo por vía sanguínea.[31] Dururante os estadios finais latentes (crónicos) da infección, os taquizoítos convértense en bradizoítos, que formarán os quistes dos tecidos.
Merozoítos
editarOrixínanse no hóspede definitivo félido. Igual que os taquizoítos, os merozoítos divídense rapidamente, e son responsables de estender a poboación do parasito dentro do intestino dos gatos (ou outros félidos) antes da reprodución sexual.[43] Cando o hóspede félido definitivo inxire un quiste dos tecidos (que contén bradizoítos), os bradizoítos convértense en merozoítos no interior de células epiteliais intestinais. Despois dun breve período de rápido crecemento da poboación no epitelio intestinal, os merozoítos convértense nos estadios sexuais non infecciosos do parasito para realizar a reprodución sexual, o que resulta finalmente na formación de ooquistes que conteñen cigotos.[45]
Bradizoítos
editarOs bradizoítos son o estadio de división lenta do parasito, que orixina os quistes dos tecidos. Cando un hóspede non infectado inxire un quiste dos tecidos, os bradizoítos liberados do quiste infectan as células do epitelio intestinal antes de converterse en taquizoítos proliferativos.[44] Despois do período inicial de proliferación polo corpo do hóspede, os taquizoítos convértense de novo en bradizoítos, que se reproducen dentro das células do hóspede formando os quistes dos tecidos.
Esporozoítos
editarOs esporozoítos son o estadio do parasito que se libera do interior dos ooquistes. Cando un humano ou outro animal de sangue quente inxire ooquistes, libéranse del os esporozoítos, que infectarán as células epiteliais intestinais antes de converterse no taquizoíto proliferativo.[44]
Historia
editarEn 1908, mentres estaba a traballar no Instituto Pasteur na cidade de Tunes, Charles Nicolle e Louis Manceaux descubriron un organismo protozoario nos tecidos dun roedor similar ao hámster da especie Ctenodactylus gundi,[8] que inicialmente pensaron que se trataba do parasito Leishmania, pero que axiña se decataron de que era un organismo novo non descuberto ata entón. Déronlle o nome de Toxoplasma gondii, facendo referencia á súa morfoloxía (Toxo, do grego τόξον, toxon; arco, e πλάσμα, plasma; é dicir, moldeado ou con forma de arco) e co nome da especie do roedor na que foi descuberto, o C. gundi (gondii). O mesmo ano en que Nicolle e Mancaeux descubriron o T. gondii, Alfonso Splendore identificou o mesmo organismo nun coello no Brasil, pero non lle deu nome.[8]
A primeira identificación concluínte de T. gondii en humanos foi nunha meniña que naceu a termo por cesárea en 1938, nun hospital de Nova York.[8] A meniña empezou a ter convulsións aos tres días de idade, e os doutores identificaron lesións na mácula da retina de ambos os ollos. Cando morreu ao mes de idade, realizouse unha autopsia. Atopáronse lesións no cerebro e nos ollos nas que había T. gondii libres ou intracelulares.[8] Os tecidos infectados da meniña foron homoxenizados e inoculados intracerebralmente en coellos e ratos; e seguidamente os animais sufriron encefalite. Posteriormente, atopáronse casos de transmisión conxénita en numerosas especies, especialmente en ovellas e roedores.
A posibilidade de transmisión de T. gondii por medio do consumo de carne pouco cociñada foi proposta primeiramente por D. Weinman e A.H Chandler en 1954.[8] En 1960, observouse que a parede do quiste dos quistes dos tecidos era disolta por encimas proteolíticos que se encontran no estómago, o que facía que liberasen os bradizoítos infecciosos no estómago (e despois no intestino). A hipótese da transmisión por medio do consumo de carne pouco cociñada foi probada nun orfanato en París en 1965; as taxas anuais de adquisición de infección por T. gondii eleváronse do 10% ao 50% despois de engadir dúas porcións de carne bovina ou equina pouco cociñada na dieta diaria dos orfos, e ao 100% despois de engadir costeletas de año pouco feitas.[8]
En 1959, un estudo feito en Bombai encontrou que a prevalencia de T. gondii en vexetarianos estritos era moi similar á dos non vexetarianos. Isto indicou a posibilidade que que houbese unha terceira ruta importante de infección, ademais da conxénita e da carnívora.[8] En 1970, descubriuse a existencia de ooquistes nas feces dos gatos, e demostrouse a ruta fecal-oral de infección por medio de ooquistes.[8]
Nas décadas de 1970 e 1980 examinouse nun gran número de especies a súa capacidade de liberar ooquistes despois de ser infectadas. Atopouse que 17 especies de félidos podían liberar ooquistes, pero ningún animal non félido mostrou ser permisivo á reprodución sexual de T. gondii no seu corpo e á posterior liberación de ooquistes.[8]
Notas
editar- ↑ Weiss, Louis M. & Kami Kim, eds. (2011) Toxoplasma Gondii: The Model Apicomplexan. Perspectives and Methods. Academic Press/Elsevier, London. p. 49
- ↑ J.P Dubey (2010) p. 1
- ↑ "CDC – About Parasites". Consultado o 12 March 2013.
- ↑ Pappas, G; Roussos, N; Falagas, ME (2009 Oct). "Toxoplasmosis snapshots: global status of Toxoplasma gondii seroprevalence and implications for pregnancy and congenital toxoplasmosis.". International Journal for Parasitology 39 (12): 1385–94. PMID 19433092. doi:10.1016/j.ijpara.2009.04.003.
- ↑ 5,0 5,1 "CDC Parasites – Toxoplasmosis (Toxoplasma infection) – Disease". Consultado o 12 March 2013.
- ↑ 6,0 6,1 J.P Dubey (2010) p. 77
- ↑ 7,0 7,1 7,2 7,3 Tenter, AM; Heckeroth, AR; Weiss, LM (2000 Nov). "Toxoplasma gondii: from animals to humans". International Journal for Parasitology 30 (12–13): 1217–58. PMC 3109627. PMID 11113252. doi:10.1016/S0020-7519(00)00124-7.
- ↑ 8,00 8,01 8,02 8,03 8,04 8,05 8,06 8,07 8,08 8,09 8,10 8,11 8,12 Dubey, JP (2009 Jul 1). "History of the discovery of the life cycle of Toxoplasma gondii". International Journal for Parasitology 39 (8): 877–82. PMID 19630138. doi:10.1016/j.ijpara.2009.01.005.
- ↑ 9,0 9,1 9,2 9,3 9,4 Kapperud, G; Jenum, PA; Stray-Pedersen, B; Melby, KK; Eskild, A; Eng, J (1996 Aug 15). "Risk factors for Toxoplasma gondii infection in pregnancy. Results of a prospective case-control study in Norway". American Journal of Epidemiology 144 (4): 405–12. PMID 8712198. doi:10.1093/oxfordjournals.aje.a008942.
- ↑ 10,0 10,1 Jones, JL; Dargelas, V; Roberts, J; Press, C; Remington, JS; Montoya, JG (2009 Sep 15). "Risk factors for Toxoplasma gondii infection in the United States". Clinical infectious diseases : an official publication of the Infectious Diseases Society of America 49 (6): 878–84. PMID 19663709. doi:10.1086/605433.
- ↑ 11,0 11,1 11,2 Cook, AJ; Gilbert, RE; Buffolano, W; Zufferey, J; Petersen, E; Jenum, PA; Foulon, W; Semprini, AE; Dunn, DT (2000 Jul 15). "Sources of toxoplasma infection in pregnant women: European multicentre case-control study. European Research Network on Congenital Toxoplasmosis". BMJ (Clinical research ed.) 321 (7254): 142–7. PMC 27431. PMID 10894691. doi:10.1136/bmj.321.7254.142.
- ↑ Sakikawa, M; Noda, S; Hanaoka, M; Nakayama, H; Hojo, S; Kakinoki, S; Nakata, M; Yasuda, T; Ikenoue, T; Kojima, T (2012 Mar). "Anti-Toxoplasma antibody prevalence, primary infection rate, and risk factors in a study of toxoplasmosis in 4,466 pregnant women in Japan". Clinical and vaccine immunology : CVI 19 (3): 365–7. PMC 3294603. PMID 22205659. doi:10.1128/CVI.05486-11.
- ↑ Gallas-Lindemann, C.; Sotiriadou, I.; Mahmoodi, M. R.; Karanis, P. (2013). "Detection of Toxoplasma gondii oocysts in different water resources by Loop Mediated Isothermal Amplification (LAMP)". Acta Tropica 125 (2): 231–236. doi:10.1016/j.actatropica.2012.10.007. PMID 23088835.
- ↑ Alvarado-Esquivel, C.; Liesenfeld, O.; Márquez-Conde, J. A.; Estrada-Martínez, S.; Dubey, J. P. (2010). "Seroepidemiology of Infection with Toxoplasma gondii in Workers Occupationally Exposed to Water, Sewage, and Soil in Durango, Mexico". Journal of Parasitology 96 (5): 847–850. doi:10.1645/GE-2453.1. PMID 20950091.
- ↑ Esmerini, P. C. O.; Gennari, S. M.; Pena, H. F. J. (2010). "Analysis of marine bivalve shellfish from the fish market in Santos city, São Paulo state, Brazil, for Toxoplasma gondii". Veterinary Parasitology 170 (1–2): 8–13. doi:10.1016/j.vetpar.2010.01.036. PMID 20197214.
- ↑ Dattoli, V. C. C.; Veiga, R. V.; Cunha, S. S.; Pontes-De-Carvalho, L.; Barreto, M. L.; Alcantara-Neves, N. M. (2011). "Oocyst Ingestion As an Important Transmission Route of Toxoplasma gondii in Brazilian Urban Children". Journal of Parasitology 97 (6): 1080–1084. doi:10.1645/GE-2836.1. PMID 21740247.
- ↑ Bobić, B; Jevremović, I; Marinković, J; Sibalić, D; Djurković-Djaković, O (1998 Sep). "Risk factors for Toxoplasma infection in a reproductive age female population in the area of Belgrade, Yugoslavia". European journal of epidemiology 14 (6): 605–10. PMID 9794128. doi:10.1023/A:1007461225944.
- ↑ Jones, J. L.; Dargelas, V.; Roberts, J.; Press, C.; Remington, J. S.; Montoya, J. G. (2009). "Risk Factors forToxoplasma gondiiInfection in the United States". Clinical Infectious Diseases 49 (6): 878–884. doi:10.1086/605433. PMID 19663709.
- ↑ Webster, JP (2007 May). "The effect of Toxoplasma gondii on animal behavior: playing cat and mouse". Schizophrenia bulletin 33 (3): 752–6. PMC 2526137. PMID 17218613. doi:10.1093/schbul/sbl073.
- ↑ 20,0 20,1 20,2 Webster, JP; Kaushik, M; Bristow, GC; McConkey, GA (2013 Jan 1). "Toxoplasma gondii infection, from predation to schizophrenia: can animal behaviour help us understand human behaviour?". The Journal of experimental biology 216 (Pt 1): 99–112. PMC 3515034. PMID 23225872. doi:10.1242/jeb.074716.
- ↑ 21,0 21,1 Berdoy, M; Webster, JP; Macdonald, DW (2000 Aug 7). "Fatal attraction in rats infected with Toxoplasma gondii". Proceedings. Biological sciences / the Royal Society 267 (1452): 1591–4. PMC 1690701. PMID 11007336. doi:10.1098/rspb.2000.1182.
- ↑ McConkey, GA; Martin, HL; Bristow, GC; Webster, JP (2013 Jan 1). "Toxoplasma gondii infection and behaviour – location, location, location?". The Journal of experimental biology 216 (Pt 1): 113–9. PMC 3515035. PMID 23225873. doi:10.1242/jeb.074153.
- ↑ Flegr, J (2013 Jan 1). "Influence of latent Toxoplasma infection on human personality, physiology and morphology: pros and cons of the Toxoplasma-human model in studying the manipulation hypothesis". The Journal of experimental biology 216 (Pt 1): 127–33. PMID 23225875. doi:10.1242/jeb.073635.
- ↑ 24,0 24,1 Louis M Weiss, Kami Kim (2011) p. 2
- ↑ 25,0 25,1 Louis M Weiss, Kami Kim (2011) p. 39
- ↑ J.P Dubey (2010) p. 22
- ↑ Dubey, JP; Ferreira, LR; Martins, J; Jones, JL (2011 Oct). "Sporulation and survival of Toxoplasma gondii oocysts in different types of commercial cat litter". The Journal of parasitology 97 (5): 751–4. PMID 21539466. doi:10.1645/GE-2774.1.
- ↑ Dubey, JP (1998 Jul). "Advances in the life cycle of Toxoplasma gondii". International Journal for Parasitology 28 (7): 1019–24. PMID 9724872. doi:10.1016/S0020-7519(98)00023-X.
- ↑ J.P Dubey (2010) p. 107
- ↑ Louis M Weiss, Kami Kim (2011) pp. 23–29
- ↑ 31,0 31,1 Louis M Weiss, Kami Kim (2011) pp. 39–40
- ↑ Miller, CM; Boulter, NR; Ikin, RJ; Smith, NC (2009 Jan). "The immunobiology of the innate response to Toxoplasma gondii". International Journal for Parasitology 39 (1): 23–39. PMID 18775432. doi:10.1016/j.ijpara.2008.08.002.
- ↑ 33,0 33,1 Louis M Weiss, Kami Kim (2011) p. 343
- ↑ Louis M Weiss, Kami Kim (2011) p. 41
- ↑ "CDC Toxoplasmosis – Microscopy Findings". Arquivado dende o orixinal o 06 de novembro de 2013. Consultado o 13 March 2013.
- ↑ Clarence R. Robbins (24 February 2012). Chemical and Physical Behavior of Human Hair. Springer. p. 585. ISBN 978-3-642-25610-3. Consultado o 12 March 2013.
- ↑ Louis M Weiss, Kami Kim (2011) p. 3
- ↑ Jones, JL; Dubey, JP (2012 Sep). "Foodborne toxoplasmosis". Clinical infectious diseases : an official publication of the Infectious Diseases Society of America 55 (6): 845–51. PMID 22618566. doi:10.1093/cid/cis508.
- ↑ J.P Dubey (2010) p. 46
- ↑ 40,0 40,1 Louis M Weiss, Kami Kim (2011) p. 580
- ↑ Louis M Weiss, Kami Kim (2011) p. 45
- ↑ J.P Dubey (2010) p. 47
- ↑ 43,0 43,1 Louis M Weiss, Kami Kim (2011) p. 19
- ↑ 44,0 44,1 44,2 Louis M Weiss, Kami Kim (2011) p. 359
- ↑ Louis M Weiss, Kami Kim (2011) p. 306
Véxase tamén
editarBibliografía
editar- Louis M Weiss; Kami Kim (28 April 2011). Toxoplasma Gondii: The Model Apicomplexan. Perspectives and Methods. Academic Press. ISBN 978-0-08-047501-1. Consultado o 12 March 2013.
- J. P. Dubey (15 April 2010). Toxoplasmosis of Animals and Humans, Second Edition. CRC Press. ISBN 978-1-4200-9237-0. Consultado o 12 March 2013.
Ligazóns externas
editar- ToxoDB : The Toxoplasma gondii genome resourceArquivado 05 de marzo de 2019 en Wayback Machine.
- Toxoplasma images, do CDC's DPDx, de dominio público
- Toxoplasmosis Research Institute & CenterArquivado 17 de outubro de 2013 en Wayback Machine.
- Cytoskeletal Components of an Invasion Machine – The Apical Complex of Toxoplasma gondii
- The Culture-Shaping Parasites, en Seed Magazine
- Toxoplasma overview, developmental stages, life cycle image at MetaPathogen
- Toxoplasma gondii in the Subarctic and Arctic
- The T.Gondii host/pathogen interactome
- Toxoplasmosis – Recent advances, Libro de libre acceso publicado en 2012
- Toxoplasma gondii, the Immune System, and Suicidal Behaviour