Cromatografía líquida de alto rendemento
A cromatografía líquida de alto rendemento, xeralmente abreviada HPLC (do inglés High-performance liquid chromatography), anteriormente denominada cromatografía líquida de alta presión, é unha técnica de laboratorio de química analítica usada para separar, identificar e cuantificar cada compoñente nunha mestura. A técnica recibe tamén outros diversos nomes na literatura internacional, como cromatografía líquida/de líquidos/en fase líquida de alta eficacia/eficiencia/resolución. A técnica baséase no uso de bombas para facer pasar un solvente líquido presurizado que contén a mestura da mostra a través dunha columna, que está chea dun material adsorbente sólido. Cada compoñente da mostra interacciona de xeito lixeiramente diferente co material adsorbente, causando diferentes velocidades de fluxo para diferentes compoñentes e orixinando a separación dos compoñentes a medida que estes flúen saíndo da columna.

A HPLC foi utilizada para fabricar produtos (por exemplo, durante o proceso de produción de produtos farmacéuticos ou biolóxicos), ten usos legais (por exemplo, para detectar drogas dopantes que aumentan o rendemento ou de abuso en urina), en investigación (por exemplo, separar os compostos dunha mostra biolóxica complexa, ou separar substancias químicas similares unhas das outras), e usos médicos (por exemplo, a detección dos niveis de vitamina D no soro sanguíneo).[1]
Unha cromatografía pode describirse como un proceso de transferencia en masa que implica a adsorción. A HPLC require o uso de bombas para facer pasar un líquido presurizado e a mestura da mostra a través dunha columna chea co adsorbente, o que causa a separación dos compoñentes da mostra. O compoñente activo da columna, o adsorbente, é normalmente un material granular feito de partículas sólidas (por exemplo, sílice, polímeros etc.), dun tamaño de 2 a 50 μm. Os compoñentes da mestura da mostra sepáranse uns dos outros debido aos seus diferentes graos de interacción coas partículas do adsorbente. O líquido presurizado adoita ser unha mestura de solventes (por exemplo, auga, acetonitrilo e/ou metanol) e denomínase "fase móbil". A súa composición e temperatura xogan un papel principal no proceso de separación ao influíren nas interaccións que teñen lugar entre os compoñentes da mostra e o adsorbente. Estas interaccións son de natureza física, como as hidrófobas (dispersivas), dipolo–dipolo e iónicas, ou, máis frecuentemente, unha combinación delas.
A HPLC distínguese da tradicional cromatografía líquida ("de baixa presión") porque as presións ás que opera son significativamente maiores (50–350 bar), mentres que a cromatografía líquida ordinaria normalmente depende da forza da gravidade para que a fase móbil pase a través da columna. Debido á pequena cantidade de mostra separada nunha HPLC analítica, as dimensións dunha columna típica son de 2,1–4,6 mm de diámetro e 30–250 mm de longo. Ademais as columnas de HPLC están feitas con partículas adsorbentes máis pequenas (de 2–50 μm como media de tamaño da partícula). Isto dálle á HPLC un poder de resolución superior (a capacidade de distinguir entre compostos) á hora de separar os compoñentes de mesturas, o que fixo que se convertese nunha técnica cromatográfica moi utilizada.
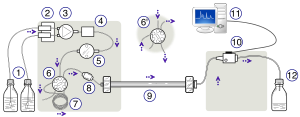
O esquema dun aparello de HPLC consta normalmente dun desgasificador, mostreador, bombas e un detector. O mostreador leva a mestura da mostra ao fluxo de fase móbil que a transporta pola columna. A bomba introduce o fluxo desexado e a composición da fase móbil na columna. O detector xera un sinal proporcional á cantidade de compoñentes da mostra que saen da columna, polo que permite unha análise cuantitativa dos compoñentes da mostra. Un microprocesador dixital e software de usuario controlan o aparello de HPLC e proporcionan datos da análise. Algúns modelos de bombas mecánicas no instrumento de HPLC poden mesturar múltiples solventes en proporcións que poden cambiar co tempo, xerando un gradiente de composición na fase móbil. Úsanse comunmente varios detectores, como os UV/Vis (ultravioleta/visible), os de matriz de fotodíodos (PDA) ou os baseados en espectrometría de masas. A maioría dos aparellos de HPLC tamén teñen un forno da columna que permite axustar a temperatura á que se produce a separación.
Funcionamento
editarA mestura da mostra que vai ser separada e analizada introdúcese nun volume pequeno discreto (normalmente microlitros) na corrente de líquido da fase móbil que percola a través da columna. Os compoñentes da mostra móvense pola columna a diferentes velocidades, que están en función das interaccións físicas específicas co adsorbente (tamén chamado fase estacionaria). A velocidade de cada compoñente depende da súa natureza química, da natureza da fase estacionaria (columna) e da composición da fase móbil. O tempo ao cal un analito determinado elúe (sae da columna) denomínase tempo de retención. O tempo de retención medido en condicións determinadas é unha característica identificadora dun analito dado.
Existen moitos tipos de columnas, cheas de adsorbentes que varían no tamaño da partícula e na natureza da súa superficie ("química de superficie"). O uso de materiais de empaquetado de tamaño de partícula máis pequeno require o uso dunha maior presión operacional ("presión traseira" ou "backpressure") e normalmente mellora a resolución cromatográfica (o grao da separación de picos entre analitos consecutivos que saen da columna). As partículas adsorbentes poden ser hidrófobas ou polares.
As fases móbiles comúns utilizadas son calquera combinación miscible de auga con varios solventes orgánicos (os máis comúns son acetonitrilo e metanol). Algunhas técnicas de HPLC usan fases móbiles sen auga (ver cromatografía en fase normal máis abaixo). O compoñente acuoso da fase móbil pode conter ácidos (como o fórmico, fosfórico ou trifluoroacético) ou sales para axudar na separación dos compoñentes da mostra. A composición da fase móbil pode manterse constante ("modo de elución isocrático") ou variar ("modo de elución de gradiente") durante a análise cromatográfica. A elución isocrática é xeralmente efectiva para a separación de compoñentes da mostra que son moi diferentes nas súas afinidades pola fase estacionaria. Na elución de gradiente a composición da fase móbil varíase normalmente desde unha baixa a unha alta forza de elución. A forza de elución da fase móbil reflíctese polos tempos de retención do analito, xa que con alta forza de elución prodúcese unha rápida elución (=tempos de retención curtos). Un perfil de gradiente típico en cromoatografía en fase inversa pode empezar cun 5% de acetonitrilo (en auga ou tampón acuoso) e progresa linearmente a un 95% de acetonitrilo en 5–25 minutos. Poden formar parte do perfil períodos con composición constante da fase móbil. Por exemplo, a composición da fase móbil pode manterse constante a un 5% de acetonitrilo durante 1–3 min, seguido dun cambio linear ata un 95% de acetonitrilo.
A composición elixida da fase móbil (tamén chamada eluente) depende da intensidade das interaccións entre os diversos compoñentes da mostra ("analitos") e da fase estacionaria (por exemplo, interaccións hidrófobas na HPLC en fase inversa). Dependendo da súa afinidade polas fases estacionarias e móbil así se producirá a partición dos analitos entre as dúas durante o proceso de separación que ten lugar na columna. Este proceso de partición é similar ao que ocorre durante unha extracción líquido-líquido pero é continua, non por etapas. Neste exemplo, usando un gradiente de auga/acetonitrilo, eluirán ao final os compoñentes hidrófobos (sairán da columna), unha vez que a fase móbil se fai máis concentrada en acetonitrilo, é dicir, nunha fase móbil de maior forza de elución.
A elección dos compoñentes da fase móbil, os aditivos (como sales ou ácidos) e as condicións do gradiente dependen da natureza dos compoñentes da mostra e da columna. Adoitan facerse unha serie de cromatografías de ensaio coa mostra para atopar o método de HPLC que rende unha separación axeitada.
Historia e desenvolvemento
editarAntes da aparición da HPLC os científicos utilizaban as técnicas estándar de cromatografía líquida. Os sistemas de cromatografía líquida eran bastante pouco eficientes debido a que a velocidade do fluxo dos solventes dependía da gravidade. As separacións tardaban moitas horas, e ás veces días completos. Naquela época a cromatografía de gases (GC) era máis poderosa que a cromatografía líquida (LC), pero críase que a separación en fase gasosa e a análise de biopolímeros de elevado peso molecular moi polares era imposible.[3] A cromatografía de gases non era efectiva debido á inestabilidade térmica dos solutos.[4] Como resultado, hipotetizáronse métodos alternativos que acabarían desembocando no desenvolvemento da HPLC.
Despois dos traballos pioneiros de Martin e Synge en 1941, os científicos Cal Giddings, Josef Huber e outros predixeron na década de 1960 que a cromatografía líquida podía funcionar nun modo de alta eficiencia reducindo o diámetro das partículas substancialmente por debaixo do nivel de 150 μm usado na cromatografía líquida típica (e na cromatografía de gases) e usando presión para incrementar a velocidade da fase móbil.[3] Estas predicións foron amplamente experimentadas e refinadas durante as décadas de 1960 e 1970. As primeiras investigacións para o seu desenvolvemento empezaron a mellorar as partículas de cromatografía líquida, e a invención de Zipax, unha partícula de superficie porosa, era moi prometedora para a tecnoloxía da HPLC.[5]
Na década de 1970 houbo moitos desenvolvementos en hardware e instrumentos. Empezaron a usarse bombas e inxectores para facer un deseño rudimentario dun sistema de HPLC.[6] As bombas amplificadoras de gases foron ideais porque funcionan a presión constante e non requiren selos impermeables ou válvulas de comprobación para que haxa un fluxo estable e unha boa cuantificación.[4] Fixéronse avances importantes en hardware en Dupont IPD (Industrial Polymers Division), como o dispositivo de gradiente de volume de pausa baixa (low-dwell-volume gradient) utilizado patra substituír o inxector de septo por unha válvula de bucle de inxección.[4]
Aínda que os desenvolvementos nos instrumentos foron importantes, a historia da HPLC é principalmente a historia e evolución da tecnoloxía das partículas.[4] Despois da introdución das partículas de capa porosa, houbo unha constante tendencia a reducir o tamaño das partículas para mellorar a eficiencia.[4] Porén, ao diminuír o seu tamaño xurdiron novos problemas. Orixináronse desvantaxes prácticas pola excesiva caída de presión necesaria para forzar o paso do fluído móbil a través da columna e a dificultade de preparar un empacado uniforme de materiais tan extremadamente finos.[7] Cada vez que o tamaño das partículas se reducía significativamente, debía haber outra rolda de desenvolvemento de instrumentos para manexar debidamente a presión.[4]
Tipos
editarCromatografía de partición
editarA cromatografía de partición foi un dos primeiros tipos de cromatografía que se desenvolveu en química.[8] O principio do coeficiente de partición aplicouse á cromatografía en papel, cromatografía en capa fina, separación líquido-líquido e en fase de gas. En 1952 o Premio Nobel de Química recibírono Archer John Porter Martin e Richard Laurence Millington Synge polo seu desenvolvemento desta técnica, que usaron para a separación de aminoácidos.[9] A cromatografía de partición utiliza un solvente retido sobre a superficie ou dentro de grans ou fibras dunha matriz de soporte sólida "inerte" como coa cromatografía en papel; ou aproveita algunhas interaccións coulómbicas (electrostáticas) e/ou de doantes de hidróxeno coa fase estacionaria. A partición das moléculas de analito prodúcese entre unha fase líquida estacionaria e o eluente. Igual que na cromatografía de interacción hidrófila (HILIC; unha subtécnica da HPLC), este método separa analitos baseándose en diferenzas na súa polaridade. A HILIC adoita usar unha fase estacionaria polar unida e unha fase móbil constituída principalmente por acetonitrilo con auga como compoñente forte. A HPLC de partición foi utilizada historicamente con soportes de alúmina ou sílice non unidos. Cada un funciona con efectividade separando analitos por diferenzas polares relativas. As fases unidas da HILIC teñen a vantaxe de separar solutos ácidos, básicos e neutros nun só experimento de cromatografía.[10]
Os analitos polares difunden nunha capa de auga estacionaria asociada coa fase estacionaria polar e así quedan retidos. Canto máis fortes sexan as interaccións entre o analito polar e a fase estacionaria polar (en relación coa fase móbil) máis longo é o tempo de elución. A forza de interacción depende dos grupos funcionais que forman parte da estrutura molecular do analito, e os grupos máis polarizados (por exemplo, hidroxilo) e os grupos que poden establecer enlaces de hidróxeno inducen máis retención. As interaccións coulómbicas (electrostáticas) poden tamén incrementar a retención. O uso de solventes máis polares na fase móbil fai diminuír o tempo de retención de analitos, mentres que solventes máis hidrófobos tenden a incrementar os tempos de retención.
Cromatografía en fase normal
editarA cromatografía en fase normal foi un dos primeiros tipos de HPLC que se desenvolveu. Tamén se coñece como HPLC en fase normal ou NP-HPLC e é un método que separa os analitos baseándose na súa afinidade por unha superficie estacionaria polar como a sílice, polo que está baseada na capacidae do analito de establecer interaccións polares (como enlaces de hidróxeno ou interaccións dipolo-dipolo) coa superficie do sorbente. A NP-HPLC usa unha fase móbil non acuosa e non polar (por exemplo, cloroformo), e funciona separando analitos facilmente solubles en solventes non polares. O analito asóciase coa fase estacionaria polar e é retido por ela. As forzas de adsorción increméntanse co aumento da polaridade do analito. A forza de interacción non só depende dos grupos funcionais presentes na estrutura da molécula de analito, senón tamén de factores estéricos. O efecto dos impedimentos estéricos sobre a forza de interacción permite que este método resolva (separe) mesmo isómeros estruturais.
O uso de solventes máis polares na fase móbil incrementará o tempo de retención dos analitos, mentres que os solventes máis hidrófobos tenden a inducir unha elución máis rápida (diminúen os tempos de retención). Os solventes moi polares como as trazas de auga na fase móbil tenden a adsorberse á superficie sólida da fase estacionaria formando unha capa unida estacionaria (de auga) que se considera que ten un papel activo na retención. Este comportamento é algo peculiar da cromatografía en fase normal porque está gobernado case exclusivamente por un mecanismo adsortivo (é dicir, os analitos interaccionan cunha superficie sólida en vez de coa capa solvatada dun ligando unido á superficie sorbente; ver tamén HPLC en fase inversa máis abaixo). A cromatografía de adsorción aínda se usa moito para separacións de isómeros estruturais tanto nos formatos de cromatografía en columna ou en capa fina en soportes de sílice activada (seca) ou alúmina.
A HPLC de partición e a NP-HPLC deixaron de ter o favor dos investigadores na década de 1970 debido ao desenvolvemento da HPLC en fase inversa debido á súa mala reproducibilidade dos tempos de retención, debido á presenza dunha capa solvente de auga ou orgánica prótica na superficie do medio cromatográfico de sílice ou alúmina. Esta capa cambia con calquera cambio na composición da fase móbil (por exemplo, o nivel de humidade) causando variacións nos tempos de retención.
Recentemente, a cromatografía de partición fíxose popular de novo entre os científicos co desenvolvemento das fases unidas de HILIC, que demostraron ter unha mellor reproducibilidade, e debido a unha mellor comprensión do rango de utilidade desta técnica.
Cromatografía de desprazamento
editarO principio básico da cromatografía de desprazamento é: unha molécula cunha alta afinidade pola matriz de cromatografía (o desprazador) compite polos sitios de unión, e deste modo despraza todas as moléculas que teñan menor afinidade.[11] Hai claras diferenzas entre a cromatografía de desprazamento e a de elución. No modo de elución, as substancias normalmente saen da columna en picos gaussianos estreitos. Unha separación ampla dos picos, preferiblemente na liña de base, é o desexado para conseguir a máxima purificación. A velocidade á que un compoñente da mestura viaxa pola columna no modo de elución depende de moitos factores. Pero para dúas substancias que viaxan a diferentes velocidades, e, por conseguinte, son resoltas, debe haber diferenzas substanciais nalgunhas interaccións entre as biomoléculas e a matriz cromatográfica. Os parámetros que operan están axustados para maximizar o efecto desta diferenza. En moitos casos, a separación na liña de base dos picos pode consegirse só con elución de gradiente e cargas de produto introducido na columna baixas. Así, dous inconvenientes da cromatografía en modo de elución, especialmente a escala preparativa, son a súa complexidade de funcionamento, debido ao bombeo do solvente de gradiente, e o baixo rendemento, debido ás cargas baixas introducidas na columna. A cromatografía de desprazamento ten vantaxes sobre a cromatografía de elución como que os compoñentes son resoltos en zonas consecutivas de substancias puras en vez de en “picos”. Como o proceso aproveita a non lineariedade das isotermas, nunha columna dada pode facerse a separación cunha alimentación máis grande da columna e os compoñentes purificados recuperados están a unha concentración significativamene máis alta.
Cromatografía en fase inversa (RPC)
editar- Véxase tamén: Cromatografía en fase inversa.
A HPLC en fase inversa (RP-HPLC ou reverse-phase-HPLC) ten unha fase estacionaria non polar e unha fase móbil acuosa moderadamente polar. Unha fase estacionaria común é a sílice coa superficie modificada con RMe2SiCl, onde R é un grupo alquilo de cadea recta como o C18H37 ou o C8H17. Con esas fases estacionarias, o tempo de retención é máis longo para moléculas que son menos polares, mentres que as moléculas polares elúen máis facilmente (saen antes na análise). Pódense incrementar os tempos de retención engadindo máis auga á fase móbil, o que fai máis forte a afinidade do analito hidrófobo pola fase estacionaria hidrófoba en relación á fase móbil agora máis hidrófila. De xeito similar, pódense diminuír os tempo de retención engadindo máis solvente orgánico ao eluente. A RP-HPLC úsase tan comunmente nos laboratorios que moitas veces é denominada incorrectamente como "HPLC" sen máis especificacións. A industria farmacéutica emprega correntemente a RP-HPLC para a cualificación de fármacos antes da súa comercialiación.
A RP-HPLC funciona baseándose no principio das interaccións hidrófobas, que se orixinan pola alta simetría na estrutura dipolar da auga e xogan o papel máis importante en todos os procesos das ciencias da vida. A RP-HPLC permite a medida destas forzas interactivas. A unión do analito á fase estacionaria é proporcional á área da superficie de contacto arredor do segmento non polar da molécula do analito despois da asociación co ligando na fase estacionaria. Este efecto solvofóbico está dominado pola forza da auga para a "redución de cavidades" arredor do analito e da cadea C18 en comparación co complexo de ambos. A enerxía liberada neste proceso é proporcional á tensión superficial do eluente (auga: 7,3−6 J/cm², metanol: 2,2−6 J/cm²) e á superficie hidrófoba do analito e do ligando, respectivamente. A retención pode diminuírse engadindo un solvente menos polar (metanol, acetonitrilo) á fase móbil para reducir a tensión superficial da auga. A elución de gradiente usa este efecto para reducir automaticamente a polaridade e a tensión superficial da fase móbil acuosa durante o curso da análise.
As propiedades estruturais da molécula de analito son moi importantes nas súas características de retención. En xeral, un analito cunha área superficial hidrófoba máis grande (C–H, C–C e xeralmente enlaces atómicos non polares, como o S-S e outros) é retido máis tempo porque non interacciona coa estrutura da auga. Por outra parte, os analitos con área superficial polar maior (debido á presenza na súa estrutura de grupos polares, como o -OH, -NH2, COO− ou -NH3+) son menos retidos, xa que están menos integrados na auga. Tales interaccións está suxeitas a efectos estéricos porque esas moléculas moi grandes só poden ter un acceso restrinxido aos poros da fase estacionaria, onde teñen lugar as interaccións con ligandos de superficie (cadeas alquilo). Tales impedimentos da superficie causan unha menor retención.
O tempo de retención increméntase cunha área superficial hidrófoba (non polar). Os compostos de cadea ramificada elúen máis rapidamente que os seus isómeros liñais correspondentes porque a área superficial global diminuíu. Igualmente, os compostos orgánicos con enlaces simples C–C elúen máis tarde que os que teñen enlaces dobres (C=C) ou triplos (C≡C), xa que os enlaces dobres ou triplos son máis curtos que o simple (C–C).
Ademais da tensión superficial da fase móbil (forza organizacional na estrutura do eluente), outros modificadores da fase móbil poden afectar á retención do analito. Por exemplo, a adición de sales inorgánicos causa un incremento linear moderado na tensión superficial das solucións acuosas (preto de 1,5−7 J/cm² por Mol para o NaCl, 2,5−7 J/cm² por Mol para o (NH4)2SO4), e como a entropía da interfase analito-solvente está controlada pola tensión superficial, a adicion de sales tende a incementar o tempo de retención. Esta técnica utilízase para unha separación suave e recuperación de proteínas e protección das súas actividades biolóxicas en análises de proteínas (cromatografía de interacción hidrófoba, HIC).
Outro importante factor é o pH da fase móbil, xa que pode cambiar o carácter hidrófobo do analito. Por esta razón a maioría dos métodos usan un axente tamponante, como o fosfato de sodio, para controlaren o pH. Os tampóns serven para múltiples cousas: control do pH, neutralización da carga na superficie da sílice da fase estacionaria e actúan como axentes de emparellamento de ións para neutralizaren a carga do analito. O formiato amónico engádese habitualmente na espectrometría de masas para mellorar a detección de certos analitos pola formación de adutos de analito-amonio. A miúdo engádese á fase móbil un ácido orgánico volátil como o ácido acético, ou máis frecuentemente o ácido fórmico se se utiliza a espectrometría de masas para analizar o eluente da columna. O ácido trifluoroacético utilízase infrecuentemente en aplicacións de espectroscopía de masas debido á súa persistencia no detector e no sistema de introdución do solvente, pero pode ser efectivo para mellorar a retención de analitos como os ácidos carboxílicos en aplicacións que utilizan outros detectores, xa que é un ácido orgánico bastante forte. Os efectos dos ácidos e tampóns varían segundo a aplicación, mais en xeral mellorarn a resolución cromatográfica.
As columnas de fase inversa son bastante difíciles de danar comparadas coas columnas de sílice normais; porén, moitas columnas de fase inversa constan de partículas de silice modificadas con alquilo e nunca deberían usarse con bases acuosas, xa que estas destruirían as partículas de sílice subxacentes. Poden utilizarse con ácidos acuosos, pero a columna non debería expoñerse ao ácido durante demasiado tempo, xa que este pode corroer as partes metálicas do equipo de HPLC. As columnas de RP-HPLC deberían ser lavadas cun solvente limpo despois do seu uso para eliminar ácidos residuais e tampóns, e almacenadas cun solvente coa composición axeitada. O contido metálico das columnas de HPLC debe manterse baixo se se quere que conserve as maiores capacidades posibles para separar substancias. Un bo test para o contido metálico dunha columna é inxectar unha mostra que é unha mestura de 2,2'- e 4,4'-bipiridina. Como a 2,2'-bipiridina pode quelar o metal, a forma do pico para a 2,2'-bipiridina será distorsionado (coa parte final máis ancha ou con máis "cola") cando están pesentes ións metálicos na superficie da silice.[Cómpre referencia]
Cromatografía de exclusión por tamaño
editarA cromatografía de exclusión por tamaño (SEC), tamén coñecida como cromatografia de permeación de xel ou cromatografía de xelfiltración, separa partículas baseándose no seu tamaño molecular (en realidade o raio de Stokes da partícula). Xeralmente é unha cromatografía de baixa resolución, polo que adoita reservarse para o paso final de perfeccionamento da purificación. Tamén é útil para determinar as terciaria e cuaternaria de proteínas purificadas. A SEC utilízase principalmente para a análise de grandes moléculas como proteínas ou polímeros. Funciona atrapando as moléculas menores nos poros das partículas. As moléculas maiores simplemente son moi grandes para entrar nos poros. As moléculas máis grandes flúen pola columna máis rapidamente que as máis pequenas, é dicr, canto menor é a molécula, maior é o tempo de retención.
Esta técnica é amplamente utilizada para a determinación do peso molecular de polisacáridos. A SEC é a técnica oficial (suxerida na farmacopea europea) para a comparación de pesos moleculares de diferentes heparinas de baixo peso molecular dispoñibles comercialmente.
Cromatografía de intercambio iónico
editarNa cromatografía de intercambio iónico (IC), a retención esta baseada na atracción entre os ións do soluto e os sitios cargados unidos á fase estacionaria. Os ións do soluto coa mesma carga que a que teñen os sitios cargados da columna quedan excluídos da unión na columna, mentres que aqueles de carga oposta á dos sitios cargados da columna quedan retidos na columna. Os ións de soluto que son retidos na colmna poden ser eluídos da columna cambiando as condicións do solvente (por exemplo, incrementando o efecto de ións do sistema solvente incrementando a concentración de sales da solución, incrementando a temperaura da columna, cambiando o pH do solvente etc.).
Entre os tipos de intercambiadores de ións están as resinas de polistireno, celulosa e dextrano (xeles), e sílice porosa ou cristal de proros controlados. As resinas de polistireno permiten enlaces cruzados cun incremento da estabilidade da cadea. Unha maior cantidade de enlaces cruzados reduce a viraxe (swerving), o cal incrementa o tempo de equilibración e finalmente mellora a selectividade. Os intercambiadores de ións de celulosa e dextrano posúen maiores tamaños de poro e baixas densidades de carga, o que os fai axeitados para a separación de proteínas.
En xeral, os intercambiadores de ións favorecen a unión de ións con carga máis alta e raio menor.
Un incremento da concentración do contraión (con respecto ao grupo funcional das resinas) reduce o tempo de retención. Unha diminución no pH reduce o tempo de retención no intercambio de catións, mentres que un incremento no pH reduce o tempo de retención no intercambio de anións. Ao diminuír o pH do solvente nunha columna de intercambio iónico, ocorre por exemplo que quedan dispoñibles máis ións hidróxeno para competir por posicións na fase estacionaria aniónica, polo que elúen os catións debilmente unidos.
Esta forma de cromatografía utilízase moito nas seguintes aplicacións: purificación da auga, preconcentración de compoñenes traza, cromatografía de intercambio de ligandos, cromatografía de intercambio iónico de proteinas, cromatografía de intercambio aniónico de alto pH de carbohidratos e oligosacáridos e outras.
Cromatografía de afinidade
editarA cromatografía de afinidade baséase na propiedade de todas as substancias bioloxicamene activas de formar complexos estables, específicos e reversibles. A formación destes complexos implica a participación de forzas moleculares comúns como as interaccións de Van der Waals, interaccións electrostáticas, interaccións dipolo-dipolo, interaccións hidrófobas e enlaces de hidróxeno. Un enlace bioespecífico eficiente fórmase por unha acción simultánea e concertada de varias destas forzas en sitios de unión complementarios.
Cromatografía en fase normal acuosa
editarA cromatografía en fase normal acuosa (ANP) é unha técnica cromatográfica que implica a rexión da fase móbil entre a cromatografía en fase inversa (RP) e a cromatografía en fase normal orgánica (ONP). Esta técnica utilízase para conseguir unha selectividade exclusiva de compostos hidrófilos, e mostra unha fase de elución normal usando solventes de fase inversa.
Elución isocrática e de gradiente
editarUnha separación na cal a composición da fase móbil permanece constante durante o procedemento denomínase isocrática (o que significa composición constante). Un exemplo sería que a porcentaxe de matanol na fase durante o procedemento permaneza constante, é dicir, por exemplo, sempre ao 10%. A palabra foi acuñada por Csaba Horváth que foi un dos pioneiros da HPLC.[Cómpre referencia],
A composición da fase móbil non ten que permanecer constante. Unha separación na que a composición da fase móbil cambia durante o proceso de separación denomínase elución de gradiente.[12] Un exemplo é que o gradiente empece cun 10% de metanol e acabe cun 90% metanol despois de 20 minutos. Os dous compoñentes da fase móbil son denominados xeralmente "A" e "B"; A é o solvente "débil" que só permite que o soluto elúa lentamente, mentres que B é o solvente "forte" que elúe os solutos rapidamente da columna. Na cromatografía en fase inversa, o solvente A é a miúdo a auga ou un tampón acuoso, mentres que B é un solvente orgánico miscible en auga, como o acetonitrilo, metanol, THF ou isopropanol.
Na elución isocrática, a anchura do pico increméntase co tempo de retención linearmente de acordo coa ecuación para N, que é o número de placas teóricas. Isto ten a desvantaxe de que os picos que elúen ao final son moi planos e anchos, ata o punto que poden non ser recoñecidos como picos.
A elución de gradiente diminúe a retención dos compoñentes que elúen tardiamente para que elúan máis rápido, dando lugar a picos máis estreitos (e altos) para a maioría dos compoñentes. Isto tamén mellora a forma do pico para os picos con cola (parte dereita máis ancha), xa que o incremento da concentración do eluente orgánico empuxa a parte final da cola dun pico cara a adiante. Isto tamén incrementa a altura do pico (o pico parece máis agudo), o cal é importante en análises de trazas. O programa do gradiente pode incluír incrementos repentinos na porcentaxe do compoñente orgánico, ou diferentes incrementos máis graduais en distintos momentos, todo de acordo coa desexada separación óptima no mínimo tempo.
Na elución isocrática, a selectividade non cambia se as dimensións da columna (lonxitude e diámetro interno) cambian, é dicir, os picos elúen na mesma orde. Na elución de gradiente a orde de elución pode cambiar a media que cambian as dimensións ou a velocidade de fluxo.[Cómpre referencia]
A forza impulsora na cromatografía en fase inversa orixínase pola alta ordenación da estrutura da auga. O papel do compoñente orgánico da fase móbil é reducir esta alta ordenación e así reducir a forza retardante do compoñente acuoso.
Parámetros
editarTeóricos
editarAs separacións por HPLC teñen unha serie de parámetros teóricos e ecuacións que describen a separación de compoñentes en picos de sinal cando se detectan polos instrumentos como por un detector de UV ou un espectrómetro de masas. Os parámetros en gran parte derivan de dúas teorías cromatográficas: teoría de placas (parte da cromatografía de partición) e a teoría da velocidade (rate) da cromatografía / ecuación de Van Deemter. Por suposto, póñense en práctica por medio da análise de cromatogramas de HPLC, aínda que a teoría da velocidade se considera a teoría máis exacta.
Son análogos para o cálculo do factor de retención para unha separación en cromatografía en papel, pero describen ata que punto a HPLC separa ben unha mestura en dous ou máis compoñentes que se detectan como picos (bandas) no cromatograma. Os parámetros da HPLC son: o factor de eficiencia (N), o factor de retención (kappa prima) e o factor de separación (alfa). Estes factores son variables dunha ecuación de resolución, que describen o ben que se separan os compoñentes dos picos ou se se solapan entre si. Estes parámetros úsanse só fundamentalmente para describir unha separación por HPLC en fase inversa ou en fase normal, xa que esas separacións tenden a ser máis sutís que outros modos de HPLC (por exemplo, as de intercambio iónico ou de exclusión por tamaño).
O volume baleiro (void volume) é a cantidade de espazo nunha columna que está ocupado polo solvente. É o espazo dentro da columna que está fóra do material empaquetado do interior da columna. O volume baleiro mídese nun cromatograma como o primeiro pico de compoñente detectado, que adoita ser o solvente que estaba presente na mestura da mostra; idealmente o solvente da mostra flúe a través da columna sen interaccionar coa columna, pero aínda pode detectarse como se fose distinto do solvente da HPLC. O volume baleiro utilízase como factor de corrección.
O factor de eficiencia (N) mide na práctica o agudos que son os picos dos compoñentes do cromatograma, como a proporción da área do pico do compoñente ("tempo de retención") en relación coa anchura dos picos no seu punto máis ancho (na liña de base). Os picos que son altos, agudos e relativamente estreitos indican que o método de separación retirou eficientemente o compoñente da mestura, é dicir, alta eficiencia. A eficiencia depende moito da columna de HPLC e do método de HPLC utilizado. O factor de eficiencia é sinónimo de número de placas, e do 'número de placas teóricas'.
O factor de retención (kappa prima) mide canto tempo leva un compoñente da mestura adherido á columna, medido pola área baixo a curva do seu pico no cromatograma (xa que os cromatogramas de HPLC son unha función do tempo). Cada pico do cromatograma ten o seu propio factor de retención (por exemplo, kappa1 para o factor de retención do primeiro pico). Este factor pode ser corrixido polo volume baleiro da columna.
O factor de separación (alfa) é unha comparación relativa do ben que quedaron separados dous compoñentes veciños da mestura (é dicir, dúas bandas veciñas do cromatograma). Este factor defínese como unha razón dos factores de retención dun par de picos veciños do cromatograma e pode tamén corrixirse polo volume baleiro da columna. Canto máis alto sexa o valor do factor de separación por riba de 1,0, mellor será a separación, ata chegar aproximadamenre a 2,0, valor por riba do cal probablemente o método da HPLC non é necesario para facer a separación. As ecuacións de resolución relacionan os tres factores de modo que a alta eficiencia e os factores de separación melloren a resolución de picos de compoñentes nunha separación por HPLC.
Diámetro interno
editarO diámetro interno dunha columna de HPLC é un parámetro importante que inflúe na sensibilidade de detección e selectividade de separación na elución de gradiente. Tamén determina a cantidade de analito que pode cargarse na columna. As columnas máis grandes utilízanse xeralmetne en aplicacións industriais, como a purificación de produtos farmacolóxicos para un uso posterior. As columnas de baixo diámetro interno teñen unha mellor sensibilidade e menor consumo de solvente pero a expensas da capacidade de carga.
As columnas de diámetro interno máis grande (por riba de 10 mm) utilízanse para purificar cantidades usables de material debido á súa gran capacidade de carga.
As columnas de escala analítica (de 4,6 mm) foron ata agora o tipo máis común de columnas, aínda que ultimamente están gañando popularidade entre os científicos as columnas máis pequenas. Utilízanse en análise cuantitativa tradicional de mostras e adoitan usar un detector de absorbancia UV-Vis.
As columnas de calibre estreito (de 1–2 mm) utilízanse para aplicacións nas que se desexa unha maior sensibilidade con detectores UV-vis especiais, ou con detección de fluorescencia ou con outros métodos de detección como a cromatografía líquida-espectrometría de masas.
As columnas capilares (de menos de 0,3 mm) utilízanse case exclusivamente con medios de detección alternativos como a espectrometría de masas. Están xeralmente feitos de capilares de sílice fundida, en vez dos tubos de aceiro inoxidable que empregan as columnas máis grandes.
Tamaño da partícula
editarA maioría das HPLC tradicionais realízanse coa fase estacionaria unida ao exterior de pequenas partículas esféricas de sílice (boliñas moi pequenas). Estas partículas poden ter varios tamaños, dos cales o máis común é o de 5 µm. As partículas máis pequenas xeralmente proporcionan máis área superficial e unha mellor separación, pero a presión que cómpre usar para unha velocidade linear óptima increméntase segundo o cadrado do inverso do diámetro da partícula.[13][14][15]
Isto significa que cambiar a partículas que sexan a metade de grandes, mantendo igual o tamaño da columna, dobrará o rendemento, pero incrementará a presión requirida multiplicándoa por catro. As partículas máis grandes utilízanse en HPLC preparativa (con diámetros das columnas desde 5 cm ata >30 cm) e para as aplicacións que non usan HPLC como a extracción en fase sólida.
Tamaño de poro
editarMoitas fases estacionarias son porosas para proporcionaren unha área maior. Os poros pequenos proporcionan maior área asuperficial, mentres que os grandes teñen unha mellor cinética, especialmente para analitos máis grandes. Por exemplo, unha proteína que é só lixeiramente máis pequena que un poro podería entrar no poro pero despois non sairía del facilmente.
Bomba de presión
editarAs bombas utilizadas varían en capacidade de presión, pero o seu rendemento mídese pola súa capacidade de producir unha velocidade de fluxo volumétrico consistente e reproducible. A presión pode chegar a ser de 60 MPa ou unhas 600 atmosferas. Os sistemas de HPLC modernos están preparados para funcionar a presións moito máis altas e, por tanto, poden utilizar partículas de tamaños moito máis pequenos nas columnas (<2 μm). Estes sistemas de "cromatografía líquida de ultraalto rendemento" ou UHPLCs poden funcionar ata a 120 MPa ou unhas 1200 atmosferas.[16] O termo "UPLC"[17] é unha denominación comercial da empresa Waters Corporation, pero ás veces utilízase para referirse á técnica máis xeral da UHPLC.
Detectores
editarOs detectores de HPLC poden clasificarse en dous grandes tipos: universal ou selectivo. Os detectores universais tipicamente miden unha propiedade en masa (por exemplo, o índice de refracción) ao mediren a diferenza dunha propiedade física entre a fase móbil e a fase móbil con soluto, mentres que os detectores selectivos miden as propiedades do soluto (por exemplo, a absorbancia UV-Vis ou ultravioleta-visible) ao responderen simplemente ás propiedades físicas ou químicas do soluto.[18] A HPLC usa normalmente un detector de absorbancia UV-Vis, pero hai unha gran variedade doutros detectores de cromatografía. Un detector universal que complementa a detección da absorbancia UV-Vis é o detector de aerosol cargado (CAD). Un tipo de detector comunmente utilizado inclúe detectores de índice de refracción, que proporcionan lecturas que miden os cambios no índice de refracción do eluente a medida que este se move a través da célula de fluxo. En certos casos, é posible usar múltiples detectores, por exemplo a LCMS normalmente combina un detector UV-Vis cun espectrómetro de masas.
Automostreadores
editarNos sistemas de HPLC poden inxectarse automaticamente un gran número de mostras grazas ao uso de automostreadores de HPLC. Ademais, os automostreadores de HPLC teñen un volume e técnica de inxección que é exactamente a mesma en cada inxección, e en consecuencia proporcionan un alto grao de precisión no volume inxectado.
Aplicacións
editarFabricación de produtos
editarA HPLC ten moitas aplicacións no laboratorio e na ciencia clínica. É unha técnica común utilizada nos desenvolvementos farmacéuticos, xa que é un modo fiable de obter un produto e asegurar a súa pureza.[19] Aínda que a HPLC pode producir produtos de calidade extremadamente alta (puros), non é sempre o método primario utilizado na produción de materiais farmacolóxicos en grandes cantidades.[20] Segundo a Farmacopea europea, a HPLC utilízase só nun 15,5% das sínteses.[21] Porén, intervén no 44% das sínteses na farmacopea dos Estados Unidos.[22] Isto probablemente podería deberse a diferenzas en custo e tempo necesario, xa que a HPLC a grande escala pode ser unha técnica cara. O incremento en especificidade, precisión e exactitude que se obtén coa HPLC correspóndese desafortunadamente cun incremento do custo.
Usos legais
editarEsta técnica úsase tamén para a detección de drogas ilícitas dopantes ou de abuso na urina. O método de detección máis común de detección de drogas é o inmunoensaio.[23] Este método é moito máis conveniente. Porén, esta conveniencia ten o problema da menor especificidade e non cubrir unha ampla variedade de drogas. Como a HPLC é un método para determinar (e posiblemente incrementar) a pureza, usar a HPLC soa na avaliación da concentracións de drogas é insuficiente. Con isto, a HPLC neste contexto realízase a miúdo xunto coa espectrometría de masas.[24] Usando a cromatografía líquida en vez da cromatografía de gases en conxunción coa espectrometría de masas evita a necesidade de modificacións con axentes acetilantes ou alquilantes, que poden ser un paso extra bastante pesado do método.[25] Esta técnica foi utilizada para detectar diversos axentes como axentes dopantes, metabolitos de drogas, conxugados glicurónidos, anfetaminas, opioides, cocaína, BZDs, ketamina, LSD, cánnabis e pesticidas.[26][27] Realizar unha HPLC en conxunción cunha espectrometría de masas reduce a necesidade absoluta de estandarizar o funcionamento experimental da HPLC.
Investigación
editarPoden realizarse ensaios similares en investigación científica, para detectar concentracións de candidatos clínicos potenciais como fármacos antiasma ou antifúnxicos.[28] Esta técnica tamén é obviamente útil para examinar múltiples especies químicas en mostras recollidas, pero require o uso de solucións estándar cando se busca información sobre a identidade das especies. Utilízase como método para confirmar os resultados de reaccións e síntese, xa que a pureza é esencial neste tipo de investigacións. Porén, a espectroscopía de masas segue sendo o xeito máis fiable de identificar especies.
Médicas
editarO uso médico da HPLC pode agbranguer a análise de drogas, pero principalmente a análise de nutrientes. Aínda que a urina é o medio máis común no que se analizan concentracións de drogas, o soro sanguíneo é a mostra que se extrae para a maioría das análises médicas con HPLC.[29] Outros métodos de detección de moléculas que son útiles para estudos clínicos foron comparados en eficacia coa HPLC, principalmente os inmunoensaios. Nun destes exemplos, os ensaios de unión competitiva de proteínas (CPBA) e a HPLC foron comparados en canto á sensibilidade na detección de vitamina D. Esta medición é útil para diagnosticar as deficiencias en vitamina D en nenos. Atopouse que a sensibilidade e especificidade desta CPBA chegaban só ao 40% e 60%, respectivamente, da capacidade da HPLC.[30] Aínda que é unha ferramenta cara, a exactitude da HPLC practicamente non é igualada por outras técnicas.
Notas
editar- ↑ Gerber, F.; Krummen, M.; Potgeter, H.; Roth, A.; Siffrin, C.; Spoendlin, C. (2004). "Practical aspects of fast reversed-phase high-performance liquid chromatography using 3μm particle packed columns and monolithic columns in pharmaceutical development and production working under current good manufacturing practice". Journal of Chromatography A 1036 (2): 127–133. PMID 15146913. doi:10.1016/j.chroma.2004.02.056.
- ↑ Morgan, David J. (2003-11-19). "Fraction collector (post on Flickr)". Flickr. Consultado o 28 October 2015.
- ↑ 3,0 3,1 Karger, Barry L. (1997). "HPLC: Early and Recent Perspectives". Journal of Chemical Education 74 (1): 45. Bibcode:1997JChEd..74...45K. doi:10.1021/ed074p45.
- ↑ 4,0 4,1 4,2 4,3 4,4 4,5 Henry, Richard A. (1 February 2009) "The Early Days of HPLC at Dupont" Arquivado 01 de agosto de 2020 en Wayback Machine.. Chromatography Online. Avanstar Communications Inc.
- ↑ Iler, R.K. (1979) The Chemistry of Silica. John Wiley & Sons. New York.
- ↑ Karger, B. L.; Berry, L. V. (1971). "Rapid liquid-chromatographic separation of steroids on columns heavily loaded with stationary phase". Clin. Chem. 17 (8): 757–64. PMID 4254537.
- ↑ Giddings, J. Calvin (1965) Dynamics of Chromatography, Part I. Principles and Theory. Marcel Dekker, Inc., New York. p. 281.
- ↑ Ettre, C. (2001). "Milestones in Chromatography: The Birth of Partition Chromatography" (PDF). LCGC 19 (5): 506–512. Arquivado dende o orixinal (PDF) o 04 de marzo de 2016. Consultado o 2016-02-26.
- ↑ Martin, A J P; Synge, R L M (1941). "Separation of the higher monoamino-acids by counter-current liquid-liquid extraction: the amino-acid composition of wool". Biochemical Journal 35 (1–2): 91–121. PMC 1265473. PMID 16747393. doi:10.1042/bj0350091.
- ↑ Lindsay, S.; Kealey, D. (1987). High performance liquid chromatography. Wiley. OSTI 7013902. from review Hung, L. B.; Parcher, J. F.; Shores, J. C.; Ward, E. H. (1988). "Theoretical and experimental foundation for surface-coverage programming in gas–solid chromatography with an adsorbable carrier gas". J. Am. Chem. Soc. 110 (11): 1090–1096. doi:10.1021/ac00162a003.
- ↑ Displacement Chromatography. Sacheminc.com. Retrieved 2011-06-07. Arquivado 15 de setembro de 2008 en Wayback Machine.
- ↑ Snyder, Lloyd R.; Dolan, John W. (2006). High-Performance Gradient Elution: The Practical Application of the Linear-Solvent-Strength Model. Wiley Interscience. ISBN 978-0470055519.
- ↑ Majors, Ronald E.. (2010-09-07) Fast and Ultrafast HPLC on sub-2 μm Porous Particles — Where Do We Go From Here? – LC-GC Europe. Lcgceurope.com. Retrieved 2011-06-07.
- ↑ Xiang, Y.; Liu Y.; Lee M.L. (2006). "Ultrahigh pressure liquid chromatography using elevated temperature". Journal of Chromatography A 1104 (1–2): 198–202. PMID 16376355. doi:10.1016/j.chroma.2005.11.118.
- ↑ Horváth, Cs.; Preiss B.A.; Lipsky S.R. (1967). "Fast liquid chromatography. Investigation of operating parameters and the separation of nucleotides on pellicular ion exchangers". Analytical Chemistry 39 (12): 1422–1428. PMID 6073805. doi:10.1021/ac60256a003.
- ↑ 1290 Infinity Quaternary Pump Arquivado 20 de novembro de 2015 en Wayback Machine.. Agilent
- ↑ waters. "Trademarks : Waters". www.waters.com.
- ↑ K., Robards (1994). Principles and practice of modern chromatographic methods. Haddad, P. R., Jackson, P. E. Amsterdam: Elsevier/Academic Press. ISBN 9780080571782. OCLC 815471219.
- ↑ Gerber, Frederic (May 2004). "Practical aspects of fast reversed-phase high-performance liquid chromatography using 3 μm particle packed columns and monolithic columns in pharmaceutical development and production working under current good manufacturing practice". Journal of Chromatography 1036 (2): 127–33. PMID 15146913. doi:10.1016/j.chroma.2004.02.056.
- ↑ Siddiqui, Masoom Raza; AlOthman, Zeid A.; Rahman, Nafisur (2013). "Analytical techniques in pharmaceutical analysis: A review". Arabian Journal of Chemistry 10: S1409–S1421. doi:10.1016/j.arabjc.2013.04.016.
- ↑ The European Pharmacopoeia, 2002. fourth ed., Council of Europe, Strasbourg.
- ↑ United States Pharmacopoeia, 2004. 27th ed. The USP Convention Inc., Rockville, MD.
- ↑ Pesce, Amadeo; Rosenthal, Murray; West, Robert; West, Cameron; Crews, Bridgit; Mikel, Charles; Almazan, Perla; Latyshev, Sergey (2010-06-01). "An evaluation of the diagnostic accuracy of liquid chromatography-tandem mass spectrometry versus immunoassay drug testing in pain patients". Pain Physician 13 (3): 273–281. PMID 20495592.
- ↑ Tsai, I.-Lin; Weng, Te-I.; Tseng, Yufeng J.; Tan, Happy Kuy-Lok; Sun, Hsiao-Ju; Kuo, Ching-Hua (2013-12-01). "Screening and confirmation of 62 drugs of abuse and metabolites in urine by ultra-high-performance liquid chromatography-quadrupole time-of-flight mass spectrometry". Journal of Analytical Toxicology 37 (9): 642–651. PMID 24084874. doi:10.1093/jat/bkt083.
- ↑ Weinmann, W.; Renz, M.; Vogt, S.; Pollak, S. (2000-01-01). "Automated solid-phase extraction and two-step derivatisation for simultaneous analysis of basic illicit drugs in serum by GC/MS". International Journal of Legal Medicine 113 (4): 229–235. PMID 10929239. doi:10.1007/s004149900098.
- ↑ Kolmonen, Marjo; Leinonen, Antti; Pelander, Anna; Ojanperä, Ilkka (2007-02-28). "A general screening method for doping agents in human urine by solid phase extraction and liquid chromatography/time-of-flight mass spectrometry". Analytica Chimica Acta 585 (1): 94–102. PMID 17386652. doi:10.1016/j.aca.2006.12.028.
- ↑ Pelander, Anna; Ojanperä, Ilkka; Laks, Suvi; Rasanen, Ilpo; Vuori, Erkki (2003-11-01). "Toxicological screening with formula-based metabolite identification by liquid chromatography/time-of-flight mass spectrometry". Analytical Chemistry 75 (21): 5710–5718. PMID 14588010. doi:10.1021/ac030162o.
- ↑ Nobilis, Milan; Pour, Milan; Senel, Petr; Pavlík, Jan; Kunes, Jirí; Voprsalová, Marie; Kolárová, Lenka; Holcapek, Michal (2007-06-15). "Metabolic profiling of a potential antifungal drug, 3-(4-bromophenyl)-5-acetoxymethyl-2,5-dihydrofuran-2-one, in mouse urine using high-performance liquid chromatography with UV photodiode-array and mass spectrometric detection". Journal of Chromatography B 853 (1–2): 10–19. PMID 17400036. doi:10.1016/j.jchromb.2007.02.045.
- ↑ Sundström, Mira; Pelander, Anna; Angerer, Verena; Hutter, Melanie; Kneisel, Stefan; Ojanperä, Ilkka (2013-10-01). "A high-sensitivity ultra-high performance liquid chromatography/high-resolution time-of-flight mass spectrometry (UHPLC-HR-TOFMS) method for screening synthetic cannabinoids and other drugs of abuse in urine". Analytical and Bioanalytical Chemistry 405 (26): 8463–8474. PMID 23954996. doi:10.1007/s00216-013-7272-8.
- ↑ Zahedi Rad, Maliheh; Neyestani, Tirang Reza; Nikooyeh, Bahareh; Shariatzadeh, Nastaran; Kalayi, Ali; Khalaji, Niloufar; Gharavi, Azam (2015-01-01). "Competitive Protein-binding assay-based Enzyme-immunoassay Method, Compared to High-pressure Liquid Chromatography, Has a Very Lower Diagnostic Value to Detect Vitamin D Deficiency in 9–12 Years Children". International Journal of Preventive Medicine 6: 67. PMC 4542329. PMID 26330983. doi:10.4103/2008-7802.161069.
Véxase tamén
editarOutros artigos
editar- Historia da cromatografía
- Electrocromatografía capilar
- Cromatografía en columna
- Cromatografía iónica
- Cromatografía líquida micelar
Bibliografía
editar- L. R. Snyder, J.J. Kirkland, and J. W. Dolan, Introduction to Modern Liquid Chromatography, John Wiley & Sons, Nova York, 2009.
- M.W. Dong, Modern HPLC for practicing scientists. Wiley, 2006.
- L. R. Snyder, J.J. Kirkland, and J. L. Glajch, Practical HPLC Method Development, John Wiley & Sons, Nova York, 1997.
- S. Ahuja and H. T. Rasmussen (ed), HPLC Method Development for Pharmaceuticals, Academic Press, 2007.
- S. Ahuja and M.W. Dong (ed), Handbook of Pharmaceutical Analysis by HPLC, Elsevier/Academic Press, 2005.
- Y. V. Kazakevich and R. LoBrutto (ed.), HPLC for Pharmaceutical Scientists, Wiley, 2007.
- U. D. Neue, HPLC Columns: Theory, Technology, and Practice, Wiley-VCH, Nova York, 1997.
- M. C. McMaster, HPLC, a practical user's guide, Wiley, 2007.
Ligazóns externas
editar| Wikimedia Commons ten máis contidos multimedia na categoría: Cromatografía líquida de alto rendemento |
- Liquid Chromatography en Curlie (en inglés)