Estrutura cuaternaria das proteínas
En bioquímica, a estrutura cuaternaria das proteínas é a disposición que presentan varias proteínas pregadas ou enroladas que forman un complexo de múltiples subunidades en estado nativo. Téñena as proteínas oligoméricas ou que forman complexos, que están formadas por varias cadeas polipeptídicas. A disposición adoptada polas distintas cadeas é a estrutura cuaternaria do conxunto. Por tanto, o concepto de estrutura cuaternaria non ten sentido en proteínas formadas por unha soa cadea polipeptídica. Un exemplo de proteína con estrutura cuaternaria é a proteína hemoglobina, formada por catro cadeas polipeptídicas, que son dúas subunidades alfa e dúas beta, dispostas en cadro. Outro exemplo son as inmunoglobulinas, formadas por catro cadeas, dúas pesadas e dúas lixeiras, dispostas formando un y grego.


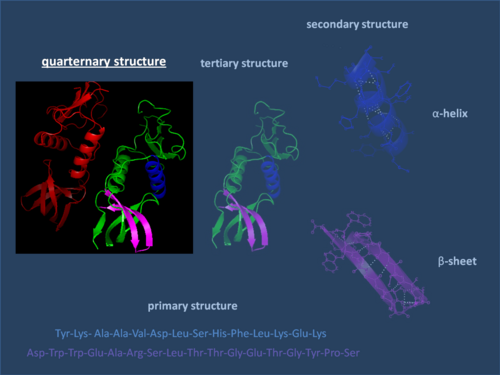
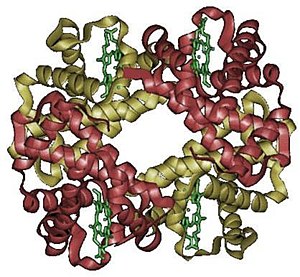
En xeral, a estrutura cuaternaria dálle á proteína a súa funcionalidade e ás veces proporciona ao complexo un eixe ou punto de simetría, aínda que non é necesario. A principal causa da estabilización das estruturas cuaternarias é a interacción hidrófoba entre aminoácidos non polares (as partes hidrófobas dos monómeros xúntanse de maneira que minimicen a superficie exposta ao solvente), pero tamén pode haber pontes de hidróxeno, forzas electrostáticas e pontes disulfuro.
Descrición e exemplos
editarMoitas proteínas son en realidade ensamblaxes de máis dunha cadea polipeptídica, as cales no contexto das grandes ensamblaxes proteicas se denominan subunidades. Ademais da estrutura terciaria das subunidades, as proteínas de moitas subunidades posúen unha estrutura cuaternaria, que é a forma en que se dispoñen as subunidades no conxunto da ensamblaxe. Os encimas compostos por varias subunidades con diversas funcións denomínanse ás veces holoencimas, e neles algunhas partes poden denominarse subunidades regulatorias e o núcleo funcional do encima denomínase subunidade catalítica. Exemplos de proteínas con estrutura cuaternaria inclúen a hemoglobina, ADN polimerase, e canais iónicos. Porén, outras ensamblaxes reciben o nome de complexos multiproteicos, que tamén posúen estrutura cuaternaria. Exemplos destes complexos son os nucleosomas e os microtúbulos. Poden ocorrer cambios na estrutura cuaternaria por medio de cambios conformacionais en subunidades individuais ou por medio da reorientación das subunidades en relación coas demais. Por medio deste tipo de cambios, nos que subxace a cooperatividade e alosterismo nos encimas "multiméricos", moitas proteínas poden ser reguladas e realizan as súas funcións fisiolóxicas.
A definición anterior segue o enfoque clásico da bioquímica, establecido nos tempos nos que a distinción entre unha proteína e unha unidade proteica funcional era difícil de dilucidar. Máis recentemente, tende a falarse de interaccións proteína-proteína cando se discute a estrutura cuaternaria e a considerarse todas as ensamblaxes de proteínas como complexos proteicos.
Nomenclatura das estruturas cuaternarias
editarO número de subunidades nun complexo oligomérico descríbese usando nomes que acaban en -mero (en grego "parte, subunidade"). Úsanse xeralmente nomes grecolatinos para os primeiros dez tipos, pero existen para os vinte primeiros, mentres que os complexos de máis de vinte subunidades se denominan usando números coa terminación -mérico (ou mero).
|
|
|
- *Non se coñecen exemplos
Aínda que os complexos superiores aos octámeros raramente se observan, hai algunhas excepcións importantes. As cápsides virais están a miúdo compostas por máis de 60 proteínas. Varias máquinas moleculares da célula, como o proteasoma (catro aneis heptaméricos = 28 subunidades), o complexo da transcrición e o espliceosoma, teñen moitas subunidades. O ribosoma é probablemente a máquina molecular máis grande, e está composto por ARN e decenas de proteínas.
Nalgúns casos, as proteínas forman complexos que despois se ensamblan formando complexos máis grandes. Neses casos, cando se usan termos como "dímero de dímeros" ou "trímero de dímeros" suxírese que o complexo pode volverse a disociar primeiro nos seus subcomplexos máis pequenos antes de disocirse en monómeros.
Determinación da estrutura cuaternaria
editarA estrurura cuaternaria pode ser determinada utilizando varias técnicas experimentais que requiren o exame dunha mostra da proteína en diversas condicións experimentais. Os experimentos a miúdo proporcionan unha estimación da masa da proteína nativa e iso, xunto co coñecemento das masas e estequiometría das subunidades, permite predicir a estrutura cuaternaria do conxunto cunha determinada exactitude. Non sempre é posible obter unha determinación precisa da composición de subunidades.
O número de subunidades dun complexo proteico pode xeralmente determinarse medindo o volume molecular hidrodinámico ou masa do complexo intacto, o cal require condicións na solución nativas. Para as proteínas pregadas, a masa pode inferirse do seu volume utilizando o volume específico parcial de 0,73 mL/g. Porén, as medicións de volume son menos seguras que as medicións de masa, xa que as proteínas non pregadas parecen ter un volume moito máis grande que as pregadas; cómpren experimentos adicionais para determinar se unha proteína está pregada ou formou un oligómero.
Predición dos atributos da estrutura cuaternaria
editarDesenvolvéronse algúns métodos bioinformáticos para predicir os atributos da estrutura cuaternaria de proteínas baseados na información da súa secuencia utilizando varios modos de composición de pseudoaminoácidos (ver por exemplo as referencias: [1] [2] [3]).
Métodos para medir a masa de complexos intactos directamente
editar- Ultracentrifugación analítca sedimentación-equilibrio
- Espectroscopia de masas electrospray
- Inmunoensaio espectrométrico de masas MSIA
Métodos para medir o tamaño dos complexos intactos directamente
editar- Dispersión de luz estática
- Cromatografía de exclusión por tamaño (precisa calibración)
- Interferometría de polarización dual
Métodos para medir o tamaño dos complexos intactos indirectamente
editar- Ultracentrifugación analítica sedimentación-velocidade (mide a constante de difusión translacional)
- Dispersión de luz dinámica (mide a constante de difusión translacional)
- Resonancia magnética nuclear de proteínas de gradiente pulsado (mide a constante de difusión translacional)
- Polarización fluorescente (mide a constante de difusión rotacional)
- Relaxación dieléctrica (mide a constante de difusión translacional)
- Interferometría de polarización dual (mide o tamaño e a densidade do complexo)
Os métodos que miden a masa ou o volume en condicións de desnaturalización (proteína despregada), como a espectrometría de masas MALDI-TOF e a SDS-PAGE, xeralmente non son útiles, porque as condicións non nativas causan normalmente que o complexo se disocie en monómeros. Porén, estes métodos poden ás veces ser aplicables; por exemplo, pode aplicarse SDS-PAGE despois dun previo tratamento do complexo intacto con reactivos químicos entrelazantes.
Interaccións proteína-proteína
editar- Artigo principal: Interaccións proteína-proteína.
As proteínas poden formar complexos fortemente unidos. Por exemplo, o inhibidor da ribonuclease únese á ribonuclease A cunha constante de disociación de aproximadamente 20 fM. Outras proteínas evolucionaron para unirse especificamente a residuos infrecuentes presentes noutras proteínas, por exemplo, a grupos biotina (avidina), tirosinas fosforiladas (dominios SH2) ou segmentos ricos en prolina (dominios SH3).
Notas
editar- ↑ Chou KC, Cai YD (November 2003). "Predicting protein quaternary structure by pseudo amino acid composition". Proteins 53 (2): 282–9. PMID 14517979. doi:10.1002/prot.10500.
- ↑ Zhang SW, Chen W, Yang F, Pan Q (October 2008). "Using Chou's pseudo amino acid composition to predict protein quaternary structure: a sequence-segmented PseAAC approach". Amino Acids 35 (3): 591–8. PMID 18427713. doi:10.1007/s00726-008-0086-x.
- ↑ Xiao, X., Wang, P. & Chou, K. C. (2009) Predicting protein quaternary structural attribute by hybridizing functional domain composition and pseudo amino acid composition. Journal of Applied Crystallography 42, 169-173.
Véxase tamén
editarOutros artigos
editar- Estrutura primaria das proteínas
- Estrutura secundaria das proteínas
- Estrutura terciaria das proteínas
- Estrutura das proteínas
Ligazóns externas
editar- The Macromolecular Structure Database (MSD) no European Bioinformatics Institute (EBI) —. Proporciona unha lista de Estruturas Cuaternaris Probables (PQS) para cada proteína no Protein Data Bank (PDB).
- servidor PQS — non foi actualizado desde 2009
- PISA — servidor de Protein Interfaces, Surfaces and Assemblies no MSD.
- complexos 3D — Clasificación estrutural dos complexos proteicos
- Proteopedia — Páxina de inicio de Proteopedia enciclopedia colaborativa en 3D de proteínas e outras moléculas.
- PDBWiki — Páxina de inicio de PDBWiki, unha páxina para a anotación pola comunidade de estruturas PDB.
- ProtCID — ProtCID, unha base de datos de interfaces proteína-proteína similares en estruturas cristalinas de proteínas homólogas.