Clorito de sodio
O clorito de sodio (NaClO2) é un composto químico usado na fabricación de papel e como desinfectante. En condicións ácidas orixina ácido cloroso e dióxido de cloro. É o compoñente do pseudomedicamento MMS, prohibido en España pola AEMPS.
| Clorito de sodio | |
|---|---|

|
|

|

|
 | |
Clorito de sodio | |
Outros nomes Sal de sodio do ácido cloroso | |
| Identificadores | |
| Número CAS | 7758-19-2, 49658-21-1 (trihidrato) |
| PubChem | 23668197 |
| ChemSpider | 22860 |
| UNII | G538EBV4VF, F83TIJ81F8 (trihidrato) |
| Número CE | 231-836-6 |
| Número UN | 1496 |
| KEGG | C19523 |
| ChEBI | CHEBI:78667 |
| Número RTECS | VZ4800000 |
| Imaxes 3D Jmol | Image 1 |
| |
| |
| Propiedades | |
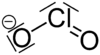
| Fórmula molecular | NaClO2 |
| Masa molecular | 90,442 g/mol (anhidro) 144,487 g/mol (trihidrato) |
| Aspecto | sólido branco |
| Olor | inodoro |
| Densidade | 2,468 g/cm3, sólido |
| Punto de fusión | o anhidro descomponse a 180–200 °C o trihidrato descomponse a 38 °C |
| Solubilidade en auga | 75,8 g/100 mL (25 °C) 122 g/100 mL (60 °C) |
| Solubilidade | lixeiramente soluble en metanol e etanol |
| Acidez (pKa) | 10-11 |
| Estrutura | |
| Estrutura cristalina | monoclínico |
| Termoquímica | |
| Entalpía estándar de formación ΔfH |
-307,0 kJ/mol |
| Perigosidade | |
| Pictogramas GHS |  
|
| Palabra sinal GHS | Danger (perigo) |
| Perigo na inxestión | Categoría 3 |
| Perigo na inhalación | Categoría 2 |
| Perigo para a pel | Categoría 1B |
| NFPA 704 | |
| Punto de inflamabilidade | Non inflamable |
| LD50 | 350 mg/kg (rata, oral) |
| Compostos relacionados | |
| Outros anións | Cloruro de sodio Hipoclorito de sodio Clorato de sodio Perclorto de sodio |
| Outros catións | Clorito de potasio Clorito de bario |
| Compostos relacionados | Dióxido de cloro Ácido cloroso |
Se non se indica outra cousa, os datos están tomados en condicións estándar de 25 °C e 100 kPa. | |
Uso editar
A principal aplicación do clorito de sodio é a xeración de dióxido de cloro como lixivia para branquear e tratar téxtiles, polpa de celulosa e papel. Tamén se usou para a desinfección de estacións de tratamento de augas municipais despois da súa conversión en dióxido de cloro.[1]:2 Unha vantaxe desta aplicación, comparada co uso máis común do cloro, é que non se producen trihalometanos (como o cloroformo) a partir de contaminantes orgánicos.[1]:25,33
O clorito de sodio, NaClO2, ás veces en combinación con cloruro de cinc, tamén ten aplicacións como compoñente en lavados terapéuticos, limpeza bucal,[2][3] pastas de dentes e xeles, sprays bucais, como conservante de colirios oculares,[4] e en solucións de limpeza de lentes de contacto.
Tamén se usa para hixienizar condutos de aire e sistemas HVAC/R (calefacción, ventilación, aire acondicionado e refrixeración) e recintos onde se gardan animais (paredes, chans e outras superficies).
Reactivo químico editar
En síntese orgánica, o clorito de sodio úsase frecuentemente como reactivo na oxidación de Pinnick para a oxidación de aldehidos a ácidos carboxílicos. A reacción realízase xeralmente en solución tamponada de fosfato monosódico en presenza dun captador de cloro (normalmente 2-metil-2-buteno).[5]
En 2005, o cloruro de sodio foi utilizado como axente oxidante para converter alquil furanos nos correspondentes ácidos 4-oxo-2-alquenoicos nunha síntese simple nun só recipiente.[6]
Clorito de sodio acidificado editar
Mesturar unha solución de clorito de sodio cunha solución de ácido débil de grao alimentario (xeralmente de ácido cítrico), ambos os dous estables, produce clorito de sodio acidificado de curta vida, que ten potentes propiedades descontaminantes. Despois de mesturar o principal ingrediente activo, prodúcese ácido cloroso en equilibrio con anión clorito. A proporción varía co pH, temperatura e outros factores, e vai desde aproximadamente o 5 ao 35% de ácido cloroso cun 65–95% de clorito; solucións máis ácidas dan lugar a unha maior proporción de ácido cloroso. O ácido cloroso descomponse a dióxido de cloro, que, á súa vez, descomponse en anión clorito e finalmente anión cloruro. O clorito de sodio acidificado utilízase en hixienización de superficies duras que están en contacto con alimentos e para o lavado de diversos alimentos como carne vermella, carne de aves, mariscos, frutas e vexetais. Como os compostos de oxo-cloro son inestables cando se preparan axeitadamente, non deberían quedar residuos medibles nos alimentos se estes son tratados correctamente.[7][8] O clorito de sodio acidificado tamén se usa como solución para o lavado das ubres para o control da mastite en gando vacún produtor de leite.[9]
Seguridade editar
O cloruro de sodio, igual que moitos axentes oxidantes, debería ser protexido da contaminación accidental por materiais orgánicos para evitar a formación dunha mestura explosiva. O composto químico é estable en forma pura e non explota cun impacto de percusión, a non ser que estean presentes contaminantes orgánicos, tales como un martelo cheo de graxa que golpea o composto nunha engra.[10] Tamén fai ignición doadamente se se combina cun axente redutor como azucre en po, xofre ou fósforo vermello.
Toxicidade editar
- Artigo principal: Suplemento mineral milagroso.
O clorito de sodio é un forte oxidante e, por tanto, pode causar síntomas clínicos similares aos do clorato de sodio, como son: metahemoglobinemia, hemólise, insuficiencia renal.[11] Unha dose de 10-15 gramos de clorato de sodio pode ser letal.[12] A metahemoglobinemia demostrouse en ratas e gatos,[13] e estudos recentes da Axencia Europea do Medicamento confirmaron que a sintomatoloxía clínica é moi similar á causada polo clorato de sodio en ratas, ratos, coellos e monos Chlorocebus.[14]
Só se coñece un caso humano na literatura médica de envelenamento por clorito.[15] Parece confirmar que a toxicidade é igual á do clorato de sodio. Facendo unha analoxía co clorato de sodio, pode esperarse que mesmo pequenas cantidades de só 1 gramo causen náuseas, vómitos e mesmo unha hemólise que pode ser mortal en persoas deficientes en glicosa-6-fosfato deshidroxenase.
A EPA estableceu un nivel de contaminación máximo de 1 miligramo de clorito por litro (1 mg/L) na auga potable.[16]
O pseudomedicamento MMS (do inglés Miracle Mineral Supplement ou Solution) é unha mestura de clorito de sodio e ácido cítrico, que se promoveu como un produto milagre que o cura todo, e está prohibido pola Axencia Española de Medicamentos e Produtos Sanitarios (AEMPS). As persoas que o venderon foron condenadas, multadas ou disciplinadas de diversas maneiras polas xurisdicións de moitos países. Axencias gobernamentais de vaios países, como a FDA fixeron múltiples advertencias contra o consumo do MMS.[17] [18] [19][20] [21][22] [23][24][25]
Fabricación editar
O ácido libre ácido cloroso, HClO2, só é estble a baixas concentracións. Como non pode ser concentrado, non é un produto comercial. Porén, o seu correspondente sal de sodio, o cloruro de sodio, NaClO2, é estable e bastante barato como para estar dispoñible comercialmente. Os sales correspondentes de metais pesados (Ag+, Hg+, Tl+, Pb2+ e tamén de Cu2+ e NH4+) descompóñense explosivamente con calor e choques.
O clorito de sodio deriva indirectamente do clorato de sodio, NaClO3. Primeiro, o clorato de sodio redúcese a dióxido de cloro, normalmente nunha solución ácida forte usando axentes redutores como o sulfito de sodio, dióxido de xofre ou ácido clorhídrico. Este intermediario é despois absorbido nunha solución acuosa de hidróxido de sodio, na que outro axente redutor o converte en clorito de sodio. Incluso o peróxido de hidróxeno pode utilizarse como axente redutor, dando lugar a gas oxíxeno como o seu subproduto en vez doutros sales inorgánicos ou materiais que poderían contaminar o produto desexado.[26]
Notas editar
- ↑ 1,0 1,1 EPA Guidance Manual, chapter 4: Chlorine dioxide (PDF). US Environmental Protection Agency. Arquivado dende o orixinal (PDF) o 2008-10-11. Consultado o 2012-02-27.
- ↑ Cohen, Joyce (2008-05-13). "New mouthwashes may help take bad breath away". USA Today. Arquivado dende o orixinal o 2012-06-26.
- ↑ "SmartMouth 2 Step Mouth Rinse". dentist.net. Arquivado dende o orixinal o 29 de outubro de 2010. Consultado o 26 de abril de 2018.
- ↑ Blink Tears
- ↑ Bal BS, Childers WE, Pinnick HW (1981). "Oxidation of α,β-unsaturated aldehydes". Tetrahedron (resumo) 37 (11): 2091–2096. doi:10.1016/S0040-4020(01)97963-3.
- ↑ Annangudi SP, Sun M, Salomon RG (2005). "An efficient synthesis of 4-oxo-2-alkenoic acids from 2-alkyl furans". Synlett (resumo) 9 (9): 1468–1470. doi:10.1055/s-2005-869833.
- ↑ Acidified sodium chlorite handling/processing. Agricultural Marketing Service (USDA). 21 de xullo de 2008. Arquivado dende o orixinal (PDF) o 8 de abril de 2013. Consultado o 9 de decembro de 2012.
- ↑ Rao, Madduri V (2007). Acidified sodium chlorite (ACS), chemical and technical assessment (PDF). Food and Agricultural Organization of the United Nations. Arquivado dende o orixinal (PDF) o 3 de decembro de 2012. Consultado o 9 de decembro de 2012.
- ↑ Hillerton, J.E.; Cooper, J.; Morelli, J. (2007). "Preventing Bovine Mastitis by a Postmilking Teat Disinfectant Containing Acidified Sodium Chlorite". Journal of Dairy Science 90 (3): 1201–1208. PMID 17297095. doi:10.3168/jds.S0022-0302(07)71607-7.
- ↑ Taylor, M. C. (1940). "Sodium Chlorite Properties and Reactions". Industrial & Engineering Chemistry 32 (7): 899–903. doi:10.1021/ie50367a007.
- ↑ Goldfrank's Toxicologic Emergencies, McGraw-Hill Professional; 8ª edición (28 de marzo de 2006), ISBN 978-0-07-143763-9
- ↑ "Chlorates". PoisonCentre.be (en francés). Arquivado dende o orixinal o 2012-12-11. Consultado o 2012-12-11.
- ↑ Clinical Toxicology of Commercial Products. Robert E. Gosselin, Roger P. Smith, Harold C. Hodge, Jeannet Braddock. Uitgever: Williams & Wilkins; 5ª edición (setembro de 1984) ISBN 978-0-683-03632-9
- ↑ "Sodium Chlorite — Summary Report" (PDF). European Agency for the Evaluation of Medicinal Products — Veterinary Medicines Evaluation Unit. Arquivado dende o orixinal (PDF) o 2007-07-10. Consultado o 2007-07-10.
- ↑ Lin, JL; Lim, PS (1993). "Acute sodium chlorite poisoning associated with renal failure". Ren Fail 15 (5): 645–8. PMID 8290712. doi:10.3109/08860229309069417.
- ↑ "ATSDR: ToxFAQs for Chlorine Dioxide and Chlorite". Arquivado dende o orixinal o 2012-07-02.
- ↑ "Seller of "Miracle Mineral Solution" Convicted for Marketing Toxic Chemical as a Miracle Cure". United States Department of Justice. 28 de maio de 2015. Arquivado dende o orixinal o 11 de maio de 2016. Consultado o 11 de maio de 2016.
- ↑ "Assurance of Voluntary Compliance - Kerri Rivera" (PDF). NBC Chicago. Arquivado dende o orixinal (PDF) o 4 de abril de 2016. Consultado o 24 de setembro de 2016.
- ↑ Modelo:Cite court
- ↑ Pulkkinen, Levi (3 de agosto de 2009). "Sexy stories, bogus cures lead to action by state AG". SeattlePI.com. seattlepi.com staff. OCLC 3734418. Arquivado dende o orixinal o 2 de novembro de 2013. Consultado o 12 de febreiro de 2012.
- ↑ "Washington Attorney General reels in refunds for consumers hooked by Aussies' quack medicine web sites" (Nota de prensa). Washington State Office of the Attorney General. 8 de marzo de 2010. Arquivado dende o orixinal o 7 de decembro de 2011. Consultado o 12 de febreiro de 2012.
- ↑ "Aussie net scammers stung after $1.2m haul". ITnews for Australian Business (Haymarket Media). Aug 26, 2009. Arquivado dende o orixinal o 20 de setembro de 2011. Consultado o 12 de febreiro de 2012.
- ↑ "Woman told to stop selling cancer 'miracle drug'". ABC News. Australia. 23 de abril de 2009. Arquivado dende o orixinal o 14 de xuño de 2013. Consultado o 12 de febreiro de 2012.
- ↑ "Unregistered health provider ordered to stop misleading cancer patients" (Nota de prensa). Minister for Tourism and Fair Trading, The Honourable Peter Lawlor. 23 de abril de 2009. Arquivado dende o orixinal o 3 de abril de 2011. Consultado o 12 de febreiro de 2012.
- ↑ Mole, Beth (2019-08-14). "People are still drinking bleach—and vomiting and pooping their guts out". Ars Technica (en inglés). Consultado o 2019-08-15.
- ↑ Qian, Yu; Chen, Yun; Jiang, Yanbin; Zhang, Lijuan (2007). "A clean production process of sodium chlorite from sodium chlorate". Journal of Cleaner Production 15 (10): 920–926. doi:10.1016/j.jclepro.2004.07.008.
Véxase tamén editar
Bibliografía editar
- "Chemistry of the Elements", N.N. Greenwood and A. Earnshaw, Pergamon Press, 1984.
- "Kirk-Othmer Concise Encyclopedia of Chemistry", Martin Grayson, Editor, John Wiley & Sons, Inc., 1985
Ligazóns externas editar


