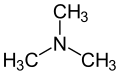
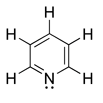
Amina
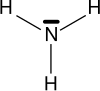
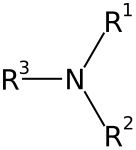
As aminas son compostos químicos orgánicos que se consideran derivados do amoníaco, orixinados pola substitución dos hidróxenos de dita molécula por radicais alquilo ou arilo (aromáticos) [1]. O grupo químico característico das aminas denomínase grupo amino. Nas aminas poden substituírse un, dous ou tres hidróxenos do amoníaco, dando lugar, respectivamente, a aminas primarias, secundarias ou terciarias [2]. As aminas denomínanse simples cando os grupos alquilo son iguais e mixtas cando son diferentes. Poden ser tamén cíclicas.
| Amoníaco | Amina primaria | Amina secundaria | Amina terciaria |
|---|---|---|---|
 |
 |
 |
|
Entre as aminas primarias están, por exemplo, a anilina e a metilamina; entre as secundarias, a dietilamina e a isopropilamina, e entre as terciarias, a dimetilbencilamina ou a trimetilamina. Teñen tamén a función amina os aminoácidos, as aminas bióxenas (por exemplo a histamina, dopamina), e as poliaminas (con varios grupos amino).
Os derivados inorgánicos do amoníaco tamén se consideran xeralmente aminas, como a cloramina (NClH2). Ás veces fálase de amina cuaternaria cando o nitróxeno está unido a catro grupos químicos e adquire carga positiva, pero segundo a IUPAC eses compostos deberían denominarse catións de amonio cuaternario ou compostos de amonio cuaternario (véxase colina). Os compostos nos que o átomo de nitróxeno está unido a un grupo carbonilo (C=O) coa estrutura R-C(=O)NR'R" non son aminas senón amidas [3], as cales teñen propiedades moi diferentes.
-
Amina terciaria (trimetilamina)
-
Amina cíclica non aromática (piperidina)
-
Amina cíclica aromática (piridina)
Clasificación das aminas
editarAs aminas poden clasificarse segundo a súa natureza e número de substituíntes enlazados ao seu nitróxeno. As aminas alifáticas conteñen só H e substituíntes alquilo. As aminas aromáticas teñen o átomo de nitróxeno conectado a un anel aromático.
As aminas que son de tipo alquilo ou arilo están organizadas en tres subcategorías baseándose no número de átomos de carbono adxacentes ao nitróxeno (número de átomos de hidróxeno da molécula de amoníaco que foron substituídos por grupos hidrocarbonados[4]). Poden ser:[5]
- Aminas primarias.— Orixinanse cando un dos tres átomos de hidróxeno do amoníaco é substituído por un grupo alquilo ou aromático. Entre as aminas primarias alquílicas importantes están a metilamina, a maioría dos aminoácidos e o axente tamponante tris, mentres que entre as aminas primarias aromáticas está a anilina.
- Aminas secundarias.— Teñen dous substituíntes orgánicos (alquilo, arilo ou ambos) unidos ao nitróxeno xunto cun hidróxeno. Exemplos importantes son a dimetilamina, e entre as aromáticas a difenilamina.
- Aminas terciarias.— Nelas o nitróxeno ten tres substituíntes orgánicos. Exemplos son a trimetilamina, que ten un distintivo cheiro a peixe, e a EDTA.
Unha cuarta subcategoría está determinada pola conectividade dos substituíntes unidos ao nitróxeno:
- Aminas cíclicas.— As aminas cíclicas poden ser aminas secundarias ou terciarias. Exemplos de aminas cíclicas son o composto de anel de tres membros aziridina e o de anel de seis membros piperidina. A N-metilpiperidina e a N-fenilpiperidina son exemplos de aminas terciarias cíclicas.
Tamén é posible que existan catro substituíntes orgánicos enlazados ao nitróxeno. Porén, estas especies químicas non son aminas senón catións de amonio cuaternario e teñen un centro de nitróxeno cargado. Hai sales de amonio cuaternario formados con moitos tipos de anións.
Propiedades
editarAs aminas son compostos moi polares. As aminas primarias e secundarias poden formar pontes de hidróxeno [6]. As aminas terciarias puras non poden formar pontes de hidróxeno, pero poden aceptar pontes de hidróxeno con moléculas que teñan enlaces O-H ou N-H. Como o nitróxeno é menos electronegativo có osíxeno, o enlace N-H é menos polar có enlace O-H. Por tanto, as aminas forman pontes de hidróxeno máis febles cós alcohois de pesos moleculares semellantes.
As aminas primarias e secundarias teñen puntos de ebulición menores cós dos alcohois, pero maiores cós dos éteres de peso molecular similar. As aminas terciarias, sen pontes de hidróxeno, teñen puntos de ebulición máis baixos cás aminas primarias e secundarias de pesos moleculares comparables.
As aminas primarias poden reaccionar con cetonas e aldehidos orixinando iminas (con dobre enlace no N [7]).
- RNH2 (amina) + R'2C=O → R'2C=NR (imina) + H2O
Notas
editar- ↑ IUPAC Goldbook Amine
- ↑ McMurry, John E. (1992), Organic Chemistry (3rd ed.), Belmont: Wadsworth, ISBN 0-534-16218-5
- ↑ IUPAC Goldbook Amide
- ↑ "3.11 Basic properties of amines". Chemistry LibreTexts (en inglés). 2015-09-28. Arquivado dende o orixinal o 23 de maio de 2021. Consultado o 2021-05-23.
- ↑ Smith, Janice Gorzynski (2011). "Chapter 25 Amines". Organic chemistry (en inglés) (3rd ed.). Nova York, NY: McGraw-Hill. pp. 949–993. ISBN 978-0-07-337562-5. Arquivado dende o orixinal (Book) o 28 de xuño de 2018. Consultado o 26 de xuño de 2018.
- ↑ Lide, D. R., ed (2005). CRC Handbook of Chemistry and Physics (86th ed.). Boca Raton (FL): CRC Press. ISBN 0-8493-0486-5.
- ↑ IUPAC Goldbook Imine
Véxase tamén
editarOutros artigos
editarLigazóns externas
editar- Primary amine synthesis - Synthetic protocols from organic-reaction.com