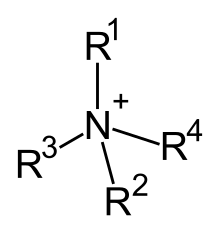
Catión de amonio cuaternario
Os catións de amonio cuaternario, son ións poliatómicos cargados positivamente coa estruura NR+
4, onde R é un grupo alquilo ou arilo.[1] A diferenza do ión amonio (NH+
4) e os catións de amonio primarios, secundarios e terciarios, os catións de amonio cuaternario están cargados permanentemente, independentemente do pH da súa disolución. Os sales de amonio cuaternario ou compostos de amonio cuaternario (chamados aminas cuaternarias na terminoloxía da industria petrolífera) son sales de catións de amonio cuaternario.


Síntese
editarOs compostos de amonio cuaternario prepáranse por alquilación de aminas terciarias cun halocarburo.[2] Na literatura vella esta reacción adoitaba chamarse reacción de Menshutkin, pero os químicos modernos chámana simplemente cuaternización.[3] A reacción pode utilizarse para producir un composto con cadeas alquilo de lonxitudes desiguais; por exemplo cando se producen surfactantes catiónicos un dos grupos alquilo da amina é normalmente máis longo que os outros.[4] Unha síntese típica é polo cloruro de benzalkonio a partir dunha alquildimetilamina de cadea longa e cloruro de bencilo:
- CH3(CH2)nN(CH3)2 + ClCH2C6H5 → [CH3(CH2)nN(CH3)2CH2C6H5]+Cl−
Reaccións
editarOs catións de amonio cuaternario non son reactivos nin sequera con fortes electrófilos, oxidantes e ácidos. Tamén son estables coa maioría dos nucleófilos. Isto último está indicado pola estabilidade dos sales de hidróxidos como o hidróxido de tetrametilamonio e hidróxido de tetrabutilamonio. Debido á súa resistencia, moitos anións pouco comúns foron illados como sales de amonio cuaternario. Exemplos son o pentafluoroxenato de tetrametilamonio, que contén o altamente reactivo ión pentafluoroxenato (XeF−
5). O permanganato pode ser solubilizado en solventes orgánicos, cando se utiliza como o seu sal NBu+
4.[5][6]
Con bases excepcionalmente fortes os catións de amonio cuaternario degrádanse. Sofren unha redistribución de Sommelet–Hauser[7] e unha redistribución de Stevens,[8] así como unha desalquilación baixo as condicións máis duras. Os catións de amonio cuaternario que conteñen unidades N–C–C–H poden tamén sufrir a eliminación de Hofmann e a degradación de Emde.
Aplicacións
editarOs sales de amonio cuaternario utilízanse como desinfectantes, surfactantes, suavizantes de tecidos e como axentes antiestáticos (por exemplo, en xampús). Nos suavizantes líquidos de tecidos e roupa adoitan utilizarse sales de cloruros. En antiestáticos para secadoras adoitan utilizarse sales de sulfatos. Os xeles espermicidas tamén conteñen sales de amonio cuaternario.
Axentes antimicrobianos
editarOs compostos de amonio cuaternario teñen tamén unha actividade antimicrobiana.[10] Certos compostos de amonio cuaternario, especialmente os que conteñen longas cadeas de alquilo, son utilizados como antimicrobianos e disinfectantes. Exemplos son o cloruro de benzalkonio, cloruro de benzetonio, cloruro de metilbenzetonio, cloruro de cetalkonio, cloruro de cetilpiridinio, cetrimonio, cetrimida, cloruro de dofanio, bromuro de tetraetilamonio, cloruro de didecildimetilamonio e bromuro de domifén. Tamén son bos contra os fungos, amebas e virus con envoltura,[11] xa que se cre que actúan alterando a membrana plasmática.[12] Os compostos de amonio cuaternario son letais para unha gran variedade de organismos excepto endósporas, Mycobacterium tuberculosis e virus sen envoltura.
Os compostos de amonio cuaternario son deterxentes catiónicos, e desinfectantes, polo que poden utilizarse para eliminar material orgánico. Son moi efectivos en combinación con fenois. Son desactivados por deterxentes aniónicos (incluíndo os xabóns comúns). Os niveis efectivos son de 200 ppm. Son efectivos a temperaturas de ata 100 °C.
Os sales de amonio cuaternario son utilizados comunmente na industria do catering e como axentes hixienizantes.
Catalizadores de transferencia de fase
editarEn química orgánica, os sales de amonio cuaternario son catalizadores de transferencia de fase (PTC). Ditos catalizadores aceleran as reaccións entre reactivos disoltos en solventes miscibles. O reactivo moi reactivo diclorocarbeno xérase por medio de catalizadores de transferencia de fase por reacción co cloroformo e hidróxido sódico acuoso.
Suavizantes téxtiles
editarNa década de 1950 introduciuse no mercado o cloruro de distearildimetilamonio (DHTDMAC) como suavizante de produtos téxtiles. Este composto deixou de fabricarse porque o catión se biodegradaba moi lentamente. Os suavizantes actuais están baseados en sales de catións de amonio cuaternario, nos que o ácido graxo é ligado ao centro cuaternario por medio dun enlace éster; estes denomínanse comunmente betaína-ésteres ou ésteres-cuaternario e son susceptibles á degradación, por exemplo, por hidrólise.[13] Caracteristicamente, os catións conteñen unha ou dúas cadeas alquilo longas derivadas de ácidos graxos ligadas a un sal de amonio etoxilatado.[14] Outros compostos catiónicos poden obterse a partir de imidazolio, catión guanidinio, sales de aminas substituídos, ou sales de amonio alcoxi cuaternario.[15]
- Surfactantes catiónicos usados como suavizantes téxtiles
-
O cloruro de distearildimetilamonio, un suavizante das primeiras xeracións con baixa biodegradabilidade que se retirou do mercado.
-
Outro diestercuaternario, un suavizante contemporáneo.
-
O cloruro de amonio dimetil éster usado como suavizante.
-
Outro diestercuaternario usado como suavizante.
Retardantes do crecemento das plantas
editarO Cycocel (cloruro de chlormequat) reduce a altura das plantas ao inhibir a produción de xiberelinas, as hormonas vexetais principais responsables da elongación celular. Por tanto, os seus efectos exérceos principalmente sobre os tecidos dos talos, pecíolos e pedúnculos florais. Efectos menores son a redución na expansión das follas, que ten como resultado follas máis grosas e dunha cor verde máis escura.[16]
Distribución na natureza
editarOs compostos de amonio cuaternario están presentes en osmólitos, especificamente glicina betaína, que estabiliza a presión osmótica nas células.[17]
A colina é tamén un precursor do neurotransmisor acetilcolina.
A colina é tamén un constituínte da lecitina, que está presente en moitas plantas e órganos animais.[18] Encóntrase en fosfolípidos. Por exemplo, as fosfatidilcolinas, uns compoñentes principais das membranas biolóxicas, son membros do grupo das lecitinas de substancias graxas en tecidos de plantas e animais.[19]
Efectos sobre a saúde
editarOs compostos de amonio cuaternario poden ter unha ampla variedade de efectos sobre a saúde, entre os cales están desde irritacións suaves da pel e respiratorias [20] ata graves queimaduras cáusticas na pel e no revestimento gastrointestinal (dependendo da concentración), síntomas gastrointestinais (por exemplo, náuseas e vómitos), estado de coma, convulsións, hipotensión e morte.[21]
Crese que son os grupos químicos responsables da reacción anafiláctica que ocorre ao usar bloqueantes neuromusculares durante a anestesia xeral en ciruruxía.[22] O Quaternium-15 é a causa única atopada máis frecuentemente da dermatite de contacto alérxica nas mans (16,5% de 959 casos)[23]
Posibles efectos na reproducion en animais de laboratorio
editarOs desinfectantes baseados en amonio cuaternario (Virex e Quatricide) foron inicialmente identificados como a causa máis probable de aumentos en defectos conxénitos e problemas de fertilidade en ratos de laboratorio en catividade.[24][25]
Notas
editar- ↑ "quaternary ammonium compounds". Compendium of Chemical Terminology (the "Gold Book") (2ª ed.). IUPAC. (2006–) [1997].
- ↑ W. R. Brasen, C. R. Hauser (1954). "o-Methylethylbenzyl Alcohol". Org. Synth. 34: 58. doi:10.15227/orgsyn.034.0058.
- ↑ Smith, Michael B.; March, Jerry (2001). Advanced Organic Chemistry: Reactions, Mechanisms, and Structure (5th ed.). New York, NY: Wiley-Interscience. ISBN 0-471-58589-0.
- ↑ Kosswig, K. (2005), "Surfactants", Ullmann's Encyclopedia of Industrial Chemistry, Weinheim: Wiley-VCH, doi:10.1002/14356007.a25_747
- ↑ Herriott, Arthur W. (1977). "Purple benzene: Solubilization of anions in organic solvents". J. Chem. Educ. 54 (4): 229. Bibcode:1977JChEd..54Q.229H. doi:10.1021/ed054p229.1.
- ↑ Doheny, Anthony J., Jr.; Ganem, Bruce (1980). "Purple benzene revisited". J. Chem. Educ. 57 (4): 308. Bibcode:1980JChEd..57..308D. doi:10.1021/ed057p308.1.
- ↑ Brasen, W. R.; Hauser, C. R. (1963). "2-Methylbenzyldimethylamine". Org. Synth. cv4p0585.
- ↑ Pine, Stanley H. (2011). "The Base-Promoted Rearrangements of Quaternary Ammonium Salts". Organic Reactions. ISBN 0471264180. doi:10.1002/0471264180.or018.04.
- ↑ Maximilian Lackner, Josef Peter Guggenbichler "Antimicrobial Surfaces". Ullmann's Encyclopedia of Industrial Chemistry, Wiley-VCH, Weinheim, 2013. doi 10.1002/14356007.q03_q01
- ↑ Jia, Zhishen; Shen, Dongfeng; Xu, Weiliang (2001). "Synthesis and antibacterial activities of quaternary ammonium salt of chitosan". Carbohydrate Res. 333 (1): 1–6. PMID 11423105. doi:10.1016/S0008-6215(01)00112-4.
- ↑ Abedon, Stephen T. "Specific Antimicrobials". Ohio State University. Arquivado dende o orixinal o 15 de outubro de 2008. Consultado o decembro de 2008.
- ↑ Edmund F. Palermo, Dong-Kuk Lee, Ayyalusamy Ramamoorthy, and Kenichi Kuroda. The Role of Cationic Group Structure in Membrane Binding and Disruption by Amphiphilic Copolymers. J Phys Chem B. 2011 Jan 20; 115(2): 366–375. Publicado on line 2010 Dec 21. doi 10.1021/jp1083357. PMCID: PMC3021096. PMID 21171655.
- ↑ Hellberg, Per-Erik; Bergström, Karin; Holmberg, Krister (xaneiro de 2000). "Cleavable surfactants". J. Surfact. Deterg. 3 (1): 81–91. doi:10.1007/s11743-000-0118-z.
- ↑ "Henkel Consumer Info". Henkelconsumerinfo.com. Arquivado dende o orixinal o 18 de outubro de 2019. Consultado o 2009-06-04.
- ↑ Smulders, E.; Sung, E. (2005), [ "Laundry Detergents, 2. Ingredients and Products"], Ullmann's Encyclopedia of Industrial Chemistry, Weinheim: Wiley-VCH, doi:10.1002/14356007.o15_013
- ↑ "Archived copy". Arquivado dende o orixinal o 25 de setembro de 2011. Consultado o July 19, 2012. Wageningen Agricultural University, The Netherlands
- ↑ Sleator, Roy D.; Wouters, Jeroen; Gahan, Cormac G. M.; Abee, Tjakko; Hill, Colin (2001). "Analysis of the Role of OpuC, an Osmolyte Transport System, in Salt Tolerance and Virulence Potential of Listeria monocytogenes". Appl. Environ. Microbiol. 67: 2692–2698. PMC 92926. PMID 11375182. doi:10.1128/AEM.67.6.2692-2698.2001.
- ↑ Zeisel SH; da Costa KA (novembro de 2009). "Choline: an essential nutrient for public health". Nutrition Reviews 67 (11): 615–23. PMC 2782876. PMID 19906248. doi:10.1111/j.1753-4887.2009.00246.x.
- ↑ Jackowski, Suzanne; Cronan, jr., John E.; Rock, Charles O. (1991). "Chapter 2: Lipid metabolism in procaryotes". En Vance, Dennis E.; Vance, J. Biochemistry of Lipids, Lipoproteins and Membranes. Elsevier. pp. 80–81. ISBN 0-444-89321-0.
- ↑ Bello, Anila; Quinn, Margaret M.; Perry, Melissa J.; Milton, Donald K. (2009). "Characterization of occupational exposures to cleaning products used for common cleaning tasks-a pilot study of hospital cleaners". Environmental Health 8: 11. PMC 2678109. PMID 19327131. doi:10.1186/1476-069X-8-11.
- ↑ Quaternary ammonium (PIM G022)
- ↑ Harper, N. J.; Dixon, T.; Dugué, P.; Edgar, D. M.; Fay, A.; Gooi, H. C.; Herriot, R.; Hopkins, P.; Hunter, J. M.; Mirakian, R.; Pumphrey, R. S.; Seneviratne, S. L.; Walls, A. F.; Williams, P.; Wildsmith, J. A.; Wood, P.; Nasser, A. S.; Powell, R. K.; Mirakhur, R.; Soar, J.; Working Party of the Association of Anaesthetists of Great Britain & Ireland (2009). "Suspected anaphylactic reactions associated with anaesthesia". Anaesthesia 64 (2): 199–211. PMC 3082210. PMID 19143700. doi:10.1111/j.1365-2044.2008.05733.x.
- ↑ Warshaw, E. M.; Ahmed, R. L.; Belsito, D. V.; Deleo, V. A.; Fowler, J. F., Jr.; Maibach, H. I.; Marks, J. G., Jr.; Toby Mathias, C. G.; Pratt, M. D.; Rietschel, R. L.; Sasseville, D; Storrs, F. J.; Taylor, J. S.; Zug, K. A.; North American Contact Dermatitis Group (2007). "Contact dermatitis of the hands: Cross-sectional analyses of North American Contact Dermatitis Group Data, 1994-2004". J. Am. Acad. Dermatol. 57 (2): 301–314. PMID 17553593. doi:10.1016/j.jaad.2007.04.016.
- ↑ Hunt, P (xuño de 2008). "Lab disinfectant harms mouse fertility. Patricia Hunt interviewed by Brendan Maher". Nature 453 (7198): 964. PMID 18563110. doi:10.1038/453964a.
- ↑ Melin VE, Potineni H, Hunt P, Griswold J, Siems B, Werre SR, Hrubec TC (2014). "Exposure to common quaternary ammonium disinfectants decreases fertility in mice". Reprod. Toxicol. 50: 163–70. PMC 4260154. PMID 25483128. doi:10.1016/j.reprotox.2014.07.071.
Véxase tamén
editarLigazóns externas
editar- Toxicities of quaternary ammonium
- Zhang, Chang; Cui, Fang; Zeng, Guang-ming; Jiang, Min; Yang, Zhong-zhu; Yu, Zhi-gang; Zhu, Meng-ying; Shen, Liu-qing (15 June 2015). "Quaternary ammonium compounds (QACs): A review on occurrence, fate and toxicity in the environment". Sci. Total Env. 518–519: 352–362. Bibcode:2015ScTEn.518..352Z. doi:10.1016/j.scitotenv.2015.03.007.