Amonio
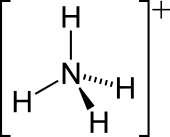
O catión amonio é un ión poliatómico con carga positiva coa fórmula química NH+
4. Está formado pola protonación do amoníaco (NH3). O amonio é tamén un nome xeral da aminas substituídas e catións de amonio cuaternario cargados positivamente ou protonados (NR+
4), onde un ou máis átomos de hidróxeno son substituídos por grupos orgánicos (indicados por R).
| Amonio | |
|---|---|
 | |

|

|
Amonio | |
Azanio[1] | |
| Identificadores | |
| Número CAS | 14798-03-9 |
| PubChem | 16741146 |
| ChemSpider | 218 |
| MeSH | D000644 |
| ChEBI | CHEBI:CHEBI:28938 |
| Imaxes 3D Jmol | Image 1 |
| |
| |
| Propiedades | |
| Fórmula molecular | H4N |
| Masa molar | 18,04 g mol−1 |
| Acidez (pKa) | 9.25 |
| Estrutura | |
| Forma da molécula | Tetraédrico |
| Se non se indica outra cousa, os datos están tomados en condicións estándar de 25 °C e 100 kPa. | |
Propiedades ácido base
editarO ión amonio xérase cando o amoníaco, unha base débil, reacciona cun ácido de Brønsted (doante de protóns):
- H+ + NH3 → NH+
4
O ión amonio é medianamente ácido, reaccionando coas bases de Brønsted para volver a converterse en molécula de amoníaco non cargada:
- NH+
4 + B− → HB + NH3
Así, o tratamento de solucións concentradas de sales de amonio con bases fortes orixina amoníaco. Cando o amoníaco se disolve en auga, unha pequena cantidade del convértese en ións amonio:
- H2O + NH3 ⇌ OH− + NH+
4
O grao no cal o amoníaco dá lugar a ións amonio depende do pH da solución. Se o pH é baixo, o equilibrio desprázase á dereita e máis moléculas de amoníaco se converten en ións amonio. Se o pH é alto (a concentración de ión hidróxeno é baixa), o equilibrio desprázase á esquerda: o ión OH capta un protón do ión amonio, xerando amoníaco.
A formación de compostos de amonio pode producirse na fase de vapor; por exemplo, cando o vapor de amoníaco entra en contacto con vapor de cloruro de hidróxeno, fórmase unha nube branca de cloruro de amonio, que finalmente se establece como un sólido formando unha fina capa branca sobre as superficies.
A conversión de amonio en amoníaco conséguese doadamene coa adición de bases fortes.
Sales de amonio
editarO catión amonio encóntrase en varios sales como o carbonato de amonio, cloruro de amonio e nitrato de amonio. Os sales de amonio máis simples son moi solubles en auga. Unha excepción é o hexacloroplatinato de amonio, cuxa formación se usaba anteriormente como unha proba da presenza de amonio. Os sales de amonio de nitrato e especialmente perclorato son moi explosivos, e neses casos o amonio é un axente redutor.
Nun proceso pouco común, os ións amonio forman unha amálgama. Tales especies prepáranse por electrólise dunha solucion de amonio usando un cátodo de mercurio.[2] Esta amálgama descomponse finalmente para liberar amoníaco e hidróxeno.[3]
Estrutura e enlaces
editarO par de electróns solitarios do átomo de nitróxeno (N) do amoníaco, representado como unha liña sobre o N, forma o enlae cun protón (H+). Desde ese momento, os catro enlaces N–H formados son equivalentes e son enlaces covalentes polares. O ión ten unha estruturs tetraédrica e é isoelectrónico co metano e borohidruro. En canto ao tamaño, o catión amonio (riónico = 175 pm) parécese ao catión cesio (riónico = 183 pm).
Ións amonio orgánicos
editar- Véxase tamén: Amina.
Os átomos de hidróxeno do ión amonio poden ser substituídos por un grupo alquilo ou algún outro grupo orgánico para formar un ión amonio substituído (na nomenclatura da IUPAC: ión aminio). Dependendo do número de grupos orgánicos, o catión amonio denomínase primario, secundario, terciario, ou cuaternario. Coa excepción dos catións de amonio cuaternario, os catións de amonio orgánicos son ácidos débiles.
Un exemplo de reacción na que se forma un ión amonio é a que se produce entre a dimetilamina, (CH3)2NH, e un ácido para dar o catión dimetilaminio, (CH3)2NH+
2:
Os catións de amonio cuaternarios teñen catro grupos orgánicos unidos ao átomo de nitróxeno, e carecen de átomo de hidróxeno enlazado ao átomo de nitróxeno. Estes catións, como o catión tetra-n-butilamonio, son utilizados ás veces para substituír os ións sodio ou potasio para incrementar a solubilidade dun anión asociado en solventes orgánicos. Os sales de amonio primarios, secundarios e terciarios realizan a mesma función, pero son menos lipófilos. Utilízanse tamén como catalizadores de transferencia de fase e surfactantes.
Unha clase pouco habitual de sales de amonio orgánicos son derivados de catións radical amina, R3N+• como o tris(4-bromofenil)amonio hexacloroantimonato.
Bioloxía
editarOs ións amonio son un produto residual do metabolismo dos animais. Nos peixes e invertebrados acuáticos é excretado directamente á auga. En mamíferos, tiburóns e anfibios, é convertido en urea no ciclo da urea, porque a urea é menos tóxica e pode ser almacenada máis eficientemente. En aves, réptiles e caracois terrestres, o amonio metabólico convértese en ácido úrico, que é sólido e, por tanto, pode ser excretado cunha mínima perda de auga.[4]
O amonio é unha importante fonte de nitróxeno para moitas especies de plantas, especialmente as que viven en solos hipóxicos. Porén, tamén é tóxico para a maioría das especies cultivadas e raramente se aplica como fonte de nitróxeno para o solo.[5]
Amonio metálico
editarO ión amonio ten unhas propiedades moi similares aos metais alcalinos máis pesados ca el e adoita considerarse emparentado con eles.[6][7][8] O amonio espérase que se comporte como un ión metálico (NH+
4 nun mar de electróns) a moi altas presións, como as reinantes no interior dos planetas xigantes gasosos como Urano e Neptuno.[7][8]
En condicións normais, o amonio non existe como metal puro, pero si como amálgama (en aliaxe co mercurio).[9]
Notas
editar- ↑ International Union of Pure and Applied Chemistry (2005). Nomenclature of Inorganic Chemistry (IUPAC Recommendations 2005). Cambridge (UK): RSC–IUPAC. ISBN 0-85404-438-8. pp. 71,105,314. Versión electrónica.
- ↑ "Pseudo-binary compounds". Arquivado dende o orixinal o 27 de xullo de 2020. Consultado o 27 de agosto de 2018.
- ↑ "Ammonium Salts". VIAS Encyclopedia.
- ↑ Campbell, Neil A.; Jane B. Reece (2002). "44". Biology (6th ed.). San Francisco: Pearson Education, Inc. pp. 937–938. ISBN 0-8053-6624-5.
- ↑ Britto, DT; Kronzucker, HJ (2002). "NH4+ toxicity in higher plants: a critical review" (PDF). Journal of Plant Physiology 159 (6): 567–584. doi:10.1078/0176-1617-0774.
- ↑ Holleman, Arnold Frederik; Wiberg, Egon (2001), Wiberg, Nils, ed., Inorganic Chemistry, translated by Eagleson, Mary; Brewer, William, San Diego/Berlin: Academic Press/De Gruyter, ISBN 0-12-352651-5
- ↑ 7,0 7,1 Stevenson, D. J. (November 20, 1975). "Does metallic ammonium exist?". Nature (Nature Publishing Group) 258 (5532): 222–223. Bibcode:1975Natur.258..222S. doi:10.1038/258222a0. Consultado o 13 de xaneiro do 2012.
- ↑ 8,0 8,1 Bernal, M. J. M.; Massey, H. S. W. (February 3, 1954). "Metallic Ammonium" (PDF). Monthly Notices of the Royal Astronomical Society (Wiley-Blackwell for the Royal Astronomical Society) 114 (2): 172–179. Bibcode:1954MNRAS.114..172B. doi:10.1093/mnras/114.2.172. Consultado o January 13, 2012.
- ↑ Reedy, J.H. (October 1, 1929). "Lecture demonstration of ammonium amalgam". Journal of Chemical Education 6 (10): 1767. Bibcode:1929JChEd...6.1767R. doi:10.1021/ed006p1767. Consultado o October 28, 2015.