Resorción ósea
A resorción ósea ou reabsorción ósea é a reabsorción do tecido óseo, é dicir, o proceso no que un tipo de céulas óseas chamadas osteoclastos destrúen o tecido do óso[1] e liberan os minerais, que ten como resultado unha transferencia de calcio desde o tecido óseo ao sangue.[2]
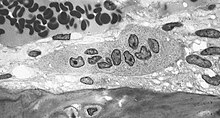
Os osteoclastos son células multinucleadas que conteñen numerosas mitocondrias e lisosomas. Estas son as células responsables da reabsorción do óso. Os osteoclastos están presentes xeralmente na capa externa do óso, xusto por debaixo do periósteo. A adhesión dos osteoclastos á osteona empeza o proceso. O osteoclasto despois induce un pregamento cara ao interior da súa membrana plasmática e segrega colaxenase e outros enzimas importantes no proceso de resorción. Libéranse ao fluído extracelular altos niveis de calcio, magnesio, fosfato e produtos do coláxeno a medida que os osteoclastos fan túneles no óso mineralizado. Os osteoclastos son prominentes na destrución de tecido que se observa na artrite psoriática e en trastornos reumatolóxicos.[3]
O corpo humano está nun constante estado de remodelación do óso.[4] A remodelación ósea é un proceso que mantén a fortaleza do óso e a homeostase iónica ao substituír partes discretas do óso vello por paquetes de matriz proteinácea de nova síntese.[5] O óso é reabsorbido polos osteoclastos e é depositado polos osteoblastos nun proceso chamado osificación.[6] A actividade dos osteocitos xoga un papel neste proceso. As condicións que teñen como resultado un decrecemento da masa ósea poden ser causadas por un incremento da resorción ou unha diminución da osificación. Durante a nenez, a formación do óso excede a resorción. A medida que ten lugar o proceso de envellecemento, a resorción excede a formación.[5]
A velocidade de resorción ósea é moito maior nas mulleres vellas posmenopáusicas debido á deficiencia de estróxenos relacionada coa menopausa.[7] Os tratamentos comúns inclúen fármacos que incrementan a densidade mineral. Os bisfosfonatos, inhibidores de RANKL, moduladores do receptor de estróxeno selectivos (SERMs), terapia de substitución hormonal e a calcitonina son algúns dos tratamentos comúns.[8] O exercicio para manter o peso corporal baixo tende a eliminar os efectos negativos da resorción ósea.[9]
Regulación
editarA resorción ósea está moi estimulada ou inhibida por sinais procedentes doutras partes do corpo, dependendo da demanda de calcio.
Os receptores de membrana sensibles ao calcio da glándula paratiroide monitorizan os niveis de calcio no fluído extracelular. Os baixos niveis de calcio estimulan a liberación de hormona paratiroide (PTH) polas células principais da glándula paratiroide.[4] Ademais dos seus efectos sobre os riles e intestino, a PTH fai incrementar o númeo e actividade dos osteoclastos. O incremento da actividade dos osteoclastos xa existentes é o efecto inicial da PTH e empeza en minutos e increméntase en poucas horas.[4] A elevación continua dos niveis de PTH incrementa a abundancia de osteoclastos. Isto causa unha maior resorción dos ións calcio e fosfato.[4]
Por outra parte, os altos niveis de calcio no sangue orixinan un decrecemento da liberación de PTH desde a glándula paratiroide, diminuíndo a cantidade e actividade dos osteoclastos, e o resultado é unha menor resorción ósea. A vitamina D incrementa a absorción de calcio e fosfato no tracto intestinal, elevando os niveis plasmáticos de calcio,[4] e así diminuíndo a resorción osea.
O calcitriol (1,25-dihidroxicolecalciferol) é a forma activa da vitamina D3.[10] Ten numerosas funcións implicadas nos niveis de calcio sanguíneos. Investigacións recentes indican que o calcitriol causa unha redución na formación de osteoclastos e a resorción ósea.[11][12] Un incremento da inxesta de vitamina D3 debería causar unha diminución da resorción ósea, pero observouse que a administración oral de vitamina D non está corelacionada linearmente co incremento dos niveis séricos de calcifediol,[13] o precursor do calcitriol.
A calcitonina é unha hormona segregada pola tiroide en humanos. A calcitonina fai diminuír a actividade dos oseoclastos e diminúe a formación de osteoclastos, tendo como resultado un decrecemento da resorción.[4] A calcitonina ten un maior efecto en nenos pequenos que en adultos e xoga un papel máis pequeno na remodelación que a PTH.[4]
Nalgúns casos nos que a resorción supera a osificación, o óso é degradado moito máis rapidamente do que pode ser renovado. O óso faise máis poroso e fráxil, expoñendo á xente ao risco de fracturas. Dependendo de onde ocorre a reabsorción ósea, poden orixinarse problemas adicionais como a perda de dentes. Isto pode ser causado por condicións como o hiperparatiroidismo e a hipovitaminose D ou incluso a diminución da produción hormonal nos anciáns. Algunhas doenzas con sintomas de diminución da densidade son a osteoporose e o raquitismo.
Algunhas persoas que experimentaron un incremento da resorción ósea e un decrecemento da formación ósea son os astronautas. Debido a encontrarse nun ambiente de gravidade cero, os astronautas non necesitan facer traballar o seu sistema musculoesquelético tan duramente coma estando na Terra. A osificación diminúe debido á falta de estrés, mentres que a resorción increméntase, o que leva a un decrecemento neto da densidade ósea.[14]
Alcoholismo
editarOs efectos do alcohol sobre a densidade mineral ósea son ben coñecidos e están ben estudados en poboacións animais e humanas. Por vías directas e indirectas, a exposición prolongada ao etanol incrementa o risco de fractura ao diminuír a densidade mineral ósea e favorecer a osteoporose. Os efectos indirectos do abuso do alcohol ocorren por medio da hormona do crecemento, esteroides sexuais e estrés oxidativo.
A hormona do crcemento é un importante regulador do crecemento e remodelación ósea en adultos e actúa a través do factor de crecemento similar á insulina 1 (IGF1) para estimular a diferenciación osteoblástica.[15] O alcoholismo crónico fai diminuír os niveis de IGF1, que suprimen a capacidade da hormona do crecemento de incrementar a densidade mineral ósea.[15]
O incremento do consumo de alcohol está ligado ao decrecemento dos niveis de testosterona e estradiol séricos, o que á súa vez leva á activación da proteína RANK (un receptor de TNF) que promove a formación de osteoclastos.[16] O estrés oxidativo prodúcese cando o etanol induce a formación de NOX, causando a produción de especies reactivas do oxíxeno nos osteoblastos, que poden finalmente orixinar a senescencia celular.[17] Os efectos directos do alcoholismo crónico son aparentes nos osteoblastos, osteoclastos e osteocitos. O etanol suprime a actividade e a diferenciación dos osteoblastos.
Ao mesmo tempo, ten un efecto directo sobre a actividade dos osteoclastos. Isto ten como resultado un incremento da velocidade de resorción ósea e unha diminución da densidade mineral ósea debido ao incremento do número de ocos e áreas con ocos no óso.[18][19] Os osteocitos viables (outro tipo de célula ósea) poden previr a osteoclastoxénese, mentres que os osteocitos apoptóticos tenden a inducir a estimulación dos osteoclastos. A estimulación da apoptose de osteocitos pola exposición ao alcohol pode explicar o descenso da densidade mineral ósea en bebedores crónicos.[19][20]
Notas
editar- ↑ Bone Resorption Medical Subject Headings (MeSH) na Biblioteca Nacional de Medicina dos EUA.
- ↑ Teitelbaum SL. (2000). "Bone resorption by osteoclasts.". Science 289 (5484): 1504–8. PMID 10968780. doi:10.1126/science.289.5484.1504.
- ↑ Mensah, Kofi A.; Schwarz, Edward M.; Ritchlin, Christopher T. (2008-08-01). "Altered Bone Remodeling in Psoriatic Arthritis". Current Rheumatology Reports 10 (4): 311–317. ISSN 1523-3774. PMC 2656567. PMID 18662512. doi:10.1007/s11926-008-0050-5.
- ↑ 4,0 4,1 4,2 4,3 4,4 4,5 4,6 Guyton and Hall Textbook of Medical Physiology, 12th Edition. ISBN 1416045740
- ↑ 5,0 5,1 Clarke, Bart (2008-11-01). "Normal Bone Anatomy and Physiology". Clinical Journal of the American Society of Nephrology 3 (Suppl 3): S131–S139. ISSN 1555-9041. PMC 3152283. PMID 18988698. doi:10.2215/CJN.04151206.
- ↑ Maurel, D. B.; Jaffre, C.; Rochefort, G. Y.; Aveline, P. C.; Boisseau, N.; Uzbekov, R.; Gosset, D.; Pichon, C.; Fazzalari, N. L. (2011-09-01). "Low bone accrual is associated with osteocyte apoptosis in alcohol-induced osteopenia". Bone 49 (3): 543–552. ISSN 1873-2763. PMID 21689804. doi:10.1016/j.bone.2011.06.001.
- ↑ Feng, Xu; McDonald, Jay M. (2011-01-01). "Disorders of Bone Remodeling". Annual Review of Pathology 6: 121–145. ISSN 1553-4006. PMC 3571087. PMID 20936937. doi:10.1146/annurev-pathol-011110-130203.
- ↑ Russell, G.; Mueller, G.; Shipman, C.; Croucher, P. (2001-01-01). "Clinical disorders of bone resorption". Novartis Foundation Symposium 232: 251–267; discussion 267–271. ISSN 1528-2511. PMID 11277085.
- ↑ Shanb, Alsayed A.; Youssef, Enas F. (2014-01-01). "The impact of adding weight-bearing exercise versus nonweight bearing programs to the medical treatment of elderly patients with osteoporosis". Journal of Family and Community Medicine 21 (3): 176–181. ISSN 1319-1683. PMC 4214007. PMID 25374469. doi:10.4103/2230-8229.142972.
- ↑ Institute of Medicine (US) Committee to Review Dietary Reference Intakes for Vitamin D and Calcium; Ross AC, Taylor CL, Yaktine AL, et al., editors. Dietary Reference Intakes for Calcium and Vitamin D. Washington (DC): National Academies Press (US); 2011. 3, Overview of Vitamin D. Available from: https://www.ncbi.nlm.nih.gov/books/NBK56061/
- ↑ Kikuta J, Kawamura S, Okiji F, Shirazaki M, Sakai S, Saito H, Ishii M (Apr 2013). "Sphingosine-1-phosphate-mediated osteoclast precursor monocyte migration is a critical point of control in antibone-resorptive action of active vitamin D.". Proceedings of the National Academy of Sciences of the United States of America 110 (17): 7009–13. PMC 3637769. PMID 23569273. doi:10.1073/pnas.1218799110.
- ↑ Yamamoto Y, Yoshizawa T, Fukuda T, Shirode-Fukuda Y, Yu T, Sekine K, Sato T, Kawano H, Aihara K, Nakamichi Y, Watanabe T, Shindo M, Inoue K, Inoue E, Tsuji N, Hoshino M, Karsenty G, Metzger D, Chambon P, Kato S, Imai Y (Mar 2013). "Vitamin D receptor in osteoblasts is a negative regulator of bone mass control". Endocrinology 154 (3): 1008–20. PMID 23389957. doi:10.1210/en.2012-1542.
- ↑ Stamp TC, Haddad JG, Twigg CA (Jun 1977). "Comparison of oral 25-hydroxycholecalciferol, vitamin D, and ultraviolet light as determinants of circulating 25-hydroxyvitamin D.". The Lancet 1 (8026): 1341–3. PMID 69059. doi:10.1016/s0140-6736(77)92553-3.
- ↑ Iwamoto J, Takeda T, Sato Y (Jun 2005). "Interventions to prevent bone loss in astronauts during space flight". The Keio Journal of Medicine 54 (2): 55–9. PMID 16077253. doi:10.2302/kjm.54.55.
- ↑ 15,0 15,1 Maddalozzo, G. F.; Turner, R. T.; Edwards, C. H. T.; Howe, K. S.; Widrick, J. J.; Rosen, C. J.; Iwaniec, U. T. (2009-09-01). "Alcohol alters whole body composition, inhibits bone formation, and increases bone marrow adiposity in rats". Osteoporosis International 20 (9): 1529–1538. ISSN 1433-2965. PMID 19238309. doi:10.1007/s00198-009-0836-y.
- ↑ Ronis, Martin J. J.; Wands, Jack R.; Badger, Thomas M.; de la Monte, Suzanne M.; Lang, Charles H.; Calissendorff, Jan (2007-08-01). "Alcohol-induced disruption of endocrine signaling". Alcoholism, Clinical and Experimental Research 31 (8): 1269–1285. ISSN 0145-6008. PMID 17559547. doi:10.1111/j.1530-0277.2007.00436.x.
- ↑ Chen, Jin-Ran; Shankar, Kartik; Nagarajan, Shanmugam; Badger, Thomas M.; Ronis, Martin J. J. (2008-01-01). "Protective effects of estradiol on ethanol-induced bone loss involve inhibition of reactive oxygen species generation in osteoblasts and downstream activation of the extracellular signal-regulated kinase/signal transducer and activator of transcription 3/receptor activator of nuclear factor-kappaB ligand signaling cascade". The Journal of Pharmacology and Experimental Therapeutics 324 (1): 50–59. ISSN 1521-0103. PMID 17916759. doi:10.1124/jpet.107.130351.
- ↑ Bonewald, Lynda F. (2011-02-01). "The amazing osteocyte". Journal of Bone and Mineral Research 26 (2): 229–238. ISSN 1523-4681. PMC 3179345. PMID 21254230. doi:10.1002/jbmr.320.
- ↑ 19,0 19,1 Verborgt, Olivier; Tatton, Nadine A.; Majeska, Robert J.; Schaffler, Mitchell B. (2002-05-01). "Spatial distribution of Bax and Bcl-2 in osteocytes after bone fatigue: complementary roles in bone remodeling regulation?". Journal of Bone and Mineral Research 17 (5): 907–914. ISSN 0884-0431. PMID 12009022. doi:10.1359/jbmr.2002.17.5.907.
- ↑ Maurel DB, Jaffre C, Rochefort GY, Aveline PC, Boisseau N, Uzbekov R, Gosset D, Pichon C, Fazzalari NL, Pallu S, Benhamou CL (September 2011). "Low bone accrual is associated with osteocyte apoptosis in alcohol-induced osteopenia". Bone 49 (3): 543–52. PMID 21689804. doi:10.1016/j.bone.2011.06.001.