Parathormona
A parathormona (PTH) ou hormona paratiroide é unha hormona peptídica de 84 aminoácidos segregada polas células principais da glándula paratiroide, que actúa incrementando a concentración de calcio (Ca2+) no sangue (efecto oposto ao da hormona calcitonina da tiroide, que fai decrecer a concentración de calcio). A PTH incrementa a concentración de calcio sanguínea actuando sobre o receptor da hormona paratiroide 1 (abundante no óso e riles) e sobre o receptor da hormona paratiroide 2 (abundante no sistema nervioso central, páncreas, testículos, e placenta). A vida media da PTH no organismo é de aproximadamente 4 minutos.[1] Ten unha masa molecular de 9,4 kDa.[2]
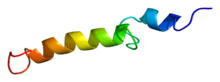
Estrutura
editarO fragmento 1-34 N-terminal da PTH humana (hPTH-(1-34)) foi cristalizado e a estrutura foi definida cunha resolución de 0,9 Å. A hPTH-(1-34) cristaliza como un dímero helicoidal longo, lixeiramente dobrado. As análises revelan que a conformación en hélice alfa estendida da hPTH-(1-34) é probablemente a conformación bioactiva.[3]
Funcións
editarRegulación do calcio sérico
editarA hormona paratiroide regula o calcio sérico por medio dos seus efectos sobre os seguintes tecidos:[5]
| Rexión | Efecto |
| óso | Aumenta a liberación de calcio do gran deposito contido nos ósos.[6] Durante a remodelación normal dos ósos prodúcese a reabsorción ósea, que é a destrución de parte do tecido óseo polos osteoclastos, a cal está indirectamente estimulada pola PTH. A estimulación é indirecta, xa que os osteoclastos non teñen receptores para a PTH; o que ocorre realmente é que a PTH se une aos osteoblastos, as células responsables de crear tecido óseo. A PTH estimula aos osteoblastos a incrementar a súa expresión do RANKL (ligando do receptor-activador do factor nuclear kappa-B) e inhibir a súa expresión de osteoprotexerina (OPG). A osteoprotexerina úneso ao RANKL e bloquea a súa interacción co RANK, que é o receptor do RANKL. A unión do RANKL ao RANK (facilitada pola diminución de osteoprotexerina) estimula aos precursores dos osteoclastos a formar novos osteoclastos, o cal finalmente fai aumentar a reabsorción ósea. |
| riles | Aumenta a reabsorción activa de calcio e magnesio nos túbulos distais dos riles e na rama ascendente delgada da asa de Henle. A medida que o óso e degrada, libérase calcio e fosfato. Tamén decrece a reabsorción de fosfato, cunha perda neta na concentración plasmática de fosfato. Cando a relación calcio:fosfato se incrementa, hai máis calcio libre en circulación.[7] |
| intestino vía riles | Aumenta a absorción de calcio no intestino ao incrementar a produción de vitamina D activada. A activación da vitamina D ocorre nos riles. A PTH fai aumentar a actividade da 25-hidroxivitamina D3 1-alfa-hidroxilase, o encima responsable da hidroxilación 1-alfa da 25-hidroxivitamina D, convertendo a vitamin D na súa forma activa (1,25-dihidroxi vitamina D). Esta forma activada da vitamina D incrementa a absorción de ións calcio (Ca2+) no intestino por medio da calbindina. |
A PTH foi unha das primeiras hormonas que se viu que utilizaban o sistema de segundo mensaxeiro da proteína G e adenilato ciclase.
O nivel normal no plasma de calcio está entre 8,5 e 10,2 mg/dL (2,12 mmol/L a 2,55 mmol/L).[9]
Regulación do fosfato sérico
editarA PTH reduce a reabsorción de fosfato nos túbulos proximais dos riles,[7] o cal significa que se excreta máis fosfato nos ouriños.
Porén, a PTH aumenta a liberación ao sangue de fosfato do intestino e ósos. No óso, libérase un pouco máis de calcio ca de fosfato como resultado da destrución do tecido óseo. Nos intestinos, a absorción de calcio e fosfato está mediada por un incremento de vitamina D activada. A absorción de fosfato non é dependente da vitamina D como si o é a de calcio. O resultado final da liberación de PTH é unha pequena caída neta na concentración sérica de fosfato.
Síntese de vitamina D
editarA PTH aumenta a actividade do encima 1-α-hidroxilase, o cal converte o 25-hidroxicolecalciferol en 1,25-dihidroxicolecalciferol, a forma activa da vitamina D.
Regulación da secreción de PTH
editarA secreción da hormona paratiroide está controlada principalmente pola concentración de calcio ([Ca2+]) no plasma sanguíneo por medio dunha retroalimentación negativa. As moléculas do receptor sensible ao calcio localizadas nas células da paratiroide detectan as concentracións de Ca2+. A proteína G asociada aos receptores de calcio detecta o calcio extracelular e pode encontrarse na superficie dunha ampla variedade de células distribuídas polo cerebro, corazón, pel, estómago, células C, e outros tecidos. Na glándula paratiroide, cando hai moito calcio extracelular non se produce hormona; así, a detección de altas concentracións de calcio extracelular causan a activación da cascada da proteína G asociada Gq a través da acción da fosfolipase C [10]. Esta hidroliza o fosfatidilinositol 4,5-bisfosfato (PIP2) e libéranse mensaxeiros intracelulares IP3 e diacilglicerol. Finalmente, estes dous mensaxeiros orixinan unha liberación de calcio dos seus depósitos intracelulares e un fluxo de calcio extracelular no espazo citoplasmático. O efecto desta sinalización por niveis elevados de calcio extracelular orixina unha concentración de calcio intracelular, que inhibe a secreción da PTH preformada almacenada en gránulos nas células da glándula paratiroide. A diferenza do mecanismo que utilizan a maioría das células secretoras, o calcio inhibe a fusión das vesículas e a liberación da PTH. Nas paratiroides, é o magnesio o que cumpre este papel de combinar estímulo e secreción. A hipomagnesia pode causar unha paralización da secreción de PTH e orixinar unha forma de hipoparatiroidismo que é reversible [11].
Estimuladores
editar- Diminución da concentración de Ca2+ sérica.
- Diminución suave da concentración sérica de Mg2+.
- Aumento do fosfato sérico (o incremento do fosfato fai que este forme complexos co calcio sérico, formando fosfato cálcico, o cal reduce a estimulación dos receptores sensibles ao Ca, xa que non captan o fosfato cálcico, o que produce un incremento da PTH).
Inhibidores
editar- Aumento da concentración sérica de Ca2+.
- Diminución forte da concentración sérica de Mg2+, que tamén produce síntomas de hipoparatiroidismo (como a hipocalcemia).[12]
Importancia clínica
editar- O nivel sanguíneo alto de PTH denomínase hiperparatiroidismo.
- Se a causa está na glándula paratiroide denomínase hiperparatiroidismo primario. As causas son adenoma de paratiroide, hiperplasia de paratiroide e cáncer de paratiroide.
- Se a causa está fóra da glándula, denomínase hiperparatiroidismo secundario. Pode darse na insuficiencia renal crónica. No hiperparatiroidismo secundario, os niveis de calcio séricos decrecen, o cal causa a hipersecreción de PTH por parte das glándulas paratiroides. A PTH actúa sobre os túbulos proximais dos riles facendo decrecer a reabsorción de fosfato (incrementando a súa excreción nos ouriños, e diminuíndo a súa concentración no soro sanguíneo), pero aumenta a reabsorción activa de calcio e magnesio nos túbuos distais e a rama ascendente delgada da asa de Henle. NOTA: na insuficiencia renal crónica, os riles non poden excretar fosfato nos ouriños. Neste caso de hiperparatiroidismo secundario, o calcio sérico decrece, pero o fosfato sérico increméntase.
- O nivel baixo de PTH no sangue denomínase hipoparatiroidismo. As causas inclúen erros cirúrxicos (por exemplo, a extirpación por erro da paratiroide durante a cirurxía de tiroide), trastornos autoinmunes, e fallos metabólicos conxénitos.
Medidas
editarOs niveis de PTH poden medirse no sangue de diversas formas: como PTH intacta; PTH N-terminal; parte media da PTH, ou como PTH C-terminal, e cada unha destas probas é útil en diferentes situacións clínicas.
O nivel medio de PTH en sangue é de 10-60 pg/mL.
Notas
editar- ↑ Bieglmayer C, Prager G, Niederle B (2002). "Kinetic analyses of parathyroid hormone clearance as measured by three rapid immunoassays during parathyroidectomy". Clin. Chem. 48 (10): 1731–8. PMID 12324490. Arquivado dende o orixinal o 07 de xuño de 2011. Consultado o 21 de xaneiro de 2012.
- ↑ Prahalad AK, Hickey RJ, Huang J; et al. (2006). "Serum proteome profiles identifies parathyroid hormone physiologic response". Proteomics 6 (12): 3482–93. PMID 16705755. doi:10.1002/pmic.200500929.
- ↑ Jin L, Briggs SL, Chandrasekhar S, Chirgadze NY, Clawson DK, Schevitz RW, Smiley DL, Tashjian AH, Zhang F (2000). "Crystal structure of human parathyroid hormone 1-34 at 0.9-A resolution". J. Biol. Chem. 275 (35): 27238–44. PMID 10837469. doi:10.1074/jbc.M001134200.
- ↑ Savvides SN, Boone T, Andrew Karplus P (2000). "Flt3 ligand structure and unexpected commonalities of helical bundles and cystine knots". Nat Struct Biol. 7 (6): 486–491. PMID 10881197. doi:10.1038/75896.; rendered via PyMOL.
- ↑ Coetzee M, Kruger MC (2004). "Osteoprotegerin-receptor activator of nuclear factor-kappaB ligand ratio: a new approach to osteoporosis treatment?". South. Med. J. 97 (5): 506–11. PMID 15180028. doi:10.1097/00007611-200405000-00018.
- ↑ Poole K, Reeve J (2005). "Parathyroid hormone - a bone anabolic and catabolic agent". Curr Opin Pharmacol 5 (6): 612–7. PMID 16181808. doi:10.1016/j.coph.2005.07.004.
- ↑ 7,0 7,1 "Copia arquivada". Arquivado dende o orixinal o 22 de setembro de 2007. Consultado o 21 de xaneiro de 2012.
- ↑ Page 1094 (The Parathyroid Glands and Vitamin D) in: Walter F., PhD. Boron (2003). Elsevier/Saunders, ed. Medical Physiology: A Cellular And Molecular Approaoch. p. 1300. ISBN 1-4160-2328-3.
- ↑ Zieve, MD, MHA, David. "MedlinePlus Medical Encyclopedia: Serum calcium". National Library of Medicine, National Institutes of Health. Consultado o 2009-02-01.
- ↑ Randolph A. Chen and William G. Goodman. Role of the calcium-sensing receptor in parathyroid gland physiology. American Journal of Physiology. (review) [1] Arquivado 09 de abril de 2013 en Wayback Machine.
- ↑ Kensuke Takatsuki, David A. Hanley and Louis M. Sherwood. Effects of magnesium ion on parathyroid hormone secretion in vitro. Calcified Tissue international. Volume 32, Number 1, 201-206, DOI: 10.1007/BF02408542 . [2] Arquivado 13 de setembro de 2019 en Wayback Machine.
- ↑ Linda S. Costanzo (2007). Lippincott, Williams, & Wilkins, ed. BRS Physiology. p. 260. ISBN 978-0781773119.
Véxase tamén
editarOutros artigos
editarBibliografía
editar- Drüeke TB, Massy ZA (2003). "Advanced oxidation protein products, parathyroid hormone and vascular calcification in uremia". Blood Purif. 20 (5): 494–7. PMID 12207101. doi:10.1159/000065203.
- Parfitt AM (2003). "Parathyroid hormone and periosteal bone expansion". J. Bone Miner. Res. 17 (10): 1741–3. PMID 12369776. doi:10.1359/jbmr.2002.17.10.1741.
- Martin TJ (2004). "Does bone resorption inhibition affect the anabolic response to parathyroid hormone?". Trends Endocrinol. Metab. 15 (2): 49–50. PMID 15080150. doi:10.1016/j.tem.2004.01.002.
- Keutmann HT, Sauer MM, Hendy GN; et al. (1979). "Complete amino acid sequence of human parathyroid hormone". Biochemistry 17 (26): 5723–9. PMID 728431. doi:10.1021/bi00619a019.
- Keutmann HT, Niall HD, O'Riordan JL, Potts JT (1975). "A reinvestigation of the amino-terminal sequence of human parathyroid hormone". Biochemistry 14 (9): 1842–7. PMID 1125201. doi:10.1021/bi00680a006.
- Parkinson DB, Thakker RV (1993). "A donor splice site mutation in the parathyroid hormone gene is associated with autosomal recessive hypoparathyroidism". Nat. Genet. 1 (2): 149–52. PMID 1302009. doi:10.1038/ng0592-149.
- Handt O, Reis A, Schmidtke J (1993). "Ectopic transcription of the parathyroid hormone gene in lymphocytes, lymphoblastoid cells and tumour tissue". J. Endocrinol. 135 (2): 249–56. PMID 1474331. doi:10.1677/joe.0.1350249.
- Tonoki H, Narahara K, Matsumoto T, Niikawa N (1991). "Regional mapping of the parathyroid hormone gene (PTH) by cytogenetic and molecular studies". Cytogenet. Cell Genet. 56 (2): 103–4. PMID 1672845. doi:10.1159/000133059.
- Klaus W, Dieckmann T, Wray V; et al. (1991). "Investigation of the solution structure of the human parathyroid hormone fragment (1-34) by 1H NMR spectroscopy, distance geometry, and molecular dynamics calculations". Biochemistry 30 (28): 6936–42. PMID 2069952. doi:10.1021/bi00242a018.
- Arnold A, Horst SA, Gardella TJ; et al. (1990). "Mutation of the signal peptide-encoding region of the preproparathyroid hormone gene in familial isolated hypoparathyroidism". J. Clin. Invest. 86 (4): 1084–7. PMC 296835. PMID 2212001. doi:10.1172/JCI114811.
- Nussbaum SR, Gaz RD, Arnold A (1990). "Hypercalcemia and ectopic secretion of parathyroid hormone by an ovarian carcinoma with rearrangement of the gene for parathyroid hormone". N. Engl. J. Med. 323 (19): 1324–8. PMID 2215618. doi:10.1056/NEJM199011083231907.
- Ahn TG, Antonarakis SE, Kronenberg HM; et al. (1986). "Familial isolated hypoparathyroidism: a molecular genetic analysis of 8 families with 23 affected persons". Medicine (Baltimore) 65 (2): 73–81. PMID 3005800.
- Tregear GW, van Rietschoten J, Greene E; et al. (1975). "Solid-phase synthesis of the biologically active N-terminal 1 - 34 peptide of human parathyroid hormone". Hoppe-Seyler's Z. Physiol. Chem. 355 (4): 415–21. PMID 4474131.
- Niall HD, Sauer RT, Jacobs JW; et al. (1974). "The Amino-Acid Sequence of the Amino-Terminal 37 Residues of Human Parathyroid Hormone". Proc. Natl. Acad. Sci. U.S.A. 71 (2): 384–8. PMC 388010. PMID 4521809. doi:10.1073/pnas.71.2.384.
- Andreatta RH, Hartmann A, Jöhl A; et al. (1973). "[Synthesis of sequence 1-34 of human parathyroid hormone]". Helv. Chim. Acta 56 (1): 470–3. PMID 4721748. doi:10.1002/hlca.19730560139.
- Jacobs JW, Kemper B, Niall HD; et al. (1974). "Structural analysis of human proparathyroid hormone by a new microsequencing approach". Nature 249 (453): 155–7. PMID 4833516. doi:10.1038/249155a0.
- Vasicek TJ, McDevitt BE, Freeman MW; et al. (1983). "Nucleotide sequence of the human parathyroid hormone gene". Proc. Natl. Acad. Sci. U.S.A. 80 (8): 2127–31. PMC 393770. PMID 6220408. doi:10.1073/pnas.80.8.2127.
- Mayer H, Breyel E, Bostock C, Schmidtke J (1983). "Assignment of the human parathyroid hormone gene to chromosome 11". Hum. Genet. 64 (3): 283–5. PMID 6885073. doi:10.1007/BF00279412.
- Hendy GN, Kronenberg HM, Potts JT, Rich A (1982). "Nucleotide sequence of cloned cDNAs encoding human preproparathyroid hormone". Proc. Natl. Acad. Sci. U.S.A. 78 (12): 7365–9. PMC 349267. PMID 6950381. doi:10.1073/pnas.78.12.7365.
- Hendy GN, Bennett HP, Gibbs BF; et al. (1995). "Proparathyroid hormone is preferentially cleaved to parathyroid hormone by the prohormone convertase furin. A mass spectrometric study". J. Biol. Chem. 270 (16): 9517–25. PMID 7721880. doi:10.1074/jbc.270.16.9517.