Melanopsina
Opsina 4
| |
| Identificadores | |
| Símbolo | OPN4, MOP |
| Entrez | 94233 |
| OMIM | |
| RefSeq | NP_001025186 |
| UniProt | Q9UH96 |
| Outros datos | |
| Locus | Cr. 10 (88.41 – 88.43 Mb) |
A melanopsina é un fotopigmento que se encontra nalgunhas células ganglionares da retina dos ollos humanos e doutros vertebrados, que se denominan células ganglionares da retina fotosensibles intrinsecamente.[1] Estas células poden percibir a luz pero reaccionan de forma moito máis lenta aos cambios visuais ca as células bastón e cono da retina. Estas células afectan aos ritmos circadianos, ao reflexo pupilar (grao de abertura da pupila), e a outras funcións relacionadas coa luz ambiental, pero non interveñen na visión de imaxes.
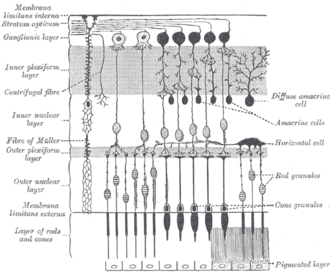
En estrutura, a melanopsina é unha opsina, unha variedade de receptor acoplado á proteína G de proteína retinilideno. A melanopsina é máis sensible á luz azul.[2] Un receptor baseado na melanopsina foi ligado á asociación que hai entre a sensibilidade á luz e as dores de cabeza fortes.[3]
A melanopsina difire doutros fotopigmentos opsinas dos vertebrados. De feito, lembra en moitos aspectos as opsinas de invertebrado, como na súa secuencia de aminoácidos e fervenza de reaccións de sinalización de "augas abaixo". Como as opsinas de vertebrados, a melanopsina parece ser un fotopigmento biestable, cunha actividade fotoisomerase intrínseca,[4] e produce unha sinalización celular a través dunha proteína G da familia Gq.
Descubrimento
editarEn 1998, descubriuse a melanopsina nas células sensibles á luz especializadas da pel da ra.[5] Un ano despois, os investigadores atoparon que a sincronización (entrainment) do rato a un ciclo de luz-escuridade mantíñase en ausencia de conos e bastóns. Esta observación levou á conclusión de que nin os bastóns nin os conos, situados na capa externa da retina, son necesarios para a sincronización circadiana e que hai unha terceira clase de fotorreceptores no ollo dos mamíferos.[6] En 2000, descubriuse que a melanopsina só se expresaba nas capas internas da retina dos animais, incluíndo os humanos, e que era unha mediadora en tarefas fotorreceptoras non visuais.[7]
Tamén se atopou que estas respostas persistían cando se bloqueaba a comunicación sináptica na retina con axentes farmacolóxicos, e cando se illaban fisicamente células ganglionares individuais que contiñan melanopsina das outras células da retina.[8] Estes descubrimentos mostraron que as células ganglionares que conteñen melanopsina son intrinsicamente fotosensibles,[9] e por iso foron chamadas células ganglionares da retina fotosensibles intrinsecamente (ipRGCs).[10] Constitúen unha terceira clase de células fotorreceptoras da retina dos mamíferos, xunto coas células fotorreceptoras que xa eran coñecidas, os conos e os bastóns. Estas células ganglionares son o principal conduto para a entrada de luz que controla a sincronización circadiana.[11]
Función
editarAs probas apoian as teorías previas de que a melanopsina é o fotopigmento responsable da sincronización do "reloxo corporal" central, que está formado polos núcleos supraquiasmáticos nos mamíferos. Utilizouse inmunocitoquímica fluorescente para visualizar a distribución da melanopsina na retina da rata e detectouse melanopsina en aproximadamente o 2,5% do total das células ganglionares da retina da rata, e estas células eran ipRGCs. Utilizando a β-galactosidase como marcador do xene da melanopsina, o etiquetado X-gal destas ipRGCs mostrou que os seus axóns comunican directamente cos núcleos supraquiasmáticos, o que proporciona probas adicionais de que a melanopsina é importante na sincronización a través do tracto retinohipotalámico (RHT).[12]
As células ganglionares que conteñen melanopsina mostran adaptación tanto á luz coma a escuridade, é dicir, que axustan a súa sensibilidade segundo a súa historia recente de exposición á luz.[13] Neste aspecto son similares aos conos e bastóns. Mentres que os conos e bastóns son responsables de analizar as imaxes, patróns, movementos e cores, varios estudos indican que as células ganglionares que conteñen melanopsina contribúen a varias respostas reflexas do cerebro e corpo á presenza da luz diúrna.
A liña celular paraneuronal de rato Neuro-2a, que normalmente non é fotosensible, fanse fotorreceptivas ao engadirlles a melanopsina humana. En tales condicións, a melanopsina actúa cun fotopigmento sensor, realizando unha detección da luz fisiolóxica. A fotorresposta da melanopsina é sensible selectivamente a luz de loxitudes de onda curtas (pico de absorción de ~479 nm),[14][15] mentres que tamén ten unha función de rexeneración da fotoisomerase intrínseca, que está corrida cromaticamente a lonxitudes de onda máis longas.[16]
Os fotorreceptores de melanopsina son sensibles a un determinado intervalo de lonxitudes de onda de luz.[17] Os fotorreceptores de melanopsina teñen o seu pico de absorción nas lonxitudes de onda da luz azul arredor dos 488 nanómetros. Outras lonxitudes de onda da luz por debaixo ou por riba dese valor activan o sistema de sinalización da melanopsina cunha diminución da eficiencia. Por exemplo, lonxitudes de onda máis curtas de 445 nm (preto do violeta no espectro visible) ou de 529 nm (na parte do espectro verde azulado) teñen ambas as dúas a metade da eficiencia ca a 488 nm.[18]
A dopamina é un factor que intervén na regulación dos ARNm da melanopsina nas ipRGCs. Como a síntese e liberación de dopamina na retina da rata están baixo o control dos conos e bastóns, parece que os conos e bastóns controlan a transcrición do xene da melanopsina.[19]
Mecanismo
editarCando a luz activa o sistema de sinalización da melanopsina, as células ganglionares que conteñen melanopsina descargan impulsos nerviosos, que son conducidos a través dos seus axóns ata dianas cerebrais específicas. Estas dianas inclúen o núcleo pretectal olivar (un centro nervioso responsable do control da pupila do ollo) e, a través do tracto retinohipotalámico, o núcleo supraquiasmático do hipotálamo (o marcapasos mestre dos ritmos circadianos).[12] As células ganglionares que conteñen melanopsina crese que inflúen nestas dianas ao liberaren polos seus terminais axónicos os neurotransmisores glutamato e polipéptido activador da adenilato ciclase (PACAP).[20] As células ganglionares que conteñen melanopsina tamén reciben impulsos dos bastóns e conos que modifican ou se engaden aos impulsos destas vías.
Importancia clínica
editarUnha mutación do xene que expresa a melanopsina foi implicado no risco de padecer trastorno afectivo estacional.[21]
Efectos na sincronización á luz
editarA sincronización á luz, pola cal os períodos de actividade comportamental ou inactividade (sono) están sincronizados co ciclo de luz-escuridade, que non é tan efectivo nos ratos con knockout de xenes para a melanopsina.[22] Pérdese a sincronización completamente cando se matan as células que expresan melanopsina, xa que estas células tamén cómpren para a transmisión de información luminosa bastón-cono.[23] Os ratos que carecen de bastóns e conos aínda mostran sincronización circadiana, pero tamén mostran unha resposta á luz reducida.[24] Porén, como os ratos poden distinguir entre os patróns visuais.[2] O reflexo pupilar tamén se conserva nos ratos que carecen de bastóns e conos pero teñen unha sensibilidade reducida, identificando un impulso esencial procedente dos conos e bastóns.[24] Os ratos, sen melanopsina, bastóns e conos, non poden sincronizar os ritmos circadianos e perden o reflexo pupilar.[24]
As ipRGCs son responsables da capacidade que teñen algunhas persoas cegas de sincronizarse cos ciclos de luz e escuridade de 24 horas a pesar de que perderon a formación de imaxes visual.[25] Estas persoas teñen tractos retinohipotalámicos intactos que permiten a sinalización desde as ipRGCs ao núcleo supraquiasmático.[26] Ademais, as ipRGCs teñen un papel na visión convencional; as ipRGCs permiten que os ratos sen bastóns e conos mostren respostas á luz non circadianas e codifiquen información da iluminación ambiental no córtex visual.[27]
Distribución entre as especies
editarOs xenes da melanopsina foron descritos en todas as clases de vertebrados, e nos xenomas de peixes, aves e anfibios descubriuse un ortólogo extra da melanopsina.[28] Nos mamíferos estudados ata agora (entre os que están roedores e primates, incluíndo humanos), a proteína melanopsina ten un patrón similar de distribución nos tecidos; a proteína exprésase só na retina, e só no 1–2% das células ganglionares da retina.[12] En vertebrados non mamíferos, a melanopsina encóntrase nun amplo conxunto de células da retina, e en estruturas fotosensibles fóra da retina como o músculo do iris do ollo, rexións profundas do cerebro, a glándula pineal, e a pel.[28]
Os mamíferos teñen xenes ortólogos da melanopsina chamados Opn4m, que derivan dunha rama da familia Opn4. Porén, os vertebrados non mamíferos teñen dúas versións do xene da melanopsina, chamadas Opn4m e Opn4x. Nos polos o Opn4m parece capaz de desencadear unha fervenza inducida pola luz do receptor acoplado á proteína G dependente do cofactor retinaldehido, de modo similar ao Opn4m estudado en mamíferos. O Opn4x parece ter unha resposta á luz moito máis feble.[28]
Notas
editar- ↑ Rovere, Giuseppe; Nadal-Nicolás, Francisco M.; Wang, Jiawei; Bernal-Garro, Jose M.; García-Carrillo, Nuria; Villegas-Pérez, Maria Paz; Agudo-Barriuso, Marta; Vidal-Sanz, Manuel (2016-12-01). "Melanopsin-Containing or Non-Melanopsin-Containing Retinal Ganglion Cells Response to Acute Ocular Hypertension With or Without Brain-Derived Neurotrophic Factor Neuroprotection". Investigative Ophthalmology & Visual Science 57 (15): 6652–6661. ISSN 1552-5783. PMID 27930778. doi:10.1167/iovs.16-20146.
- ↑ 2,0 2,1 Lok, Corie (20 January 2011). "Vision science: Seeing without seeing". Nature 469 (7330): 284–5. Bibcode:2011Natur.469..284L. PMID 21248815. doi:10.1038/469284a.
- ↑ Jennifer Couzin-Frankel (2010). "Why Light Makes Migraines Worse – ScienceNOW". Arquivado dende o orixinal o 14 de agosto de 2011. Consultado o 3 April 2011.
- ↑ Panda S, Nayak SK, Campo B, Walker JR, Hogenesch JB, Jegla T (January 2005). "Illumination of the melanopsin signaling pathway". Science 307 (5709): 600–4. Bibcode:2005Sci...307..600P. PMID 15681390. doi:10.1126/science.1105121.
- ↑ Provencio I, Jiang G, De Grip WJ, Hayes WP, Rollag MD (January 1998). "Melanopsin: An opsin in melanophores, brain, and eye". Proc. Natl. Acad. Sci. U.S.A. 95 (1): 340–5. Bibcode:1998PNAS...95..340P. PMC 18217. PMID 9419377. doi:10.1073/pnas.95.1.340.
- ↑ Freedman MS, Lucas RJ, Soni B, Schantz MV, Munoz M, David-Gray Z, Foster R (April 1999). "Regulation of Mammalian Circadian Behavior by Non-rod, Non-cone, Ocular Photoreceptor". Science 284 (5413): 502–4. Bibcode:1999Sci...284..502F. PMID 10205061. doi:10.1126/science.284.5413.502.
- ↑ Provencio I, Rodrigues IR, Jiang G, Hayes WP, Moreira EF, Rollag MD (January 2000). "A Novel Human Opsin in the Inner Retina". J. Neurosci. 20 (2): 600–5. PMID 10632589.
- ↑ Berson DM, Dunn FA, Takao M (February 2002). "Phototransduction by retinal ganglion cells that set the circadian clock". Science 295 (5557): 1070–3. Bibcode:2002Sci...295.1070B. PMID 11834835. doi:10.1126/science.1067262.
- ↑ Qiu X, Kumbalasiri T, Carlson SM, Wong KY, Krishna V, Provencio I, Berson DM (2005). "Induction of photosensitivity by heterologous expression of melanopsin". Nature 433 (7027): 745–9. PMID 15674243. doi:10.1038/nature03345.
- ↑ Tu DC, Zhang D, Demas J, Slutsky EB, Provencio I, Holy TE, Van Gelder RN (December 2005). "Physiologic diversity and development of intrinsically photosensitive retinal ganglion cells". Neuron 48 (6): 987–99. PMID 16364902. doi:10.1016/j.neuron.2005.09.031.
- ↑ Güler AD, Ecker JL, Lall GS, Haq S, Altimus CM, Liao HW, Barnard AR, Cahill H, Badea TC, Zhao H, Hankins MW, Berson DM, Lucas RJ, Yau KW, Hattar S (2008). "Melanopsin cells are the principal conduits for rod-cone input to non-image-forming vision". Nature 453 (7191): 102–5. PMC 2871301. PMID 18432195. doi:10.1038/nature06829.
- ↑ 12,0 12,1 12,2 Hattar S, Liao HW, Takao M, Berson DM, Yau KW (February 2002). "Melanopsin-containing retinal ganglion cells: architecture, projections, and intrinsic photosensitivity". Science 295 (5557): 1065–70. Bibcode:2002Sci...295.1065H. PMC 2885915. PMID 11834834. doi:10.1126/science.1069609.
- ↑ Wong KY, Dunn FA, Berson DM (December 2005). "Photoreceptor adaptation in intrinsically photosensitive retinal ganglion cells". Neuron 48 (6): 1001–10. PMID 16364903. doi:10.1016/j.neuron.2005.11.016.
- ↑ Bailes HJ, Lucas RJ (2013). "Human melanopsin forms a pigment maximally sensitive to blue light (max ~ 479nm)...". Proceedings of the Royal Society Biological Sciences 280 (1759): 20122987. PMC 3619500. PMID 23554393. doi:10.1098/rspb.2012.2987.
- ↑ Berson DM (2007). "Phototransduction in ganglion-cell photoreceptors". Pflugers Arch. 454 (5): 849–55. PMID 17351786. doi:10.1007/s00424-007-0242-2.
- ↑ Melyan Z, Tarttelin EE, Bellingham J, Lucas RJ, Hankins MW (February 2005). "Addition of human melanopsin renders mammalian cells photoresponsive". Nature 433 (7027): 741–5. Bibcode:2005Natur.433..741M. PMID 15674244. doi:10.1038/nature03344.
- ↑ Enezi J, Revell V, Brown T, Wynne J, Schlangen L, Lucas R. (August 2011). "A 'melanopic' spectral efficiency function predicts the sensitivity of melanopsin photoreceptors to polychromatic lights". Journal of Bological Rhythms 26 (4): 314–323. PMID 21775290. doi:10.1177/0748730411409719.
- ↑ Enezi J, Revell V, Brown T, Wynne J, Schlangen L, Lucas R. "Measuring melanopic illuminance". Lucas Group (Faculty of Life Sciences - The University of Manchester).
- ↑ Sakamoto K, Liu C, Kasamatsu M, Pozdeyev NV, Iuvone PM, Tosini G (2005). "Dopamine regulates melanopsin mRNA expression in intrinsically photosensitive retinal ganglion cells". Eur. J. Neurosci. 22 (12): 3129–36. PMID 16367779. doi:10.1111/j.1460-9568.2005.04512.x.
- ↑ Hannibal J, Fahrenkrug J (February 2004). "Target areas innervated by PACAP-immunoreactive retinal ganglion cells". Cell Tissue Res. 316 (1): 99–113. PMID 14991397. doi:10.1007/s00441-004-0858-x.
- ↑ Roecklein KA, Rohan KJ, Duncan WC, Rollag MD, Rosenthal NE, Lipsky RH, Provencio I (April 2009). "A missense variant (P10L) of the melanopsin (OPN4) gene in seasonal affective disorder". J Affect Disord 114 (1–3): 279–85. PMC 2647333. PMID 18804284. doi:10.1016/j.jad.2008.08.005.
- ↑ Panda S, Sato TK, Castrucci AM, Rollag MD, DeGrip WJ, Hogenesch JB, Provencio I, Kay SA (December 2002). "Melanopsin (Opn4) requirement for normal light-induced circadian phase shifting". Science 298 (5601): 2213–6. PMID 12481141. doi:10.1126/science.1076848.
- ↑ Güler AD, Ecker JL, Lall GS, Haq S, Altimus CM, Liao H, Barnard AR, Cahill H, Badea TC, Zhao H, Hankins MW, Berson DM, Lucas RJ, Yau K, Hattar S (2008). "Melanopsin cells are the principal conduits for rod–cone input to non-image-forming vision". Nature 453 (7191): 102–5. Bibcode:2008Natur.453..102G. PMC 2871301. PMID 18432195. doi:10.1038/nature06829.
- ↑ 24,0 24,1 24,2 Panda S, Provencio I, Tu DC, Pires SS, Rollag MD, Castrucci AM, Pletcher MT, Sato TK, Wiltshire T, Andahazy M, Kay SA, Van Gelder RN, Hogenesch JB (25 July 2003). "Melanopsin is required for non-image-forming photic responses in blind mice". Science 301 (5632): 525–7. Bibcode:2003Sci...301..525P. PMID 12829787. doi:10.1126/science.1086179.
- ↑ Czeisler CA, Shanahan TL, Klerman EB, Martens H, Brotman DJ, Emens JS, Klein T, Rizzo JF (January 1995). "Suppression of melatonin secretion in some blind patients by exposure to bright light". N. Engl. J. Med. 332 (1): 6–11. PMID 7990870. doi:10.1056/NEJM199501053320102.
- ↑ Arendt, Josephine (1 February 2006). "Chapter 15. The Pineal Gland and Pineal Tumours". Neuroendocrinology, Hypothalamus, and Pituitary,. Endotext.com. pp. an E–book edited by Ashley Grossman (chapter section: Melatonin Synthesis and Metabolism). Arquivado dende o orixinal o 09 de febreiro de 2008. Consultado o 7 February 2008.
Image forming vision (rods and cones) is not required ... for synchronising /phase shifting the circadian clock.
- ↑ Brown TM, Gias C, Hatori M, Keding SR, Semo M, Coffey PJ, Gigg J, Piggins HD, Panda S, Lucas RJ (2010). "Melanopsin contributions to irradiance coding in the thalamo-cortical visual system". PLoS Biol. 8 (12): e1000558. PMC 2998442. PMID 21151887. doi:10.1371/journal.pbio.1000558.
- ↑ 28,0 28,1 28,2 Bellingham J, Chaurasia SS, Melyan Z, Liu C, Cameron MA, Tarttelin EE, Iuvone PM, Hankins MW, Tosini G, Lucas RJ (July 2006). "Evolution of melanopsin photoreceptors: discovery and characterization of a new melanopsin in nonmammalian vertebrates". PLoS Biol. 4 (8): e254. PMC 1514791. PMID 16856781. doi:10.1371/journal.pbio.0040254.