Inmunocitoquímica
A inmunocitoquímica (abreviada ICQ, e en inglés ICC) é unha técnica de laboratorio común que se usa para visualizar anatomicamente a localización dunha proteína específica ou molécula de antíxeno nas células por medio do uso dun anticorpo primario específico que se une a ela. O anticorpo primario permite a visualización da proteína baixo un microscopio de fluorescencia cando este está unido a un anticorpo secundario que ten un fluoróforo conxugado. A inmunocitoquímica permite avaliar se unha célula dunha determinada mostra expresa ou non o antíxeno[1] en cuestión. Nos casos nos que se atopa un sinal inmunopositivo, a inmunocitoquímica permite determinar en que compartimentos subcelulares se está expresando o antíxeno.
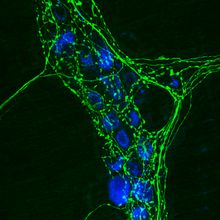
Inmunocitoquímica fronte a inmunohistoquímica
editarA inmunocitoquímica diferénciase da inmunohistoquímica[2] en que a primeira realízase en mostras de células intactas nas cales non hai unha estrutura de tecido. Isto inclúe células individuais que foron illadas dun bloque de tecido sólido, células que crecen en capa nun cultivo, células depositadas dunha suspensión, ou células tomadas dun frotis. A diferenza disto, as mostras inmunohistoquímicas son cortes de tecidos biolóxicos, nas que todas as células están rodeadas pola arquitectura do tecido e polas outras células que normalmente se encontran no tecido intacto. Na inmunohistoquímica a mostra de tecido foi conxelado ou incrustado en parafina e fixado. A inmunocitoquímica é unha técnica usada para avaliar a presenza dunha proteína ou antíxeno específicos en células (células cultivadas, suspensións de células) utilizando un anticorpo específico, o cal se une a eles, permitindo así a visualización e exame con microscopio. É unha técnica valiosa para a determinación do contido celular de células individuais. As mostras que poden analizarse inclúen frotis sanguíneos e doutros tipos, aspirados, células cultivadas e suspensións de células.[3]
Hai moitas maneiras de preparar mostras de células para as análises inmunocitoquímicas. Cada método ten as súas propias vantaxes e características únicas, así que o método máis axeitado debe elixirse para cada mostra e resultado que se pretende.
As células que teñen que ser marcadas poden estar unidas a un soporte sólido para que se poidan manipular doadamente nos procedementos seguintes. Isto pode conseguirse por varios métodos: as células adherentes poden cultivarse sobre portaobxectos de microscopia, cubreobxectos ou un soporte plástico adecuado opticamente. As células en suspensión poden ser centrifugadas en portaobxectos de cristal (con citocentrífuga), unidas a un soporte sólido usando ligadores químicos, ou nalgúns casos manipuladas en suspensión.
As suspensións celulares concentradas que existen nun medio de baixa viscosidade son boas candidatas para realizar preparacións de frotis. As suspensións de células diluídas que existían nun medio diluído son máis axeitadas para a preparación por citocentrifugación. As suspensións celulares que existen nun medio de alta viscosidade, son máis apropiadas para ser testadas como preparacións a partir de bastonciños de mostras. A característica común nestes tipos de preparacións é que está presente a célula completa na superficie do portaobxectos. Para que teña lugar calquera reacción intercelular, a inmunoglobulina debe primeiro atravesar a membrana plasmática celular que está intacta nestas preparacións. As reaccións que teñen lugar no núcleo poden ser máis difíciles, e os fluídos extracelulares poden crear obstáculos únicos na realización da inmunocitoquímica. Nesta situación, cómpre permebilizar as células usando deterxentes (Triton X-100 ou Tween-20) ou escoller fixadores orgánicos (acetona, metanol ou etanol).
Os anticorpos son unha importante ferramenta para demostrar a presenza e a localización subcelular dun antíxeno. A marcaxe é unha técnica versátil, e se o antíxeno está moi localizado, pode detectar incluso só uns poucos miles de moléculas de antíxeno nunha célula. Nalgunhas circunstancias, a marcaxe celular pode usarse para determinar a concentración aproximada dun antíxeno, especialmente por un analizador de imaxes.
Métodos
editar- Véxase tamén: Inmunohistoquímica.
Hai moitos métodos para conseguir a detección inmunolóxica en tecidos, como as que utilizan de forma directa anticorpos primarios ou antisoros. Un método directo implica o uso dunha etiqueta química detectable (por exemplo, unha molécula fluorescente, partículas de ouro, etc.) directamente no anticorpo,[4] o cal despois se unirá ao antíxeno (por exemplo, unha proteína) na célula.
Alternativamente, hai moito métodos indirectos. Nun deses métodos, o antíxeno únese a un anticorpo primario que é despois amplificado polo uso dun anticorpo secundario que se une ao anticorpo primario. Despois, aplícase un reactivo terciario que contén un encima para que se una ao anticorpo secundario. Cando se aplica o reactivo cuaternario (o substrato), o extremo encimático do reactivo terciario converte o substrato nun produto de reacción pigmentado, que produce unha cor detectable (son posibles moitas cores; marrón, negra, vermella, etc.) na mesma localización na que o anticorpo primario orixinal recoñeceu o antíxeno de interese.
Algúns exemplos de substratos utilizados (tamén chamados cromóxenos) son AEC (3-amino-9-etilcarbazol) ou DAB (3,3'-diaminobencidina). O uso dun destes reactivos despois da exposición ao encima necesario (por exemplo, a peroxidase do ravo picante conxugada a un reactivo anticorpo) produce unha inmunorreacción positiva. A visualización inmunocitoquímica de antíxenos específicos de interese pode utilizarse cando non se pode usar un marcador ou tinguidura menos específico como a hematoxilina-eosina para facer a diagnose ou proporcionar información preditiva adicional sobre o tratamento dalgunha doenza (nalgúns cancros, por exemplo).
Alternativamente, o anticorpo secundario pode ligarse covalentemente a un fluoróforo (FITC e rodamina son os máis comúns), que é detectado nun microscopio confocal ou de fluorescencia. A localización da fluorescencia variará segundo a molécula diana, e será externa para proteínas de membrana e interna para proteínas citoplasmáticas. Deste modo, a inmunofluorescencia é unha poderosa técnica cando se combina coa microscopia confocal para estudar a localización de proteínas e procesos dinámicos (exocitose, endocitose, etc.).
Notas
editar- ↑ W. Burry, Richard (2010). Immunocytochemistry. Springer, Nova York, NY. pp. 7–16. ISBN 978-1-4419-1304-3.
- ↑ Renshaw, Simon (2017). Immunohistochemistry and Immunocytochemistry: Essential Methods, Second Edition. John Wiley & Sons, Ltd. pp. 35–102.
- ↑ Novus Biologicals ICC vs IHC vs IF – Do You Know The Difference?
- ↑ Cooper, Mark; Lummas, Sheriden (2016). Immunohistochemistry and Immunocytochemistry: Essential Methods, Second Edition. John Wiley & Sons, Ltd. pp. 21–23.