Adenosín monofosfato cíclico
O adenosín monofosfato cíclico, AMP cíclico ou AMPc (cAMP en inglés) é un nucleótido que funciona como segundo mensaxeiro en varios procesos biolóxicos. É un derivado do ATP, xa que se orixina a partir deste por acción do encima adenilato ciclase. No AMPc o seu fosfato non establece só un enlace fosfodiéster co OH en posición 5' da ribosa, senón tamén outro co OH en posición 3', creando un ciclo na molécula entre o fosfato e a ribosa, polo que o AMPc tamén se chama adenosín monofosfato-3',5' cíclico.
| Adenosín monofosfato cíclico | |
|---|---|
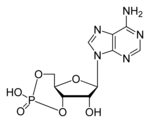
|

|
| Identificadores | |
| Número CAS | 60-92-4 |
| PubChem | 6076 |
| ChemSpider | 5851 |
| UNII | E0399OZS9N |
| DrugBank | DB02527 |
| KEGG | C00575 |
| MeSH | Cyclic+AMP |
| ChEBI | CHEBI:17489 |
| ChEMBL | CHEMBL316966 |
| Ligando IUPHAR | 2352 |
| Imaxes 3D Jmol | Image 1 |
| |
| |
| Propiedades | |
| Fórmula molecular | C10H12N5O6P |
| Masa molecular | 329,206 |
Se non se indica outra cousa, os datos están tomados en condicións estándar de 25 °C e 100 kPa. | |
Síntese e descomposición
editarO AMPc sintízase a partir do ATP polo encima adenilato ciclase, localizado na membrana celular. Este encima actívase principalmente polas proteínas G, con actividade estimulatoria (Gs) ou inhibitoria (Gi), que están reguladas por proteínas receptoras de membrana unidas a elas. A adenilato ciclase hepática responde con maior forza ao glicagón, entanto que a muscular responde con maior forza á adrenalina.
A descomposición do AMPc a 5´-AMP está catalizada polo encima fosfodiesterase.
Funcións
editarO AMPc é un segundo mensaxeiro, empregado nas rutas de transdución de sinais nas células como resposta a un estímulo externo ou interno, como pode ser unha hormona como o glicagón ou a adrenalina, que non penetra na célula e se une a un receptor de membrana. Adoita estar relacionado coa activación de diversas proteína quinases. Regula o paso de Ca2+ polas canles iónicas da membrana. En bacterias, é un regulador catabólico que controla a expresión de xenes regulados por un operón relacionados coa degradación de azucres en función da concentración de glicosa.
En humanos
editarO AMPc e as súas quinases asociadas funcionan en varios procesos bioquímicos, como a regulación do metabolismo do glicóxeno, azucres e lípidos.
Nos humanos, o AMPc funciona activando a proteína quinase A ou PKA, tamén coñecida como proteína quinase dependiente do AMPc. No seu estado de holoencima tetramérica normalmente é inactiva, e consta de dúas unidades catalizadoras e dúas reguladoras (C2R2) coas unidades reguladoras bloqueando os centros catalizadores das unidades catalizadoras. O AMPc únese a sitios específicos nas unidades reguladoras da proteína quinase, o que causa a disociación das subunidades reguladoras e catalizadoras, e isto activa as unidades catalizadoras e permítelles que fosforilen as proteínas que son os seus substratos.
As subunidades activas catalizan a transferencia do fosfato desde o ATP a residuos específicos de serina das proteínas que son os seus substratos. As proteínas unha vez fosforiladas poden actuar directamente nas canles iónicas das células, ou poden converterse en encimas que foron activados ou inhibidos. A proteína quinase A pode tamén fosforilar proteínas específicas que despois se unen ás rexións promotoras do ADN, causando o aumento da expresión de determinados xenes.
Non todas as proteínas quinases responden ao AMPc: moitos tipos de proteína quinase non son dependentes do AMPc, por exemplo a proteína quinase C.
Moitos efectos biolóxicos dependen das proteínas quinases dependentes do AMPc, as cales varían segundo o tipo de célula.
Ademais o AMPc pode activar as canles de Ca, e para iso non necesita a proteína quinase A, o que, por exemplo, é unha vía secundaria para que a hormona liberadora da hormona do crecemento cause a liberación da hormona do crecemento.
Outras proteínas distintas das proteína quinases A, que son activadas polo AMPc son as Epac (proteínas de intercambio activadas por AMPc). As Epac conteñen un dominio GEF (factor de intercambio de guanina), que se activa cando se une o AMPc á outra zona da Epac, o que permite que a Epac poida activar a outras proteínas.
En bacterias
editarNas bacterias o nivel de AMPc varía dependendo do medio usado para o seu crecemento. En concreto, o nivel de AMPc está baixo cando a fonte de carbono é a glicosa. Isto sucede debido á inhibición do encima que produce o AMPc, a adenil ciclase, como un efecto colateral do transporte de glicosa ao interior da célula. O factor de transcrición CRP proteína receptora de AMPc, tamén chamado CAP (proteína activadora de xenes por catabolito), forma un complexo co AMPc e dese modo dito factor queda activado para unirse ao ADN. O CRP-AMPc fai incrementar a expresión dun gran número de xenes, incluíndo os dalgúns encimas, que poden intervir na subministración de enerxía a partir de fontes distintas da glicosa.
Un exemplo deste mecanismo é a activación ("control positivo") polo AMPc do operón lac. Cando hai pouca glicosa na célula, o AMPc acumúlase e únese ao sitio alostérico do CRP, que é unha proteína activadora da transcrición. A proteína entón adopta a súa conformación activa e únese a un sitio específico situado antes do promotor do operón lac, facilitando que a ARN polimerase se una ao promotor e empece a transcrición dos xenes do operón lac. Deste modo a bacteria pode usar a lactosa para a produción de enerxía, xa que os xenes do operón facilitarán o uso dese azucre. Pero se hai suficiente glicosa, a concentración de AMPc descende, o CRP disóciase do operón lac, e dito operón deixa de transcribirse.
En mofos mucosos
editarEn especies fúnxicas de mofos mucosos como ''Dyctiostelium discoideum'' os movementos quimiotácticos das súas células están determinados por ondas de AMPc periódicas que se propagan pola célula.
Patoloxía
editarPapel do AMPc nos carcinomas humanos
editarAlgunhas investigacións suxiren que unha desregulación das vías de AMPc e unha activación masiva de AMPc controlada polos xenes está relacionada co crecemento dalgúns tipos de cáncer.[1][2][3]
Papel do AMPc en desordes do córtex prefrontal
editarAlgunhas investigacións recentes suxiren que o AMPc afecta ás funcións superiores do pensamento no córtex prefrontal por medio da regulación da apertura de canles iónicas.[4]
Véxase tamén
editarNotas
editar- ↑ American Association for Cancer Research (cAMP-responsive Genes and Tumor Progression)
- ↑ American Association for Cancer Research (cAMP Dysregulation and Melonoma)
- ↑ American Association for Cancer Research (cAMP-binding Proteins' Presence in Tumors)
- ↑ ScienceDaily ::Brain Networks Strengthened By Closing Ion Channels, Research Could Lead To ADHD Treatment