ARNr 16S
O ARNr 16S, é dicir, ácido ribonucleico ribosómico 16S (en inglés 16S rRNA) é o compoñente da subunidade menor de 30S (S son as unidades svedberg) do ribosoma procariota, o cal se une á secuencia Shine-Dalgarno. Os xenes que o codifican denomínanse xene do ARNr 16S e utilízanse para reconstruír filoxenias, debido ás lentas taxas de evolución desta rexión xénica.[2] Carl Woese e George E. Fox foron os dous investigadores pioneiros no uso do ARNr 16S en filoxenética en 1977.[3]
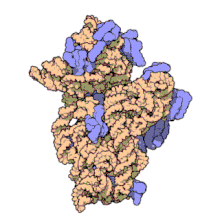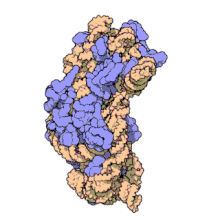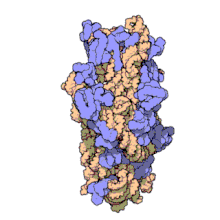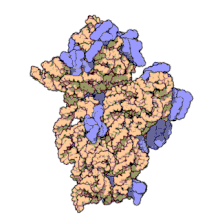
Nunha soa bacteria poden existir múltiples secuencias do xene de ARNr 16S.[4]
Funcións
editarTen varias funcións:
- Igual que o ARNr 23S, ten un papel estrutural, actuando como armazón, definindo as posicións das proteínas ribosómicas.
- O extremo 3' contén a anti-secuencia Shine-Dalgarno, que se une augas arriba ao codón de inicio AUG do ARNm. O extremo 3' do ARNr 16S únese ás proteínas S1 e S21, que están implicadas na iniciación da síntese de proteínas.
- Interacciona con ARNr 23S, axudando na unión das dúas subunidades ribosómicas (50S+30S)
- Estabiliza os emparellamentos correctos codón-anticodón no sitio A do ribosoma por medio da formación dun enlace de hidróxeno entre o átomo N1 dos residuos de adenina 1492 e 1493 e o grupo 2'OH do esqueleto do ARNm.
Estrutura
editarA súa estrutura pode dividirse en catro dominios, tal como se mostra na imaxe.
Cebadores universais
editarO xene do ARNr 16S utilízase para estudos filoxenéticos[5] xa que está altamente conservado entre diferentes especies de bacterias e arqueas.[6] Carl Woese foi o pioneiro neste uso do ARNr 16S.[2] Suxeriuse que o xene do ARNr 16S pode utilizarse como un reloxo molecular fiable porque as súas secuencias en distintas liñaxes bacterianas relacionadas distantemente teñen funcionalidades similares.[7] Algunhas arqueas (hiper)termófilas (por exemplo, as da orde Thermoproteales) conteñen intróns no xene do ARNr 16S que están localizados en rexións altamente conservadas e poden causar un impacto no annealing de cebadores "universais".[8] Os ARNr mitocondriais e cloroplásticos están tamén amplificados.
O par cebador ou primer máis común foi concibido por Weisburg et al.[5] e denomínase actualmente 27F e 1492R; porén, para algunhas aplicacións poden ser necesarios amplicóns máis curtos, como por exemplo o par cebador 27F-534R que cobre de V1 a V3 para a secuenciación 454 con química do titanio (as lecturas de 500 son ideais).[9] A miúdo utilízase o 8F en vez do 27F. Ambos os cebadores son case idénticos, pero o 27F ten un M en vez dun C. AGAGTTTGATCMTGGCTCAG comparado co 8F.[10]
| Nome do cebador | Secuencia (5'-3') | Referencia |
|---|---|---|
| 8F | AGA GTT TGA TCC TGG CTC AG | [11][12] |
| U1492R | GGT TAC CTT GTT ACG ACT T | [11][12] |
| 928F | TAA AAC TYA AAK GAA TTG ACG GG | [13] |
| 336R | ACT GCT GCS YCC CGT AGG AGT CT | [13] |
| 1100F | YAA CGA GCG CAA CCC | |
| 1100R | GGG TTG CGC TCG TTG | |
| 337F | GAC TCC TAC GGG AGG CWG CAG | |
| 907R | CCG TCA ATT CCT TTR AGT TT | |
| 785F | GGA TTA GAT ACC CTG GTA | |
| 805R | GAC TAC CAG GGT ATC TAA TC | |
| 533F | GTG CCA GCM GCC GCG GTA A | |
| 518R | GTA TTA CCG CGG CTG CTG G | |
| 27F | AGA GTT TGG ATC M TGG CTC AG | [14] |
| 1492R | CGG TTA CCT TGT TAC GAC TT | [14] |
Aplicacións en PCR e secuenciación
editarAdemais de sitios de unión de cebadores altamente conservados, as secuencias do xene do ARNr 16S conteñen rexións hipervariables que poden proporcionar secuencias sinatura específicas de especies útiles para a identiicación de bacterias.[15][16] Como resultado, a secuenciación do xene do ARNr 16S converteuse en algo común en microbioloxía médica como unha alternativa barata e rápida aos métodos fenotípicos de identificación bacteriana.[17] Aínda que a secuenciación do 16S se usou orixinalmente para identificar bacterias, viuse despois que servía para facer unha reclasificación das bacterias en especies completamente novas,[18] ou mesmo en xéneros.[5][19] Foron tamén usadas para describir novas especies que nunca se puideran cultivar con éxito.[20][21] Coa chegada a moitos laboratorios de técnicas de secuenciación de terceira xeración, é posible a identificación simultánea de miles de secuencias de ARNr 16S en cuestión de horas, o que permite facer estudos metaxenómicos, como por exemplo da flora intestinal.[22]
Rexións hipervariables
editarO xene do ARNr 16S bacteriano contén nove rexións hipervariables (V1-V9) que oscilan entre unha lonxitude de 30 a 100 pares de bases e que están implicadas na estutura secundaria da subunidade ribosómica menor.[23] O grao de conservación varía amplamente entre as rexións hipervaribles, e as rexións máis conservadas correlaciónanse coa taxonomía de maior nivel (grandes grupos) e as rexións menos conservadas coa de menor nivel, como xéneros e especies.[24] Aínda que as secuencias 16S completas permiten unha comparación de todas as rexións hipervariables, cando estas son de 1500 pares de bases de longo a súa análise pode ser prohibitivamente cara para estudos que tratan de identificar ou caracterizar diversas comunidades bacterianas.[24] Estes estudos utilizan habitualmente a plataforma Illumina, que produce lecturas de 50 a 12000 veces máis baratas que a pirosecuenciación 454 ou a secuenciación de Sanger, respectivamente.[25] Aínda que é máis barata e axeitada para cubrir máis profundmente unha comunidade,a secuenciación de Illumina só produce lecturas de 75 a 250 pares de bases de longo (ata 300 pares de bases con Illumina MiSeq), e non ten un protocolo establecido para a ensamblaxe fiable do xene completo en mostras da comunidade bacteriana.[26] Porén, as rexións completamente hipervariables poden ser ensambladas a partir dunha soa execución de Illumina, o que as fai dianas ideais para a plataforma.[26]
Aínda que as rexións hipervariables do 16S poden variar drasticamente entre bacterias, o xene do 16S en conxunto mantén unha maior homoxeneidade na lonxitude que o seu equivalente eucariota de 18S, o cal pode facer que os aliñamentos sexan máis doados.[27] Ademais, o xene do 16S contén secuencias altamente conservadas entre rexións hipervariables, o que permite o deseño de cebadores universais que poden producir fiablemente as mesmas seccións da secuencia do 16S en diferentes taxons.[28] Aínda que ningunha rexión hipedrvariable pode clasificar con exctitude todas as bacterias desde a categoría de dominio á de especie, algunhas poden predicir con fiabilidade niveis taxonómicos específicos.[24] Por esta razón, moitos estudos de comunidade seleccionan as rexións hipervariables semiconservadas como a V4, xa que pode proporcionar unha resolución a nivel de filo de maneira tan precisa coma o xene 16S completo.[24] Aínda que as rexións menos conservadas teñen dificultade para clasificar novas especies cando o nivel taxonómico superior se descoñece, utilízanse a miúdo para detectar a presenza de patóxenos específicos. Nun estudo feito por Chakravorty et al. en 2007, caracterizáronse as rexións V1-V8 de varios patóxenos para determinar que rexións hipervariables sería máis útil incluír para probas específicas de especie ou de espectro máis amplo.[29] Entre outros descubrimentos, estes investigadores atoparon que a rexión V3 era mellor para identificar o xénero de todos os patóxenos probados e que a V6 era a máis axeitada para diferenciar especies entre todos os patóxenos probados das listas da CDC estadounidense, incluíndo o ántrax.[29]
Aínda que a análise de rexións hipervariables 16S é unha poderosa ferramenta para os estudos de taxonomía bacteriana, ten dificultades á hora de diferenciar entre especies moi estreitmente emparentadas.[28] Nas familias Enterobacteriaceae, Clostridiaceae e Peptostreptococcaceae, as especies poden compartir ata o 99% en similitude de secuencia no xene 16S completo.[30] Como resultado, as secuencias V4 poden diferir en só uns poucos nucleótidos, o que fai que as bases de datos de referencia non poidan clasificar con fiabilidade estas bacterias nos niveis taxonómicos inferiores.[30] Limitando a análise do 16S a rexións hipervariables seleccionadas, estes estudos poden fracasar ao non observr diferenzas en taxóns estreitamente relacionados e agrupalos nunha soa unidade taxonómica, subestimando a diversidade total da mostra.[28] Ademais, os xenomas bacterianos poden conter múltiples xenes de ARNr 16S, e as rexións V1, V2 e V6 son as que conteñen a maior diversidade intraespecífica.[6] Aínda que non é o método máis preciso para clasificar as especies bacterianas, a análise de rexións hipervariables segue sendo unha das ferramentas máis útiles de que se dispón para estudos de comunidades bacterianas.[30]
Bases de datos de ARNr 16S
editarO xene do ARNr 16S utilízase como un estándar na clasificación e identificación de microbios, porque está presente na maioría dos microbios e presenta os cambios adecuados. Disponse de cepas tipo de secuencias do xene do ARNr 16S da maioría das bacterias e arqueas en bases de datos públicas como as do NCBI. Porén, con frecuencia a calidade das secuencias que se encontran nesas bases de datos non está validada. Por tanto, utilízanse moito bases de datos secundarias que recollen só secuencias de ARNr 16S. As bases de datos máis usadas son as seguintes:
EzBioCloud
editarA base de datos EzBioCloud, antes chamada EzTaxon, consta dun sistema taxonómico xerárquico que contén 62988 especies/filotipos de bacterias e arqueas, que inclúe 15290 nomes publicados validamente ata setembro de 2018. Baseándose nas relacións filoxenéticas como as de máxima probabilidade e OrthoANI, todas as especies/subespecies están representadas por polo menos unha secuencia do xene de ARNr 16S. A base de datos EzBioCloud está revisada sistematicamente e posta ao día regularmente, o que tamén inclúe novas especies candidatas. Ademais, a páxina web ofrece ferramentas bioinformáticas como unha calculadora ANI, ContEst16S e 16S rRNA DB para as pipeline Mothur e QIIME.[31]
The Ribosomal Database Project
editarThe Ribosomal Database Project (RDP) Arquivado 19 de agosto de 2020 en Wayback Machine. é unha base de datos revisados que ofrece datos de ribosomas xunto con programas relacionados e servizos. As ofertas inclúen aliñamentos ordenados filoxeneticamente de secuencias de ARNr, árbores filoxenéticas derivadas, diagramas da estrutura secundaria do ARNr e varios paquetes de software para manexar, analizar e mostrar os aliñamentos e árbores. Os datos están dispoñibles por ftp e correo electrónico. Tamén se proporcionan certos servizos analíticos por servidor de correo electrónco.[32]
SILVA
editarSILVA proporciona conxuntos de datos completos de calidade comprobada e postos ao día regularmente de secuencias aliñadas de ARNr das subunidades ribosómicas menor (16S/18S, SSU) e maior (23S/28S, LSU) dos tres dominios da vida, así como unha suite de ferramentas de investigación, deseño de cebadores e aliñamento para Bacteria, Archaea e Eukarya.[33]
GreenGenes
editarGreengenes é unha base de datos de referencia de 16S completa e de calidade controlada, baseada na taxonomía dunha filoxenia de novo, que proporciona conxuntos de unidades taxonómicas operacionais estándar. A páxina oficial deste sitio é http://greengenes.secondgenome.com, e ten licenza Creative Commons BY-SA 3.0.[34][35]
Notas
editar- ↑ Schluenzen F, Tocilj A, Zarivach R, Harms J, Gluehmann M, Janell D, Bashan A, Bartels H, Agmon I, Franceschi F, Yonath A (September 2000). "Structure of functionally activated small ribosomal subunit at 3.3 angstroms resolution". Cell 102 (5): 615–23. PMID 11007480. doi:10.1016/S0092-8674(00)00084-2.
- ↑ 2,0 2,1 Woese CR, Fox GE (November 1977). "Phylogenetic structure of the prokaryotic domain: the primary kingdoms". Proceedings of the National Academy of Sciences of the United States of America 74 (11): 5088–90. Bibcode:1977PNAS...74.5088W. PMC 432104. PMID 270744. doi:10.1073/pnas.74.11.5088.
- ↑ Woese CR, Kandler O, Wheelis ML (June 1990). "Towards a natural system of organisms: proposal for the domains Archaea, Bacteria, and Eucarya". Proceedings of the National Academy of Sciences of the United States of America 87 (12): 4576–9. Bibcode:1990PNAS...87.4576W. PMC 54159. PMID 2112744. doi:10.1073/pnas.87.12.4576.
- ↑ Case RJ, Boucher Y, Dahllöf I, Holmström C, Doolittle WF, Kjelleberg S (January 2007). "Use of 16S rRNA and rpoB genes as molecular markers for microbial ecology studies". Applied and Environmental Microbiology 73 (1): 278–88. PMC 1797146. PMID 17071787. doi:10.1128/AEM.01177-06.
- ↑ 5,0 5,1 5,2 Weisburg WG, Barns SM, Pelletier DA, Lane DJ (January 1991). "16S ribosomal DNA amplification for phylogenetic study". Journal of Bacteriology 173 (2): 697–703. PMC 207061. PMID 1987160. doi:10.1128/jb.173.2.697-703.1991.
- ↑ 6,0 6,1 Coenye T, Vandamme P (November 2003). "Intragenomic heterogeneity between multiple 16S ribosomal RNA operons in sequenced bacterial genomes". FEMS Microbiology Letters 228 (1): 45–9. PMID 14612235. doi:10.1016/S0378-1097(03)00717-1.
- ↑ Tsukuda, Miyuki; Kitahara, Kei; Miyazaki, Kentaro (2017-08-30). "Comparative RNA function analysis reveals high functional similarity between distantly related bacterial 16 S rRNAs". Scientific Reports (en inglés) 7 (1): 9993. Bibcode:2017NatSR...7.9993T. ISSN 2045-2322. PMC 5577257. PMID 28855596. doi:10.1038/s41598-017-10214-3. Arquivado dende o orixinal o 15 de maio de 2018. Consultado o 14 de xullo de 2019.
- ↑ Jay ZJ, Inskeep WP (July 2015). "The distribution, diversity, and importance of 16S rRNA gene introns in the order Thermoproteales". Biology Direct 10 (35): 35. PMC 4496867. PMID 26156036. doi:10.1186/s13062-015-0065-6.
- ↑ "Copia arquivada". Arquivado dende o orixinal o 30 de outubro de 2010. Consultado o 14 de xullo de 2019.
- ↑ "Primers, 16S ribosomal DNA - François Lutzoni's Lab". lutzonilab.net. Arquivado dende o orixinal o 27 de decembro de 2012. Consultado o 14 de xullo de 2019.
- ↑ 11,0 11,1 Eden PA, Schmidt TM, Blakemore RP, Pace NR (April 1991). "Phylogenetic analysis of Aquaspirillum magnetotacticum using polymerase chain reaction-amplified 16S rRNA-specific DNA". International Journal of Systematic Bacteriology 41 (2): 324–5. PMID 1854644. doi:10.1099/00207713-41-2-324.
- ↑ 12,0 12,1 James, Greg (15 May 2018). "Universal Bacterial Identification by PCR and DNA Sequencing of 16S rRNA Gene". PCR for Clinical Microbiology. Springer, Dordrecht. pp. 209–214. ISBN 978-90-481-9038-6. doi:10.1007/978-90-481-9039-3_28.
- ↑ 13,0 13,1 Weidner S, Arnold W, Pühler A (1996). "Diversity of uncultured microorganisms associated with the seagrass Halophila stipulacea estimated by restriction fragment length polymorphism analysis of PCR-amplified 16S rRNA genes" (PDF). Appl Environ Microbiol 62 (3): 766–71. PMC 167844. PMID 8975607. Arquivado dende o orixinal (PDF) o 16 de maio de 2011. Consultado o 14 de xullo de 2019.
- ↑ 14,0 14,1 Jiang H, Dong H, Zhang G, Yu B, Chapman LR, Fields MW (June 2006). "Microbial diversity in water and sediment of Lake Chaka, an athalassohaline lake in northwestern China". Applied and Environmental Microbiology 72 (6): 3832–45. PMC 1489620. PMID 16751487. doi:10.1128/AEM.02869-05.
- ↑ Pereira F, Carneiro J, Matthiesen R, van Asch B, Pinto N, Gusmão L, Amorim A (December 2010). "Identification of species by multiplex analysis of variable-length sequences". Nucleic Acids Research 38 (22): e203. PMC 3001097. PMID 20923781. doi:10.1093/nar/gkq865.
- ↑ Kolbert CP, Persing DH (June 1999). "Ribosomal DNA sequencing as a tool for identification of bacterial pathogens". Current Opinion in Microbiology 2 (3): 299–305. PMID 10383862. doi:10.1016/S1369-5274(99)80052-6.
- ↑ Clarridge JE (October 2004). "Impact of 16S rRNA gene sequence analysis for identification of bacteria on clinical microbiology and infectious diseases". Clinical Microbiology Reviews 17 (4): 840–62, table of contents. PMC 523561. PMID 15489351. doi:10.1128/CMR.17.4.840-862.2004.
- ↑ Lu T, Stroot PG, Oerther DB (July 2009). "Reverse transcription of 16S rRNA to monitor ribosome-synthesizing bacterial populations in the environment". Applied and Environmental Microbiology 75 (13): 4589–98. PMC 2704851. PMID 19395563. doi:10.1128/AEM.02970-08.
- ↑ Brett PJ, DeShazer D, Woods DE (January 1998). "Burkholderia thailandensis sp. nov., a Burkholderia pseudomallei-like species". International Journal of Systematic Bacteriology. 48 Pt 1 (1): 317–20. PMID 9542103. doi:10.1099/00207713-48-1-317.
- ↑ Schmidt TM, Relman DA (1994). Phylogenetic identification of uncultured pathogens using ribosomal RNA sequences. Methods in Enzymology 235. pp. 205–22. ISBN 978-0-12-182136-4. PMID 7520119. doi:10.1016/0076-6879(94)35142-2.
- ↑ Gray JP, Herwig RP (November 1996). "Phylogenetic analysis of the bacterial communities in marine sediments". Applied and Environmental Microbiology 62 (11): 4049–59. PMC 168226. PMID 8899989.
- ↑ Sanschagrin S, Yergeau E (2014). "Next-generation sequencing of 16S ribosomal RNA gene amplicons". J Vis Exp (90). PMC 4828026. PMID 25226019. doi:10.3791/51709.
- ↑ Gray MW, Sankoff D, Cedergren RJ (1984). "On the evolutionary descent of organisms and organelles: a global phylogeny based on a highly conserved structural core in small subunit ribosomal RNA". Nucleic Acids Research 12 (14): 5837–52. PMC 320035. PMID 6462918. doi:10.1093/nar/12.14.5837.
- ↑ 24,0 24,1 24,2 24,3 Yang B, Wang Y, Qian PY (March 2016). "Sensitivity and correlation of hypervariable regions in 16S rRNA genes in phylogenetic analysis". BMC Bioinformatics 17 (1): 135. PMC 4802574. PMID 27000765. doi:10.1186/s12859-016-0992-y.
- ↑ Bartram AK, Lynch MD, Stearns JC, Moreno-Hagelsieb G, Neufeld JD (June 2011). "Generation of multimillion-sequence 16S rRNA gene libraries from complex microbial communities by assembling paired-end illumina reads". Applied and Environmental Microbiology 77 (11): 3846–52. PMC 3127616. PMID 21460107. doi:10.1128/AEM.02772-10.
- ↑ 26,0 26,1 Burke CM, Darling AE (2016-09-20). "A method for high precision sequencing of near full-length 16S rRNA genes on an Illumina MiSeq". PeerJ 4: e2492. PMC 5036073. PMID 27688981. doi:10.7717/peerj.2492.
- ↑ Van de Peer Y, Chapelle S, De Wachter R (1996). "A quantitative map of nucleotide substitution rates in bacterial rRNA". Nucleic Acids Research 24 (17): 3381–91. PMC 146102. PMID 8811093. doi:10.1093/nar/24.17.3381.
- ↑ 28,0 28,1 28,2 Větrovský T, Baldrian P (2013-02-27). "The variability of the 16S rRNA gene in bacterial genomes and its consequences for bacterial community analyses". PLoS One 8 (2): e57923. Bibcode:2013PLoSO...857923V. PMC 3583900. PMID 23460914. doi:10.1371/journal.pone.0057923.
- ↑ 29,0 29,1 Chakravorty S, Helb D, Burday M, Connell N, Alland D (May 2007). "A detailed analysis of 16S ribosomal RNA gene segments for the diagnosis of pathogenic bacteria". Journal of Microbiological Methods 69 (2): 330–9. PMC 2562909. PMID 17391789. doi:10.1016/j.mimet.2007.02.005.
- ↑ 30,0 30,1 30,2 Jovel J, Patterson J, Wang W, Hotte N, O'Keefe S, Mitchel T, Perry T, Kao D, Mason AL, Madsen KL, Wong GK (2016-01-01). "Characterization of the Gut Microbiome Using 16S or Shotgun Metagenomics". Frontiers in Microbiology 7: 459. PMC 4837688. PMID 27148170. doi:10.3389/fmicb.2016.00459.
- ↑ Yoon, S. H., Ha, S. M., Kwon, S., Lim, J., Kim, Y., Seo, H. and Chun, J. (2017). Introducing EzBioCloud: A taxonomically united database of 16S rRNA and whole genome assemblies. Int J Syst Evol Microbiol. 67:1613-1617
- ↑ Larsen N, Olsen GJ, Maidak BL, McCaughey MJ, Overbeek R, Macke TJ, Marsh TL, Woese CR. (1993) The ribosomal database project. Nucleic Acids Res. Jul 1;21(13):3021-3.
- ↑ Elmar Pruesse, Christian Quast, Katrin Knittel, Bernhard M. Fuchs, Wolfgang Ludwig, Jörg Peplies, Frank Oliver Glöckner (2007) Nucleic Acids Res. SILVA: a comprehensive online resource for quality checked and aligned ribosomal RNA sequence data compatible with ARB. December; 35(21): 7188–7196.
- ↑ DeSantis TZ, Hugenholtz P, Larsen N, Rojas M, Brodie EL, Keller K, Huber T, Dalevi D, Hu P, Andersen GL (July 2006). "Greengenes, a chimera-checked 16S rRNA gene database and workbench compatible with ARB". Applied and Environmental Microbiology 72 (7): 5069–72. PMC 1489311. PMID 16820507. doi:10.1128/aem.03006-05.
- ↑ McDonald D, Price MN, Goodrich J, Nawrocki EP, DeSantis TZ, Probst A, Andersen GL, Knight R, Hugenholtz P (March 2012). "An improved Greengenes taxonomy with explicit ranks for ecological and evolutionary analyses of bacteria and archaea". The ISME Journal 6 (3): 610–8. PMC 3280142. PMID 22134646. doi:10.1038/ismej.2011.139.
Véxase tamén
editarLigazóns externas
editar- Laboratorio de Medicina da Universidade de Washington: Diagnose molecular | Secuenciación bacteriana
- The Ribosomal Database Project Arquivado 19 de agosto de 2020 en Wayback Machine.
- Ribosomas e ARN ribosómico: (ARNr)
- SILVA, base de datos de ARNr
- Greengenes: datos e ferramentas de ADNr 16S
- EzBioCloud