Termodinámica
Este artigo precisa de máis fontes ou referencias que aparezan nunha publicación acreditada que poidan verificar o seu contido, como libros ou outras publicacións especializadas no tema. Por favor, axude mellorando este artigo. (Desde xaneiro de 2017.) |
A termodinámica (do grego θερμη, therme, que significa "calor" e δυναμις, dynamis, que significa "potencia") é a parte da física que estuda os fenómenos relacionados con traballo, enerxía, calor e entropía, mediante as leis que gobernan os procesos nos que se ve involucrada a enerxía térmica. Nun sentido máis amplo estuda as relacións entre as propiedades macroscópicas dun sistema. A pesar de todos nós termos un sentimento do que é enerxía, é moi difícil elaborar unha definición precisa para ela. A enerxía pode ser vista como a capacidade de realizar un traballo, a capacidade de realizar mudanzas nos sistemas, un estado de vibración dos sistemas etc.
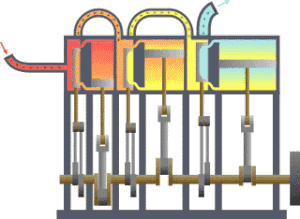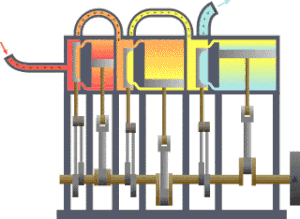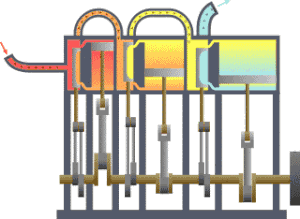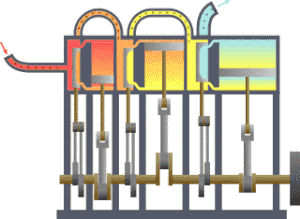
É bastante coñecido o feito de que unha substancia está constituída dun conxunto de partículas denominadas moléculas. As propiedades dunha substancia dependen, naturalmente, do comportamento destas partículas. A partir dunha visión macroscópica para o estudo do sistema, que non require o coñecemento do comportamento individual destas partículas, desenvolveuse a chamada termodinámica clásica. Permite abordar dunha maneira fácil e directa a solución de moitos problemas. Unha abordaxe máis elaborada e rigorosa, baseada no comportamento medio de grandes grupos de partículas, dáse na chamada termodinámica estatística.
Sempre que unha ou máis propiedades dun sistema varían, dise que ocorreu unha mudanza de estado. O camiño a través de sucesivos estados polo cal pasa o sistema defínese como proceso. Un proceso de case-equilibrio é aquel no que o desvío do equilibrio termodinámico é infinitesimal, e todos os estados polo cal o sistema pasa pode considerarse como estados de equilibrio. Moitos procesos reais poden aproximarse con precisión por sucesivos procesos de case-equilibrio.
Por outro lado, se un proceso evolucionou moi axiña e o sistema non estivo en equilibrio durante ningún instante durante a mudanza de estado, este é un proceso de non-equilibrio. Na termodinámica clásica a descrición destes procesos fica limitada ao que había antes e despois de restabelecido o equilibrio, sendo esta incapaz de especificar os estados intermediarios polos que pasou o sistema. Unha abordaxe máis eficiente destes procesos faise a través da termodinámica irreversible.
A pesar da antiga convivencia do ser humano con manifestacións de calor e outras formas de enerxía, a termodinámica non emerxeu como unha ciencia ata cerca de 1700 cando as primeiras tentativas para construír unha máquina a vapor foron feitas na Inglaterra por Thomas Savery e Thomas Newcomen. Estas máquinas eran moi lentas e ineficientes, mais eles abriron o camiño para o desenvolvemento dunha nova ciencia. O termo termodinámica foi primeiramente utilizado nunha publicación de Lord Kelvin en 1849. O primeiro texto de termodinámica foi escrito en 1859 por William Rankine, un profesor da Universidade de Glasgow na Escocia. O gran progreso da termodinámica ocorreu no inicio dos anos de 1900, cando se expurgaron teorías erróneas, transformándose nunha ciencia madura.
A termodinámica permite determinar a dirección na cal varios procesos físicos e químicos irán ocorrer. Tamén permite determinar as relacións entre as diversas propiedades dunha substancia. Con todo, non traballa con modelos da microestrutura da substancia, e non é capaz de fornecer detalles desta, mais unha vez que algúns datos sexan coñecidos, a través do método da termodinámica clásica, poden determinarse outras propiedades.
A termodinámica está baseada en leis estabelecidas experimentalmente:
- A lei cero da termodinámica determina que, cando dous corpos teñen igualdade de temperatura cun terceiro corpo, eles teñen igualdade de temperatura entre si. Esta lei é a base para a medición de temperatura.
- A Primeira Lei da Termodinámica fornece o aspecto cuantitativo de procesos de conversión de enerxía. É o principio da conservación da enerxía: "A enerxía do Universo é constante".
- A Segunda Lei da Termodinámica determina o aspecto cualitativo de procesos en sistemas físicos, isto é, os procesos ocorren nunha certa dirección mais non poden ocorrer na dirección oposta. Enunciada por Clausius da seguinte maneira: "A entropía do Universo tende a un máximo".
- A Terceira Lei da Termodinámica estabelece un punto de referencia absoluto para a determinación da entropía , representado polo estado derradeiro de orde molecular máxima e mínima enerxía. Enunciada como "A entropía dunha substancia cristalina pura na temperatura cero absoluto é cero". É extremadamente útil na análise termodinámica das reaccións químicas, como a combustión, por exemplo.
Sistemas termodinámicos editar
En termodinámica, a parte do universo obxecto de estudo denomínase sistema e a parte que pode interaccionar con este denomínase medio ambiente ou arredores.
Clases de sistemas dominantes:
- Sistema aberto, cando se pode transferir materia entre o sistema e os arredores,
- Sistema pechado, non se pode transferir materia entre o sistema e os arredores,
- Sistema illado, a materia non interacciona cos arredores.
Os sistemas están separados por paredes, que poden ser ríxidas ou non ríxidas, segundo sexan móbiles ou non, poden ser permeables ou impermeables ó paso de materia e de conducir a calor será adiabática, en caso contrario será non adiabática.
Historia da termodinámica editar
A historia da termodinámica como disciplina científica considérase xeralmente que comeza con Otto von Guericke quen, en 1650, construíu e deseñou a primeira bomba de baleiro e demostrou as propiedades do baleiro empregando os hemisferios de Magdeburgo. Guericke foi impulsado a facer o baleiro coa fin de refutar a suposición de Aristóteles de que "a natureza aborrece o baleiro". Pouco despois o físico e químico Robert Boyle estudou e mellorou os deseños de Guericke e en 1656, en coordinación co científico Robert Hooke, construíu unha bomba de aire. Con esta bomba, Boyle e Hooke observaron unha correlación entre presión, temperatura e volume. Co tempo, formularon a lei de Boyle, indicando que para un gas a temperatura constante, a presión e o volume son inversamente proporcionais e outras leis dos gases.
En 1679, un asociado de Boyle, Denis Papin baseándose nestes conceptos, construíu un dixestor de vapor, que era un recipiente pechado cunha tampa con peche hermético no que o vapor confinado alcanzaba unha alta presión, aumentando o punto de ebulición e acurtando o tempo de cocción dos alimentos. En 1967 o enxeñeiro Thomas Savery, a partir dos deseños de Papin, construíu o primeiro motor térmico, seguido por Thomas Newcomen en 1712. Aínda que estes primeiros motores eran básicos e pouco eficientes atraeron a atención dos científicos máis destacados da época.
En 1733, Bernoulli empregou métodos estatísticos, xunto coa mecánica clásica, para extraer resultados sobre a hidrodinámica, iniciando a mecánica estatística.
En 1781 desenvolvéronse os conceptos de capacidade calorífica e calor latente por Joseph Black, profesor da Universidade de Glasgow, onde James Watt traballou como fabricante de instrumentos. Watt consultou con Black nas probas da máquina de vapor, mais foi Watt quen concibiu a idea do condensador externo, aumentando grandemente a eficiencia da máquina de vapor. Dous anos despois Antoine Lavoisier propuxo a teoría do calórico.
En 1798 Benjamin Thompson, conde de Rumford, demostrou a conversión do traballo mecánico en calor.
Sobre a base de todo este traballo previo, Sadi Carnot, o "pai da termodinámica ", publicou en 1824 un discurso sobre a eficiencia térmica, a enerxía, a enerxía motriz e o motor. O documento describe as relacións básicas enerxéticas entre a máquina de Carnot, o ciclo de Carnot e a enerxía motriz, marcando o inicio da termodinámica como ciencia moderna.
O primeiro libro de texto sobre termodinámica foi escrito en 1859 por William Rankine, quen se formara como físico e profesor de enxeñaría civil e mecánica na Universidade de Glasgow. A primeira e segunda leis da termodinámica xurdiron simultaneamente na década de 1850, principalmente polas obras de Germain Henri Hess, William Rankine, Rudolf Clausius, James Prescott Joule e William Thomson (Lord Kelvin).
Os fundamentos da termodinámica estatística establecéronas físicos como James Clerk Maxwell, Ludwig Boltzmann, Max Planck, Rudolf Clausius, Johannes van der Waals e Josiah Willard Gibbs.
Dende 1873 ata 1876, o físico matemático estadounidense Josiah Willard Gibbs publicou unha serie de tres artigos nos que demostraba como os procesos termodinámicos, incluíndo reaccións químicas, poderían analizarse graficamente. Mediante o estudo da enerxía, a entropía, o potencial químico, a temperatura e a presión do sistema termodinámico, pódese determinar se un proceso se produce espontaneamente. A termodinámica química e a fisicoquímica foron desenvolvidas ademais por Walther Nernst, Pierre Duhem, Gilbert N. Lewis, Jacobus Henricus van 't Hoff e Théophile de Donder, aplicando os métodos matemáticos de Gibbs.
Véxase tamén editar
| Wikimedia Commons ten máis contidos multimedia na categoría: Termodinámica |
| O Galilibros ten un manual sobre: Termodinámica |
Bibliografía editar
- Boltzmann, Ludwig (1986). Escritos de mecánica y termodinámica (en castelán). Alianza Editorial. ISBN 842060173X.
- Pérez Cruz, Justo R. (2005). La Termodinámica de Galileo a Gibbs (en castelán). Fundación Canaria Orotava de Historia de la Ciencia. ISBN 978-84-609-7580-9. Arquivado dende o orixinal o 16 de outubro de 2013. Consultado o 01 de abril de 2017.
- Planck, Max (1990). Treatise on Thermodynamics (en inglés). Dover Publications. ISBN 048666371X.
- Zemansky, Mark W. (1985). Calor y termodinámica. Madrid: McGraw-Hill. ISBN 84-85240-85-5.
- Callen, Herbert B. (1985). Thermodynamics and an Introduction to Thermostatistics. John Wiley & Sons.
- Reif, Federick (1985). Fundamentals of Statistical and Thermal Physics. McGraw-Hill.
- Masanes, Lluís; Oppenheim, Jonathan (2017). A general derivation and quantification of the third law of thermodynamics (en inglés). Nature.