Transaminación
A transaminación é unha reacción química na que se trransfire un grupo amino a un cetoácido para formar novos aminoácidos. Esta ruta é tamén responsable da desaminación de moitos aminoácidos. Por esta ruta os aminoácidos esenciais transfórmanse en non esenciais.
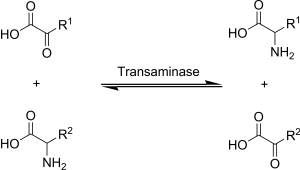
A transaminación en bioquímica é realizada por encimas chamados transaminases ou aminotransferases. O α-cetoglutarato actúa como o aceptor predominante de grupos amino e produce glutamato como novo aminoácido.
- Aminoácido + α-cetoglutarato ↔ α-cetoácido + Glutamato
O grupo amino do glutamato, á súa vez, é transferida ao oxaloacetato nunha segunda reacción de transaminación que rende aspartato.
Mecanismo de acción
editar- Artigo principal: Aminotransferase.
A transaminación catalizada por aminotransferases ocorre en dúas fases. Na primeira fase, o grupo α-amino dun aminoácido é transferido ao encima, producindo o correspondente α-cetoácido e o encima aminado. Durante a segunda fase, o grupo amino é transferido ao cetoácido aceptor, formando o produto aminoácido e rexenerando o encima. A quiralidade dun aminoácido queda determinada durante a transaminación. Para que se complete a reacción, as aminotransferases requiren a participación dun coencima que contén un grupo aldehido chamado piridoxal 5'-fosfato (PLP), un derivado da piridoxina (vitamina B6). O grupo amino é acomodado pola conversión do coencima PLP a piridoxamina 5'-fosfato (PMP). O PLP está unido covalentemente ao encima por un enlace de base de Schiff formado pola condensación do seu grupo aldehido co grupo ε-amino dun residuo de lisina do encima. A base de Schiff, que se conxuga ao anel de piridinio do encima é o foco da actividade do coencima.
Mecanismo de tipo Ping Pong Bi Bi da transaminación catalizada por encima dependente de PLP. A reacción de aminotransferase ocorre en dúas fases que constan de tres pasos: transaminación, tautomerización e hidrólise. Na primeira fase, o grupo alfa amino do aminoácido é transferido ao PLP rendendo un alfa cetoácido e PMP. Na segunda fase da reacción, na cal o grupo amino do PMP é transferido a un alfa-cetoácido diferente, rendendo un novo alfa-aminoácido e PLP.
O produto das reaccións de transaminación depende da dispoñibilidade de α-cetoácidos. Os produtos xeralmente son a alanina ou o aspartato ou o glutamato, xa que os seus correspondentes alfa-cetoácidos son producidos na metabolismo enerxético. A lisina, prolina e treonina son os únicos aminoácidos que non sempre sofren transaminación e usan as súas respectivas deshidroxenases.
Mecanismo alternativo
editarUn segundo tipo de reacción de transaminación pode ser descrita como unha substitución nucleofílica dun amino ou anión amida sobre un amino ou sal de amonio.[1] Por exemplo, o ataque dunha amina primaria por un anión amida primaria pode utilizarse para preparar aminas secundarias:
- RNH2 + R'NH− → RR'NH + NH2−
Poden prepararse aminas secundarias simétricas usando níquel de Raney (2RNH2 → R2NH + NH3). E, finalmente, os sales de amonio cuaternario poden ser desalquilados usando etanolamina:
- R4N+ + NH2CH2CH2OH → R3N + RN+H2CH2CH2OH
Os aminonaftalenos tamén sofren transaminacións.[2]
Tipos de aminotransferases
editarA transaminación está mediada por diferentes tipos de encimas aminotransferases, que poden ser específicas para cada aminoácido ou poden procesar un grupo de aminoácidos quimicamentre similares. Estas últimas actúan sobre o grupo de aminoácidos de cadea ramificada, que son a leucina, isoleucina e valina. Os dous tipos comúns de aminotransferases son a alanina aminotransferase (ALT) e a aspartato aminotransferase (AST).
Notas
editar- ↑ Booth, Gerald (2000-01-01). Naphthalene Derivatives. Wiley-VCH Verlag GmbH & Co. KGaA. ISBN 9783527306732. doi:10.1002/14356007.a17_009.
Véxase tamén
editarBibliografía
editar- Smith, M. B. e March, J. Advanced Organic Chemistry: Reactions, Mechanisms, and Structure, quinta ed. Wiley, 2001, p. 503. ISBN 0-471-58589-0
- Gerald Booth "Naphthalene Derivatives" en Ullmann's Encyclopedia of Industrial Chemistry, 2005, Wiley-VCH, Weinheim. doi:10.1002/14356007.a17_009
- Voet & Voet. "Biochemistry" Fourth edition