Proteína adaptadora do transporte vesicular
As proteínas adaptadoras do transporte vesicular son proteínas implicadas na formación de complexos que funcionan no tráfico de moléculas desde unha localización subcelular a outra.[2][3][4] Estes complexos funcionan concentrando as correctas moléculas de cargamento en vesículas de transporte que se evaxinan ou extruden dun orgánulo e viaxan a outra localización, onde o cargamento será entregado. Coñécense algúns detalles sobre como estas proteínas adaptadoras mostran a súa especificidade de tráfico, pero aínda queda moito por aprender.
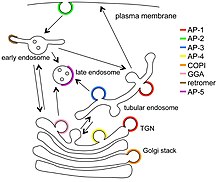

Varios trastornos humanos están asociados con defectos nos compoñentes destes complexos,[5][6] como o alzhéimer e o párkinson.[7]
As proteínas
editar- Véxase tamén: Proteína adaptadora da clatrina.
A maioría das proteínas adaptadoras son heterotetrámeros. Nos complexos de proteínas adaptadoras hai dúas grandes proteínas (∼100 kD) e dúas proteínas pequenas. Unha das proteínas grandes denomínase β (beta), e β1 está no complexo AP-1, β2 no complexo AP-2, e así sucesivamente.[10] A outra proteína grande ten diferentes designación nos diferentes complexos. Na AP-1 denomínase γ (gamma), a AP-2 chámase α (alfa), a AP-3, δ (delta), a AP-4, ε (épsilon) e a AP-5 ten a denominación ζ (dseta).[10] As dúas proteínas pequenas son a subunidade media denominada μ (mu ∼50 kD) e a subunidade pequena σ (sigma ∼20 kD), e denominadas do 1 ao 5 correspondendo cos 5 complexos AP.[10] Os compoñentes de COPI (cop un) un coatómero, e de TSET (T-set), un complexo de tráfico de membrana, teñen heterotetrámeros similares aos dos complexos AP.[11]
O retrómero non está estreitamente relacionado[12] e as súas proteínas non serán descritas aquí. As GGA son un grupo de proteínas relacionadas (tres en humanos) que actúan como proteínas adaptadoras da clatrina monómeras en varios importantes tráficos de vesículas de membrana,[13] pero non son similares a calquera dos complexos de proteínas adaptadoras e non se discutirán en detalle neste artigo. As estoninas (que non se mostran na primeira figura) son tamén monómeros similares nalgúns aspectos ás GGA[4] e tampouco se discutirán en detalle neste artigo.
Os PTB son dominios proteicos que inclúen o NUMB, DAB1 e DAB2. A epsina e a AP180 no seu dominio ANTH son outras proteínas adaptadoras.[4]
Un complexo de transporte importante, o COPII, non se mostra na primeira figura. O complexo COPII é un heterohexámero, pero non está estreitamente relacionado cos complexos AP/TSET. As proteínas individais do complexo COPII denomínanse proteínas SEC, porque están codificadas por xenes de mutantes secretores de lévedos. Un aspecto especialmente interesante de COPII é que pode formar vesículas esféricas típicas e túbulos para transportar grandes moléculas como os precursores do coláxeno, que non poden axustarse dentro de vesículas esféricas típicas.[14] Estes son exemplos do conxunto máis grande de adaptadores de cargamento.[3]
Evolución
editarO antepasado común máis recente dos eucariotas debeu ter un mecanismo para transportar moléculas entre as súas endomembranas e orgánulos, e propúxose a probable identidade do complexo adaptador implicado.[11] Pénsase que o antepasado común máis recente tiña 3 proteínas implicadas no tráfico e que formaban un heterodímero. Ese heterodímero seguidamente "dimerizouse" para formar un complexo de 6 membros. Os compoñentes individuais despois cambiaron dando os actuais complexos, na orde mostrada, na que AP1 e AP2 son os últimos en diverxer.[11]
Ademais, un compoñente de TSET, unha muniscina tamén chamada proteína TCUP, parece que evolucionou en parte das proteínas dos opistocontos (animais e fungos).[11] Partes dos complexos de proteínas adaptadoras evolucionaron dando partes das proteínas GGA e estonina.[4] Hai probas que indican que partes do complexo do poro nuclear e do COPII poden estar relacionados evolutivamente.[15]
Formación de vesículas de transporte
editarO tipo mellor caracterizado de vesícula é a vesícula revestida de clatrina (CCV). Tamén está moi estudadoa a formación de vesículas COPII no retículo endoplásmico e o seu transporte ao aparato de Golgi. O heterotetrámero da COPI é similar ao da AP/clatrina, pero o revestimento da COPI non está estreitamente relacionado cos revestimentos das vesículas revestidas de clatrina ou as COPII.[16][17] A AP-5 está asociada con dúas proteínas, SPG11 e SPG15, que teñen certa semellanza estrutural coa clatrina, e poden formar o revestimento arredor do complexo AP-5,[18] pero a ultraestrutura do revestimento non se coñece. O revestimento da AP-4 é descoñecido.[19][a]
Unha característica case universal da ensamblaxe do revestimento é o recrutamento de varios complexos adaptadores na membrana "doante" pola proteína Arf1. A única excepción coñecida é a AP-2, que é recrutada por certo lípido da membrana plasmática.[20]
Outra característica case universal da ensamblaxe do revestimento é que os adaptadores son recrutados primeiro, e estes recrutan despois o revestimento. A excepción é COPI, na cal as 7 proteínas son recrutadas na membrana como heptámeros.[16]
Como se ilustra na imaxe que acompaña, a produción de vesículas revestidas non é instantánea, e unha considerable fracción do tempo de maduración utilízase para establecer interaccións "abortivas" ou "fútiles"[21] ata que se producen suficientes interaccións simultáneas para permitir que a estrutura continúe desenvolvéndose.[22]
O último paso na formación de vesículas de transporte é a evaxinación da membrana doante. Para isto cómpre enerxía, pero mesmo no caso ben estudado das vesículas revestidas de clatrina, non todos requiren dinamina. A ilustración que acompaña mostra o caso das vesíclas revestids de clatrina AP-2, aínda que as vesículas AP-1 e AP-3 non usan dinamina.[23]
Selección das moléculas do cargamento
editarO tipo de moléculas que son incorporadas nun determinado tipo de vesícula depende das interaccións específicas que se establecen. Algunhas destas interaccións establécense directamente cos complexos de proteínas adaptadoras e outros indirectamente con "adaptadores alternativos".[4] Como exemplos, as proteínas de membrana poden establecer interaccións directas, mentres que as proteínas que están solubilizadas no lume dos orgánulos doantes únense indirectamente aos complexos de proteínas adaptadoras ao ligarse a proteínas de membrana que atravesan a membrana e únense polo seu extremo luminal á molécula cargamento desexada. As moléculas que non deberían ser incluídas na vesícula parece que son excluídas por "ateigamento molecular" (molecular crowding).[24]
Os "sinais" ou "motivos" de aminoácidos das proteínas cargamento que interaccionan coas proteínas adaptadoras poden ser moi curtos. Por exemplo, un caso ben coñecido é o do motivo dileucina, no cal un residuo do aminoácido leucina vai seguido doutra leucina ou isoleucina.[25][b] Un exemplo incluso máis simple é o do sinal baseado na tirosina, que é YxxØ (un residuo de tirosina separado por dous residuos de aminoácidos doutro residuo de aminoácido voluminoso hidrófobo). A figura que acompaña mostra como unha pequena parte dunha proteína pode interaccionar especificamente con outra proteína, así que estes curtos motivos de sinalización non deberían ser tan sorprendentes.[26] O tipo de comparacións de secuencia usábanse, en parte, para definir estes motivos.[10]
Nalgúns casos, as modificacións postraducionais, como as fosforilacións (mostradas na figura) son importantes para o recoñecemento do cargamento.
Doenzas
editarOs fallos nestes adaptadores orixinan as chamadas enfermidades de adaptadores.[6]
A AP-2/vesícula revestida de clatrina están implicadas na hipercolesterolemia autosómica recesiva por medio da proteína adaptadora de receptor de lipoproteínas de baixa densidade 1 asociada.[27][28]
O retrómero está implicado na reciclaxe de compoñentes da membrana plasmáica. A importancia desta reciclaxe na sinapse é insinuada nunha das figuras da galería. Hai polo menos tres modos polos que a disfunción do retrómero pode contribuír a orixinar trastornos cerebrais, incluíndos as enfermidades de Alzheimer e Parkinson.[7]
A AP-5 é o complexo descrito máis recentemente e unha das razóns que sosteñen a idea de que é un complexo adaptador auténtico é que está asociado á peraplexia espástica hereditaria,[18] igual que a AP-4.[6] A AP-1 está ligada á síndrome MEDNIK. A AP-3 está ligada á síndrome de Hermansky–Pudlak. A COPI está ligada a unha doenza autoinmune.[29] A COPII está ligada á displasia cranio–lentículo–sutural. Unha das proteínas GGA pode estar implicada na enfermidade de Alzheimer.[30]
Galería
editar-
Os compoñentes da sinapse recíclanse por medio de vesículas de transporte
-
O complexo de tráfico de membranas TSET
-
A muniscina evolucionou a partir dunha parte do TCUP
-
Vías de transporte vesicular en plantas.
Notas e referencias
editar- ↑ A AP-4 é moito menos abondosa que outros complexos AP e está ausente de varios organismos modelo, o que fai que as análises xenéticas e bioquímicas sexan máis difíciles.
- ↑ O motivo "baseado na dileucina" completo é (D/E)XXXL(L/I), onde X é calquera aminoácido e D/E é ou un residuo de ácido aspártico ou de ácido glutámico
- ↑ Unha visión diferente dos 5 complexos de proteínas adaptadoras pode verse aquí: Mattera R, Guardia CM, Sidhu SS, Bonifacino JS. "Figure 1: Isolation of Tepsin as an AP-4 interactor". J Biol Chem 290: 30736–49. PMC 4692204. PMID 26542808. doi:10.1074/jbc.M115.683409.
- ↑ Bonifacino JS (2014). "Adaptor proteins involved in polarized sorting". The Journal of Cell Biology 204 (1): 7–17. PMC 3882786. PMID 24395635. doi:10.1083/jcb.201310021.
- ↑ 3,0 3,1 Paczkowski JE, Richardson BC, Fromme JC (2015). "Cargo adaptors: structures illuminate mechanisms regulating vesicle biogenesis". Trends in Cell Biology 25 (7): 408–16. PMC 4475447. PMID 25795254. doi:10.1016/j.tcb.2015.02.005.
- ↑ 4,0 4,1 4,2 4,3 4,4 Robinson MS (2015). "Forty Years of Clathrin-coated Vesicles". Traffic (Copenhagen, Denmark) 16 (12): 1210–38. PMID 26403691. doi:10.1111/tra.12335.
- ↑ De Matteis MA, Luini A (September 2011). "Mendelian disorders of membrane trafficking". The New England Journal of Medicine 365 (10): 927–38. PMID 21899453. doi:10.1056/NEJMra0910494.
- ↑ 6,0 6,1 6,2 Bonifacino J (28 January 2014). "Adaptor diseases : bridging cell biology and medicine". videocast.nih.gov. National Institutes of Health. Consultado o 15 April 2017.
- ↑ 7,0 7,1 Small SA, Petsko GA (March 2015). "Retromer in Alzheimer disease, Parkinson disease and other neurological disorders". Nature Reviews. Neuroscience 16 (3): 126–32. PMID 25669742. doi:10.1038/nrn3896.
- ↑ "here".
- ↑ "here".
- ↑ 10,0 10,1 10,2 10,3 Mattera R, Guardia CM, Sidhu SS, Bonifacino JS (2015). "Bivalent Motif-Ear Interactions Mediate the Association of the Accessory Protein Tepsin with the AP-4 Adaptor Complex". The Journal of Biological Chemistry 290 (52): 30736–49. PMC 4692204. PMID 26542808. doi:10.1074/jbc.M115.683409.
- ↑ 11,0 11,1 11,2 11,3 Hirst J, Schlacht A, Norcott JP, Traynor D, Bloomfield G, Antrobus R, Kay RR, Dacks JB, Robinson MS (2014). "Characterization of TSET, an ancient and widespread membrane trafficking complex". eLife 3: e02866. PMC 4031984. PMID 24867644. doi:10.7554/eLife.02866.
- ↑ Burd C, Cullen PJ (2014). "Retromer: a master conductor of endosome sorting". Cold Spring Harbor Perspectives in Biology 6 (2): a016774. PMC 3941235. PMID 24492709. doi:10.1101/cshperspect.a016774.
- ↑ Tan J, Evin G (2012). "Β-site APP-cleaving enzyme 1 trafficking and Alzheimer's disease pathogenesis". Journal of Neurochemistry 120 (6): 869–80. PMID 22171895. doi:10.1111/j.1471-4159.2011.07623.x.
- ↑ Zanetti G, Prinz S, Daum S, Meister A, Schekman R, Bacia K, Briggs JA (2013). "The structure of the COPII transport-vesicle coat assembled on membranes". eLife 2: e00951. PMC 3778437. PMID 24062940. doi:10.7554/eLife.00951.
- ↑ Promponas VJ, Katsani KR, Blencowe BJ, Ouzounis CA (2016). "Sequence evidence for common ancestry of eukaryotic endomembrane coatomers". Scientific Reports 6: 22311. Bibcode:2016NatSR...622311P. PMC 4773986. PMID 26931514. doi:10.1038/srep22311.
- ↑ 16,0 16,1 Faini M, Beck R, Wieland FT, Briggs JA (June 2013). "Vesicle coats: structure, function, and general principles of assembly". Trends in Cell Biology 23 (6): 279–88. PMID 23414967. doi:10.1016/j.tcb.2013.01.005.
- ↑ Jackson LP (August 2014). "Structure and mechanism of COPI vesicle biogenesis". Current Opinion in Cell Biology 29: 67–73. PMID 24840894. doi:10.1016/j.ceb.2014.04.009.
- ↑ 18,0 18,1 Hirst J, Borner GH, Edgar J, Hein MY, Mann M, Buchholz F, Antrobus R, Robinson MS (2013). "Interaction between AP-5 and the hereditary spastic paraplegia proteins SPG11 and SPG15". Molecular Biology of the Cell 24 (16): 2558–69. PMC 3744948. PMID 23825025. doi:10.1091/mbc.E13-03-0170.
- ↑ Frazier MN, Davies AK, Voehler M, Kendall AK, Borner GH, Chazin WJ, Robinson MS, Jackson LP (2016). "Molecular Basis for the Interaction Between AP4 β4 and its Accessory Protein, Tepsin". Traffic (Copenhagen, Denmark) 17 (4): 400–15. PMC 4805503. PMID 26756312. doi:10.1111/tra.12375.
- ↑ Yu X, Breitman M, Goldberg J (2012). "A structure-based mechanism for Arf1-dependent recruitment of coatomer to membranes". Cell 148 (3): 530–42. PMC 3285272. PMID 22304919. doi:10.1016/j.cell.2012.01.015.
- ↑ Kirchhausen, Tom. "Building Bubbles". youtube.com. harvard.edu. Consultado o 23 April 2017.
- ↑ Cocucci E, Aguet F, Boulant S, Kirchhausen T (August 2012). "The first five seconds in the life of a clathrin-coated pit". Cell 150 (3): 495–507. PMC 3413093. PMID 22863004. doi:10.1016/j.cell.2012.05.047.
- ↑ Kural C, Tacheva-Grigorova SK, Boulant S, Cocucci E, Baust T, Duarte D, Kirchhausen T (2012). "Dynamics of intracellular clathrin/AP1- and clathrin/AP3-containing carriers". Cell Reports 2 (5): 1111–9. PMC 3513667. PMID 23103167. doi:10.1016/j.celrep.2012.09.025.
- ↑ Hirst J, Edgar JR, Borner GH, Li S, Sahlender DA, Antrobus R, Robinson MS (2015). "Contributions of epsinR and gadkin to clathrin-mediated intracellular trafficking". Molecular Biology of the Cell 26 (17): 3085–103. PMC 4551321. PMID 26179914. doi:10.1091/mbc.E15-04-0245.
- ↑ Mattera R, Boehm M, Chaudhuri R, Prabhu Y, Bonifacino JS (2011). "Conservation and diversification of dileucine signal recognition by adaptor protein (AP) complex variants". The Journal of Biological Chemistry 286 (3): 2022–30. PMC 3023499. PMID 21097499. doi:10.1074/jbc.M110.197178.
- ↑ Traub LM, Bonifacino JS (2013). "Cargo recognition in clathrin-mediated endocytosis". Cold Spring Harbor Perspectives in Biology 5 (11): a016790. PMC 3809577. PMID 24186068. doi:10.1101/cshperspect.a016790.
- ↑ Online 'Mendelian Inheritance in Man' (OMIM) 605747
- ↑ "Entrez Gene: LDLRAP1 low density lipoprotein receptor adaptor protein 1".
- ↑ Online 'Mendelian Inheritance in Man' (OMIM) 616414
- ↑ Online 'Mendelian Inheritance in Man' (OMIM) 606006
Véxase tamén
editarOutros artigos
editarLigazóns externas
editar- Un collage de micrografías electrónicas que mostran as COPI, COPII e vesículas de clatrina
- estrutura do revestimento COPI Arquivado 28 de abril de 2017 en Wayback Machine. de [1]
- Vídeo-descrición da enfermidade de COPII CLSD
- Víeos de iBiology videos de Kai Simons sobre lípidos, balsas lipídicas e tráfico celular