Complexo do citocromo b6f
O complexo do citocromo b6f (plastoquinol—plastocianina redutase; número EC 1.10.99.1) é un complexo encimático situado na membrana dos tilacoides dos cloroplastos das plantas, cianobacterias, e algas verdes, que intervén na fase luminosa da fotosíntese catalizando a transferencia de electróns entre o plastoquinol e a plastocianina.[1] A reacción é análoga á catalizada polo citocromo bc1 (complexo III) da cadea de transporte electrónico mitocondrial. Na fotosíntese, o complexo do citocromo b6f intervén na transferencia de electróns entre os fotosistemas II e I.
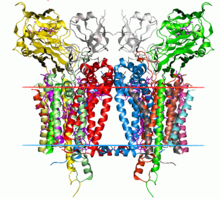
Estrutura encimática
editarO complexo do citocromo b6f é un dímero, e cada un dos seus monómeros está composto por oito subunidades.[2] O peso molecular total do complexo é de 217 kDa. Os monómeros constan dos seguintes compoñentes:
- catro subunidades grandes, que son o citocromo f de 32 kDa (cun hemo de tipo c), un citocromo b6 de 25 kDa (cun grupo hemo de alto e baixo potencial), a proteína ferro-sulfurada de Rieske de 19 kDa (que contén un grupo [2Fe-2S]), e unha subunidade IV de 17 kDa;
- catro subunidades pequenas (de 3-4 kDa) chamadas: PetG, PetL, PetM, e PetN.[2][3]
Foron determinados xa as estruturas cristalinas dos complexos citocromo b6f de Chlamydomonas reinhardtii, Mastigocladus laminosus, e Nostoc sp. PCC 7120.[4][5][6] O complexo é estruturalmente similar ao citocromo bc1. O citocromo b6 e a subunidade IV son homólogas ao citocromo b [7], e as proteínas ferro-sulfuradas de Rieske de ambos os complexos son homólogas.[8] Porén, os citocromos f e c1 non son homólogos.[9]
O citocromo b6f contén sete grupos prostéticos.[10][11] Catro deles atópanse tanto no citocromo b6f coma no bc1, e son: o hemo tipo c dos citocromos c1 e f, os dous hemo tipo b (bp e bn) do bc1 e b6f, e o grupo [2Fe-2S] da proteína de Rieske. Os outros tres grupos prostéticos atópanse no citocromo b6f, e son: clorofila a, β-caroteno, e hemo cn (tamén chamado hemo x).[4]
Funcións
editarNa fotosíntese, o complexo do citocromo b6f funciona mediando a transferencia de electróns entre os dous complexos dos centros de reacción fotosintéticos, desde o fotosistema II ao fotosistema I, á vez que transfire protóns desde o estroma do cloroplasto ao lume dos tilacoides traídos polas plastoquinonas/plastoquinol.[12] O transporte de electróns por medio do citocromo b6f é responsable da creación do gradiente de protóns que impulsa a síntese de ATP nos cloroplastos (fotofosforilación acíclica).[3]
Noutra reacción diferente, o complexo do citocromo b6f xoga un papel central na fotofosforilación cíclica, na cal o NADP+ non acepta os electróns da ferredoxina reducida.[1] Á vez que transporta electróns, o complexo do citocromo b6f transfire protóns (traídos polas plastoquinonas/plastoquinol) desde o estroma do cloroplasto a través da membrana do tilacoide ata o lume tilacoidal. Este ciclo dá lugar á creación dun gradiente de protóns polo citocromo b6f, que se pode utilizar para impulsar a síntese de ATP. Este ciclo é esencial no conxunto da fotosíntese,[13] xa que se cre que axuda a manter na produción da fase luminosa unha proporción axeitada de ATP/NADPH para a fixación do carbono na fase escura.[14][15]
Mecanismo de reacción
editarO complexo do citocromo b6f é responsable da "fotofosforilación acíclica" (1) e da "fotofosforilacion cíclica" (2), na que se transfiren electróns entre dous transportadores redox móbiles, o plastoquinol (QH2 ou PQH2) e a plastocianina (Pc):
| H2O | → | fotosistema II | → | QH2 | → | Cyt b6f | → | Pc | → | fotosistema I | → | NADPH | (1) |
| QH2 | → | Cyt b6f | → | Pc | → | fotosistema I | → | Q | (2) |
O citocromo b6f cataliza a transferencia de electróns do plastoquinol á plastocianina, á vez que bombea protóns desde o estroma ao lume tilacoidal:
- QH2 + 2Pc(Cu2+) + 2H+ (estroma) → Q + 2Pc(Cu+) + 4H+ (lume)[1]
Esta reacción ocorre por medio do chamado ciclo Q (igual ca no complexo III mitocondrial).[16] A plastoquinona actúa como o transportador de electróns, transferindo os seus dous electróns a unha cadea de transportadores de electróns de alto e baixo potencial por medio dun mecanismo chamado bifurcación de electróns.[17]
Ciclo Q
editarPrimeira parte do ciclo Q
- O QH2 (plastoquinol) únese ao lado luminal ou "p" (positivo) do complexo. É oxidado a semiquinona (SQ) polo centro ferro-sulfurado (centro de transporte electrónico de alto potencial) e libera dous protóns no lume tilacoidal.
- O centro ferro-sulfurado reducido transfire o seu electrón a través do citocromo f á plastocianina (Pc).
- No centro de transporte electrónico de baixo potencial a SQ transfire o seu electrón ao hemo bp do citocromo b6.
- O hemo bp transfire entón o electrón ao hemo bn.
- O hemo bn reduce a plastoquinona (Q) cun electrón para formar a SQ.
Segunda metade do ciclo Q
- Un segundo plastoquinol (QH2) únese ao complexo.
- No centro de transporte electrónico de alto potencial un electrón reduce outra Pc oxidada.
- No centro de transporte electrónico de baixo potencial, o electrón procedente do hemo bn é transferido á SQ, e a Q2- completamente reducida capta dous protóns do estroma para formar QH2.
- A Q (oxidada) e a QH2 (reducida) que foron rexeneradas difunden na membrana.
Transferencia cíclica de electróns
editarA diferenza do complexo III mitocondrial, o citocromo b6f cataliza outra reacción de transferencia de electróns que é central para a fotofosforilación cíclica. O electrón procedente da ferredoxina (Fd) transfírese á plastoquinona e despois o complexo do citocromo b6f reduce a plastocianina, a cal é reoxidada polo P700 do fotosistema I.[18] O mecanismo exacto de como a plastoquinona é reducida pola ferredoxina aínda está a investigarse. Unha proposta é que alí existe unha ferredoxina:plastoquinona-redutase ou unha NADP deshidroxenase.[18] Como parece que non se require o hemo x para que se realice o ciclo Q e non se atopa no complexo III,[12] propúxose que para a fotofosforilación cíclica se utiliza o seguinte mecanismo:[17][19]
- Fd (red.) + hemo x (ox.) → Fd (ox.) + hemo x (red.)
- hemo x (red.) + Fd (red.) + Q + 2H+ → hemo x (ox.) + Fd (ox.) + QH2
Notas
editar- ↑ 1,0 1,1 1,2 Berg, Jeremy M. ; Tymoczko, John L.; Stryer, Lubert. (2007). W.H. Freeman - New York, ed. Biochemistry. ISBN 978-0-7167-8724-2.
- ↑ 2,0 2,1 Whitelegge, JP.; Zhang, H.; Aguilera, R.; Taylor, RM.; Cramer, WA. (2002). "Full subunit coverage liquid chromatography electrospray ionization mass spectrometry (LCMS+) of an oligomeric membrane protein: cytochrome b(6)f complex from spinach and the cyanobacterium Mastigocladus laminosus.". Mol Cell Proteomics 1 (10): 816–27. PMID 12438564. PMID 12438564
- ↑ 3,0 3,1 Voet, Donald J. ; Judith G. Voet (2011). Wiley, J - New York, NY, ed. Biochemistry. ISBN 978-0-470-57095-1.
- ↑ 4,0 4,1 Stroebel, D.; Choquet, Y.; Popot, JL.; Picot, D. (2003). "An atypical haem in the cytochrome b(6)f complex.". Nature 426 (6965): 413–8. PMID 14647374. doi:10.1038/nature02155. PMID 14647374
- ↑ Yamashita, E.; Zhang, H.; Cramer, WA. (2007). "Structure of the cytochrome b6f complex: quinone analogue inhibitors as ligands of heme cn.". J Mol Biol 370 (1): 39–52. PMID 17498743. doi:10.1016/j.jmb.2007.04.011.
- ↑ Baniulis, D.; Yamashita, E.; Whitelegge, JP.; Zatsman, AI.; Hendrich, MP.; Hasan, SS.; Ryan, CM.; Cramer, WA. (2009). "Structure-Function, Stability, and Chemical Modification of the Cyanobacterial Cytochrome b6f Complex from Nostoc sp. PCC 7120.". J Biol Chem 284 (15): 9861–9. PMID 19189962. doi:10.1074/jbc.M809196200. PMID 19189962
- ↑ Widger, WR.; Cramer, WA.; Herrmann, RG.; Trebst, A. (1984). "Sequence homology and structural similarity between cytochrome b of mitochondrial complex III and the chloroplast b6-f complex: position of the cytochrome b hemes in the membrane.". Proc Natl Acad Sci U S A 81 (3): 674–8. PMID 6322162. doi:10.1073/pnas.81.3.674. PMID 6322162
- ↑ Carrell, CJ.; Zhang, H.; Cramer, WA.; Smith, JL. (1997). "Biological identity and diversity in photosynthesis and respiration: structure of the lumen-side domain of the chloroplast Rieske protein.". Structure 5 (12): 1613–25. PMID 9438861. PMID 9438861
- ↑ Martinez, SE.; Huang, D.; Szczepaniak, A.; Cramer, WA.; Smith, JL. (1994). "Crystal structure of chloroplast cytochrome f reveals a novel cytochrome fold and unexpected heme ligation.". Structure 2 (2): 95–105. PMID 8081747. PMID 8081747
- ↑ Baniulis, D.; Yamashita, E.; Zhang, H.; Hasan, SS.; Cramer, WA. "Structure-function of the cytochrome b6f complex.". Photochem Photobiol 84 (6): 1349–58. PMID 19067956. doi:10.1111/j.1751-1097.2008.00444.x. PMID 19067956
- ↑ Cramer, WA.; Zhang, H.; Yan, J.; Kurisu, G.; Smith, JL. (2004). "Evolution of photosynthesis: time-independent structure of the cytochrome b6f complex.". Biochemistry 43 (20): 5921–9. PMID 15147175. doi:10.1021/bi049444o. PMID 15147175
- ↑ 12,0 12,1 Kurisu, G.; Zhang, H.; Smith, JL.; Cramer, WA. (2003). "Structure of the cytochrome b6f complex of oxygenic photosynthesis: tuning the cavity.". Science 302 (5647): 1009–14. PMID 14526088. doi:10.1126/science.1090165. PMID 14526088
- ↑ Munekage, Y.; Hashimoto, M.; Miyake, C.; Tomizawa, K.; Endo, T.; Tasaka, M.; Shikanai, T. (2004). "Cyclic electron flow around photosystem I is essential for photosynthesis.". Nature 429 (6991): 579–82. PMID 15175756. doi:10.1038/nature02598. PMID 15175756
- ↑ Blankenship, Robert E. (2002). Blackwell Science - Oxford ; Malden, MA, ed. Molecular mechanisms of photosynthesis. ISBN 978-0-632-04321-7.
- ↑ Bendall, Derek. "Cyclic photophosphorylation and electron transport". Biochimica et Biophysica Acta (BBA) - Bioenergetics. doi:10.1016/0005-2728(94)00195-B.
- ↑ Cramer, WA.; Soriano, GM.; Ponomarev, M.; Huang, D.; Zhang, H.; Martinez, SE.; Smith, JL. (1996). "Some new structural aspects and old controversies concerning the cytochrome b6f complex of oxygenic photosynthesis.". Annu Rev Plant Physiol Plant Mol Biol 47: 477–508. PMID 15012298. doi:10.1146/annurev.arplant.47.1.477. PMID 15012298
- ↑ 17,0 17,1 Cramer, WA.; Zhang, H.; Yan, J.; Kurisu, G.; Smith, JL. (2006). "Transmembrane traffic in the cytochrome b6f complex.". Annu Rev Biochem 75: 769–90. PMID 16756511. doi:10.1146/annurev.biochem.75.103004.142756. PMID 16756511
- ↑ 18,0 18,1 "cyclic electron transfer in plant leaf". PNAS. doi:10.1073/pnas.102306999.
- ↑ Cramer, WA.; Yan, J.; Zhang, H.; Kurisu, G.; Smith, JL. (2005). "Structure of the cytochrome b6f complex: new prosthetic groups, Q-space, and the 'hors d'oeuvres hypothesis' for assembly of the complex.". Photosynth Res 85 (1): 133–43. PMID 15977064. doi:10.1007/s11120-004-2149-5. PMID 15977064
Ligazóns externas
editarEstrutura PDB do complexo do citocromo b6f de:
- 1Q90Arquivado 19 de marzo de 2008 en Wayback Machine. - Chlamydomonas reinhardtii
- 1VF5Arquivado 01 de febreiro de 2008 en Wayback Machine. Mastigocladus laminosus
- 2D2CArquivado 11 de outubro de 2008 en Wayback Machine. - Mastigocladus laminosus
- 2E74Arquivado 28 de maio de 2020 en Wayback Machine. -Mastigocladus laminosus
- 2E75Arquivado 28 de maio de 2020 en Wayback Machine. -Mastigocladus laminosus
- 2E76Arquivado 28 de maio de 2020 en Wayback Machine. - Mastigocladus laminosus
- 2ZT9 - Nostoc sp. PCC 7120
- Structure-Function Studies of the Cytochrome b6f Complex Arquivado 28 de xullo de 2008 en Wayback Machine. - Investigqacións recentes sobre o citocromo b6f no laboratorio de William Cramer na Universidade Purdue, USA
- UMichOPM - families - superfamily - 3 [1]- Posicións calculadas do b6f e complexos relacionados en membranas.