Ciclohexano
O ciclohexano é un hidrocarburo saturado cicloalcano coa fórmula molecular (CH2)6. O ciclohexano é utilizado principalmente para a produción industrial de ácido adípico e caprolactama, que son os precursores do nailon. O ciclohexano é un líquido incoloro, inflamable cun cheiro distintivo a deterxente, que lembra aos produtos de limpeza (nos cales ás veces o ciclohexano é un compoñente).[1]
| Ciclohexano | |
|---|---|
|

|
| |
| Identificadores | |
| Número CAS | 110-82-7 |
| PubChem | 8078 |
| ChemSpider | 7787 |
| UNII | 48K5MKG32S |
| DrugBank | DB03561 |
| KEGG | C11249 |
| ChEBI | CHEBI:29005 |
| ChEMBL | CHEMBL15980 |
| Imaxes 3D Jmol | Image 1 |
| |
| |
| Propiedades | |
| Fórmula molecular | C6H12 |
| Masa molecular | 84,16 g/mol |
| Aspecto | líquido incoloro |
| Olor | doce, a gasolina |
| Densidade | 0,7781 g/mL, líquido |
| Punto de fusión | 647 °C; 1 197 °F; 920 K |
| Punto de ebulición | 8 074 °C; 14 565 °F; 8 347 K |
| Solubilidade en auga | Inmiscible |
| Solubilidade | soluble en éter, alcohol, acetona miscible con aceite de oliva |
| Índice de refracción (nD) | 1,42662 |
| Viscosidade | 1,02 cP a 17 °C |
| Termoquímica | |
| Entalpía estándar de formación ΔfH |
-156 kJ/mol |
| Entalpía estándar de combustión ΔcH |
-3920 kJ/mol |
| Perigosidade | |
| Clasificación da UE | Inflamable ('F) Nocivo (') Perigoso para o medio ambiente (N) Irritante grave para os ollos, que pode danar a córnea |
| Frases R | R11, R38, R65, R67, R50/53 |
| Frases S | S2, S9, S16, S25, S33, S60, S61, S62 |
| NFPA 704 | |
| Punto de inflamabilidade | −20 °C; −4 °F; 253 K |
| Temperatura de autoignición | 245 °C; 473 °F; 518 K |
| Compostos relacionados | |
| Cicloalcanos relacionados | Ciclopentano Cicloheptano |
| Compostos relacionados | Ciclohexeno Benceno |
Se non se indica outra cousa, os datos están tomados en condicións estándar de 25 °C e 100 kPa. | |
Produción e reaccións
editarA escala industrial, o ciclohexano prodúcese por hidroxenación do benceno.[2] Os produtores de ciclohexano consomen aproximadamente o 11,4% da demanda global de benceno.[3] A reacción é moi exotérmica, cunha ΔH(500 K)� = 216.37 kJ/mol). A deshidroxenación comeza apreciablemente a 300 °C, o que reflicte a entropía favorable desta deshidroxenación.[1]
Métodos históricos
editarA diferenza do benceno, o ciclohexano non é doado de obter de fontes naturais como o carbón. Por esta razón, os primeiros investigadores tiveron que sintetizar as súas mostras de ciclohexano.[4] En 1867 Marcellin Berthelot reduciu benceno con ácido hidroiódico a elevadas temperaturas.[5] Identificou incorrectamente o produto de reacción como n-hexano non só a causa da coincidencia de ambos no punto de ebulición (69 °C), mais tamén porque non cría que o benceno fose unha molécula cíclica (a diferenza do seu contemporáneo August Kekulé), senón algún tipo de asociación do acetileno. En 1870 un dos seus escépticos, Adolf von Baeyer repetiu a reacción[6] e produciu o mesmo produto de reacción, o hexahidrobenceno e en 1890 Vladimir Markovnikov creu que podía destilar o mesmo composto de petróleo do Cáucaso, chamando ao seu produto hexanafteno. En 1894 Baeyer sintetizou ciclohexano empezando cunha condensación de Dieckmann do ácido pimélico seguida de múltiples reducións:
No mesmo ano, E. Haworth e W.H. Perkin Jr. (1860–1929) preparárono por medio dunha reacción de Wurtz do 1,6-dibromohexano.
Surprendentemente, os seus ciclohexanos fervían a 10 °C máis que o hexahidrobenceno e o hexanafteno, pero este complicado enguedello solucionárono en 1895 Markovnikov, N.M. Kishner, e Nikolay Zelinsky cando reasignaron o "hexahidrobenceno" e o "hexanafteno" como metilciclopentano, resultado dunha inesperada reacción de rearranxo.
Reaccións
editarO ciclo hexano é bastante pouco reactivo, sendo un hidrocarburo hidrofóbico non polar. Reacciona con superácidos, como o HF + SbF5, que orixina cracking. Porén, os ciclohexanos substituídos, poden ser reactivos en varias condicións, moitas das cales son importantes en química orgánica.
Usos
editarComercialmente a maior parte do ciclohexano producido é convertido na mestura ciclohexanona-–ciclohexanol (ou "aceite KA") por oxidación catalítica. O aceite KA úsase despois como materia prima para producir ácido adípico e caprolactama.[7]
Usos no laboratorio
editarO ciclohexano utilízase ás veces como solvente orgánico non polar.
Tamén se utiliza para a calibración de instrumentos de calorimetría diferencial de varrido (DSC), a causa da súa adecuada transición cristal-cristal a −87,1 °C.[8]
Algunhas industrias de equipamento para o tratamento da calor utilizan o ciclohexano como un gas que transporta carbono en caldeias de carburización ao baleiro de alta pureza.
Conformación
editar- Artigo principal: Conformación do ciclohexano.
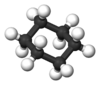
O anel de seis vértices do ciclohexano non presenta unha conformación coa forma dun hexágono perfecto. A conformación en forma de hexágono plano bidimensional ten unha considerable tensión angular porque os seus enlaces non son de 109,5º, e a tensión de torsión sería considerable porque todos os enlaces serían enlaces eclipsados. Por tanto, para reducir a tensión de torsión, o ciclohexano adopta unha estrutura tridimensional chamada conformación en cadeira. Hai tamén outros dous posibles confórmeros intermedios: a media cadeira, que é o confórmero máis inestable, e o bote torcido, que é máis estable que o confórmero bote. Isto propúxoo por primeira vez en 1890 Hermann Sachse, pero só foi aceptado moito máis tarde. A nova conformación ten os carbonos a un ángulo de 109,5°. A metade dos hidróxenos están nun plano do anel (posición ecuatorial), mentres que a outra metade están perpendiculares ao plano (axial). Esta conformación permite a estrutura máis estable do ciclohexano. Outra conformación do ciclohexano é a conformación en bote, pero interconvértese na formación en cadeira lixeiramente máis estable. Se o ciclohexano é monosubstituído con substituíntes grandes, entón o substituínte se encontrará probablemente unido en posición ecuatorial, xa que esta é a a conformación lixeiramente máis estable.
O ciclohexano ten o menor ángulo e tensión de torsión de todos os cicloalcanos, e como resultado o ciclohexano estímase que ten unha tensión anular total de 0, que é unha combinación de ángulo e forza de torsión. Isto tamén fai que o ciclohexano sexa o cicloalcano máis estable e produza a menor cantidade de calor (por unidade CH2) cando arde comparado con outros cicloalcanos.
Fases sólidas
editarO ciclohexano ten dúas fases cristalinas. A fase I de alta temperatura, estable entre os 186 K e o punto de fusión de 280 K, é un cristal plástico, o que significa que as moléculas manteñen algún grao de liberdade rotacional. A fase II de baixa temperatura (por debaixo dos 186 K) é ordenada. Hai outras fases (metaestables) de baixa temperatura, fases III e IV, que se obteñen pola aplicación de presións moderadas de máis de 30 MPa. A fase IV aparece exclusivamente en ciclohexano deuterado, é dicir, con deuterio. (Nótese que a aplicación de presión incrementa os valores de todas as temperaturas de transición).[9]
| Nº | Simetría | Grupo espacial | a (Å) | b (Å) | c (Å) | Z | T (K) | P (MPa) |
|---|---|---|---|---|---|---|---|---|
| I | Cúbica | Fm3m | 8,61 | 4 | 195 | 0,1 | ||
| II | Monoclínica | C2/c | 11,23 | 6,44 | 8,20 | 4 | 115 | 0,1 |
| III | Ortorrómbica | Pmnn | 6,54 | 7,95 | 5,29 | 2 | 235 | 30 |
| IV | Monoclínica | P12(1)/n1 | 6,50 | 7,64 | 5,51 | 4 | 160 | 37 |
Aquí, Z é o número de unidades de estrutura por cela unidade; as constantes da cela unidade a, b e c foron medidas a unha temperatura (T) e presión (P) dadas.
Notas
editar- ↑ 1,0 1,1 M. Larry Campbell. "Cyclohexane" in Ullmann's Encyclopedia of Industrial Chemistry, Wiley-VCH, Weinheim, 2012. doi 10.1002/14356007.a08_209.pub2
- ↑ Fred Fan Zhang, Thomas van Rijnman, Ji Soo Kim, Allen Cheng "On Present Methods of Hydrogenation of Aromatic Compounds, 1945 to Present Day" Lunds Tekniska Högskola 2008
- ↑ "Market Study Benzene, Ceresana, July 2011". Arquivado dende o orixinal o 21 de decembro de 2017. Consultado o 25 de xullo de 2014.
- ↑ Warnhoff, E. W. (1996). "The Curiously Intertwined Histories of Benzene and Cyclohexane". J. Chem. Ed. 73 (6): 494. doi:10.1021/ed073p494.
- ↑ Ver:
- Bertholet (1867) "Nouvelles applications des méthodes de réduction en chimie organique" (Novas aplicacións de métodos de redución en química orgánica), Bulletin de la Société chimique de Paris, series 2, 7 : 53-65.
- Bertholet (1868) "Méthode universelle pour réduire et saturer d'hydrog'ene les composés organiques" (Método universal para reducir e saturar con hidróxeno compostos orgánicos), Bulletin de la Société chimique de Paris, series 2, 9 : 8-31. da páxina 17: "En effet, la benzine, chauffée à 280° pendant 24 heures avec 80 fois son poids d'une solution aqueuse saturée à froid d'acide iodhydrique, se change à peu près entièrement en hydrure d'hexylène, C12H14, en fixant 4 fois son volume d'hydrog'ene: C12H6 + 4H2 = C12H14 … Le neuveau carbure formé par la bezine est un corps unique et défini: il bout à 69°, et offre toutes les propriétés et la composition de l'hydrure d'hexylène extrait des pétroles." (En efecto, o benceno, quentado a 280° durante 24 horas con 80 veces o seu peso dunha solución acuosa de ácido hidroiódico saturado frío, cambia case enteiramente a hidruro de hexileno, C12H14, [Nota: esta fórmula para o hexano (C6H14) é incorrecta porque os químicos daquela época usaban unha masa atómica incorrecta do carbono.] fixando [é dicir, combinando con] 4 veces o seu volume de hidróxeno: C12H6 + 4H2 = C12H14 … O novo composto de carbono formado polo benceno é unha única e ben definida substancia: ferve a 69° e presenta todas as propiedades e a composición do hidruro de hexileno extraído do petróleo.)
- ↑ Adolf Baeyer (1870) "Ueber die Reduction aromatischer Kohlenwasserstoffe durch Jodphosphonium" (Sobre a redución de hidrocarburos aromáticos polo ioduro de fosfonio [H4IP]), Annalen der Chemie und Pharmacie, 155 : 266-281. Da páxina 279: "Bei der Reduction mit Natriumamalgam oder Jodphosphonium addiren sich im höchsten Falle sechs Atome Wasserstoff, und es entstehen Abkömmlinge, die sich von einem Kohlenwasserstoff C6H12 ableiten. Dieser Kohlenwasserstoff ist aller Wahrscheinlichkeit nach ein geschlossener Ring, da seine Derivate, das Hexahydromesitylen und Hexahydromellithsäure, mit Leichtigkeit wieder in Benzolabkömmlinge übergeführt werden können." (Durante a redución [do benceno] con amálgama de sodio ou ioduro de fosfonio, engádense seis átomos de hidróxeno no caso extremo, e orixínanse derivados, os cales derivan dun hidrocarburo C6H12. Este hidrocarburo é con toda probabilidade un anel pechado, xa que os seus derivados — hexahidromesitileno [1,3,5 - trimetil ciclohexano] e ácido hexahidromelítico [ácido ciclohexano-1,2,3,4,5,6-hexacarboxílico] — poden ser convertidos con facilidade outra vez en derivados do benceno.)
- ↑ Michael Tuttle Musser "Cyclohexanol and Cyclohexanone" in Ullmann's Encyclopedia of Industrial Chemistry, Wiley-VCH, Weinheim, 2005.
- ↑ Price, D. M. (1995). "Temperature Calibration of Differential Scanning Calorimeters". Journal of Thermal Analysis 45 (6): 1285–1296. doi:10.1007/BF02547423.
- ↑ 9,0 9,1 Mayer, J.; Urban, S.; Habrylo, S.; Holderna, K.; Natkaniec, I.; Würflinger, A.; Zajac, W. (1991). "Neutron Scattering Studies of C6H12 and C6D12 Cyclohexane under High Pressure". Physica status solidi (b) 166 (2): 381. doi:10.1002/pssb.2221660207.
Véxase tamén
editarOutros artigos
editarLigazóns externas
editar| Commons ten máis contidos multimedia sobre: Ciclohexano |
- International Chemical Safety Card 0242
- National Pollutant Inventory – Cyclohexane fact sheet
- NIOSH Pocket Guide to Chemical Hazards
- Cyclohexane@3Dchem
- Hermann Sachse e a primeira proposta da conformación en cadeira.
- NLM Hazardous Substances Databank – Cyclohexane
- Metanol descuberto no espazo
- Cálculo da presión de vapor, densidade líquida, viscosidade líquida dinámica, e tensión superficial do ciclohexano
- Produción de ciclohexano por unha técnica de hidroxenación de benceno
