Bicarbonato de sodio
O bicarbonato de sodio (tamén chamado bicarbonato sódico, hidroxenocarbonato de sodio ou carbonato ácido de sodio) é un composto sólido cristalino de cor branca moi solúbel en auga, cun lixeiro sabor alcalino parecido ao do carbonato de sodio, de fórmula NaHCO3.
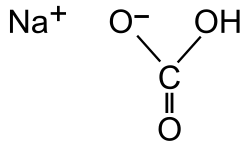

Pódese encontrar como mineral na natureza ou producirse artificialmente.[1]
Cando se expón a un ácido moderadamente forte descomponse en dióxido de carbono e auga. A reacción é a seguinte:
- NaHCO3 + HCl → NaCl + H2O + CO2 (gas)
- NaHCO3 + CH3COOH → CH3COONa + H2O + CO2 (gas)
Debido á capacidade do bicarbonato de sodio de liberar dióxido de carbono úsase, canda outros compostos acídicos, como aditivo levadante en panadaría e na produción de gasosas. Algúns lévedos para a fabricación do pan conteñen bicarbonato de sodio. Antigamente usábase como fonte de dióxido de carbono para a bebida gasosa Coca Cola.
É o compoñente fundamental dos pos extintores de incendios.
Propiedades
editar| Propiedades físicas do bicarbonato sódico | |
|---|---|
| Estado de agregación | Sólido |
| Aparencia | Branca cristalina |
| Densidade | 2173 kg/m3; 2,173 g/cm3 |
| Masa molar | 84,0 g/mol |
| Punto de fusión | 323,15 K (50 °C) |
| Punto de descomposición | 543,15 K (270 °C) |
| Índice de refracción | 1,3344 |
| Solubilidade en auga | 10,3 g/100 g H2O |
Obtención
editarMediante o proceso de Solvay. Aínda que utilizado para obter Na2CO3, é posíbel obter nunha das reaccións intermedias bicarbonato sódico. O proceso consiste na seguinte reacción:
Na+ + Cl- + NH3 + H2O + CO2 → NaHCO3(s) + NH4+ + Cl-
Na cal precipita o bicarbonato de sodio.
Usos
editarUso en cociña
editarO bicarbonato de sodio úsase principalmente en repostaría, onde reacciona con outros compoñentes para liberar CO2, que axuda ás masas a elevarse, dándolles sabor e volume. Os compostos ácidos que inducen esta reacción inclúen bitartrato de potasio (tamén coñecido como cremor tártaro), zume de limón, iogur ou ácido acético, entre outros.
Uso cultural e cosmético
editarO bicarbonato de sodio utilízase como axente alcalinizante que actúa en combinación coa saliva no coqueo, de maneira que se suaviza e se produce a extracción dos metabólitos da folla de coca facéndose desta maneira o coqueo un proceso pracenteiro e duradeiro, en contraposición a se non se usara o bicarbonato de sodio. O bicarbonato é á coca o que o azucre ao café, de maneira que no altiplano andino (serras do Perú, Bolivia e N da Arxentina), onde se practica o coqueo, o consumo de bicarbonato é alto.
Na China úsase para lavar os pés.
En todo o mundo utilízase para combater a acidez gástrica cando no se dispón de medicamentos específicos.
Serve tamén para a limpeza polo seu poder abrasivo (por exemplo, para limpar obxectos de prata) e desodorizante (por exemplo, para quitar o cheiro "a novo" das neveiras).
Úsase ademais como branqueador dental, xa que pole a superficie do esmalte, e como axente desodorizante para eliminar olores de suoración forte en axilas e pés.
Riscos do uso
editarNotas
editarVéxase tamén
editar| Wikimedia Commons ten máis contidos multimedia na categoría: Bicarbonato de sodio |