Tautómero
Os tautómeros (do grego tauto, igual, e meros, parte) son isómeros estruturais de compostos orgánicos que poden interconverterse facilmente por medio dun reacción química chamada tautomerización,[1][2][3] que consiste xeralmente na migración formal dun átomo de hidróxeno ou un protón, acompañada do cambio entre un enlace sinxelo e un enlace dobre adxacente. Entre as dúas formas tautómeras existe un equilibrio químico. Este tipo de isomería denomínase tautomería, que é un tipo especial de isomería estrutural. A tautomería pode desempeñar un importante papel no emparellamento de bases non canónico no ADN e, especialmente, no ARN.

Química
editarEn solucións nas que é posible a tautomerización, pode chegarse a un equilibrio químico entre os tautómeros. A proporción exacta na que aparece cada tautómero depende de varios factores, como a temperatura, solvente, e pH.[4]
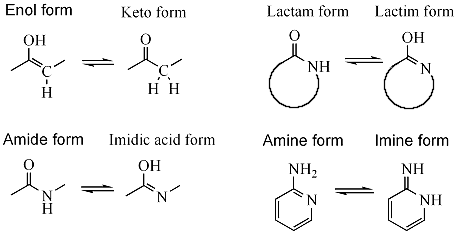
Os pares de tautómeros máis comúns son:
- Cetona - enol (tautomería ceto-enol, H-C-C=O C=C-O-H); por exemplo, na acetona.
- Cetena - inol; por exemplo, na etenona.
- Amida - ácido imídico (H-N-C=O N=C-O-H); por exemplo, durante as reaccións de hidrólise de nitrilos.
- Lactama - lactima; unha tautomería amida - ácido imídico en aneis heterocíclicos, por exemplo nas bases nitroxenadas guanina, timina, e citosina.
- Enamina - imina (C=C-N-H H-C-C=N).
- Enamina - enamina; por exemplo, durante as reaccións encimáticas catalizadas polo fosfato de piridoxal.
- Anómeros de azucres redutores en solución, que se interconverten a través dunha forma intermedia de cadea aberta.
Formas principais de tautomería
editarPrototropía
editarA prototropía é o mecanismo máis común polo que se produce a tautomería e consiste na recolocación dun protón (H+).[5] O tautomerismo prototrópico pode considerarse como un tipo de comportamento ácido-base. Os tautómeros prototrópicos son estados de protonación isómeros coa mesma fórmula empírica e carga total.
As tautomerizacións son catalizadas por:
- Bases (1. desprotonación; 2. formación dun anión deslocalizado, como, por exemplo, un enolato; 3. protonación nunha posición diferente do anión).
- Ácidos (1. protonación; 2. formación dun catión deslocalizado; 3. desprotonación nunha posición diferente adxacente ao catión).
- Tautomería anular
- É un tipo de tautomería prototrópica na que un protón pode ocupar dúas ou máis posicións dun sistema heterocíclico, por exemplo, 1H- e 3H-imidazol; 1H-, 2H- e 4H- 1,2,4-triazol; 1H- e 2H- isoindol.[4]
- Tautomería de anel-cadea
- Ocorre cando o movemento do protón está acompañado do paso dunha estrutura aberta a un anel, como o caso das formas de cadea aberta e pirano da glicosa ou furano da frutosa.
Tautomería de valencia
editarA tautomería de valencia é un tipo de tautomería na que se forman e rompen rapidamente enlaces sinxelos e/ou dobres, sen que exista migración de átomos ou grupos.[6] Diferénciase do tautomerismo prototrópico, e implica procesos nos que hai unha rápida reorganización dos electróns de enlace. Un exemplo deste tipo de tautomerismo pode encontrarse no hidrocarburo bullvaleno. Outro exemplo son as formas abertas e pechadas de certos heterociclos, como azida - tetrazol ou münchnona mesoiónica-acilamino cetena. O tautomerismo de valencia require un cambio na xeometría molecular e non debería confundirse coas estruturas resonantes típicas ou mesómeros.
Tautomería ceto-enólica
editarA tautomería máis coñecida é a tautomería ceto-enólica. Un enol (composto que ten un grupo hidroxilo unido a un carbono cun dobre enlace carbono-carbono) resulta da migración formal dun hidróxeno que estaba unido a un carbono en posición alfa ao osíxeno dun grupo carbonilo (C=O).
Trátase xeralmente dun equilibrio con predominio da forma ceto aínda que a cantidade de cada forma depende da estabilidade relativa de ambos os tautómeros;[7] afectada pola capacidade de formación de pontes de hidróxeno por parte do disolvente, unha posible conxugación dos dobres enlaces ou a formación dunha ponte de hidróxeno intramolecular como no caso da acetilacetona que despraza o equilibrio cara á forma enólica.
A tautomerización pode ser catalizada tanto por ácidos coma por bases.[8]
Na catálise por bases, a base extrae un hidróxeno alfa da forma cetónica formando un anión enolato; a deslocalización da carga e posterior protonación do anión leva á forma enólica, como mostra a seguinte imaxe
Na catálise por ácidos, protónase o osíxeno do grupo carbonilo. A desprotonación dun carbono alfa dá a forma enólica.
Á súa vez, esta tautomería permítenos substituír os hidróxenos por deuterio ao facermos reaccionar unha cetona cun ácido ou unha base en presenza de deuterio D2O utilizado como disolvente, proceso que pode ser seguido por espectroscopia de resonancia magnética nuclear e que nos dá a vantaxe de sabermos cantos hidróxenos alfa posúe a molécula en cuestión.
Outra característica interesante desta tautomería é que a mesma pode inducir a estereoisomerización, como nos mostra esta cis-ciclopentanona 2,3-disubstiuída que se transforma no seu isómero trans que está menos impedido e por tanto é enerxeticamente máis favorable.
Porcentaxe da forma enol no equilibrio
editarAs porcentaxes da forma enólica no equilibrio para algúns compostos son:
- Propanona (ou acetona) : 0,00025 %
- 2,3-Butanodiona (ou diacetil ou diacetilo): 0,0056 %
- Ciclohexanona: 0,02 %
- Acetilacetona: 84,2%
Notas
editar- ↑ Smith MB, March J (2001). Wiley Interscience, ed. Advanced Organic Chemistry (5th ed. ed.). New York. pp. 1218–1223. ISBN 0-4715-8589-0.
- ↑ Katritzky AR, Elguero J; et al. (1976). The Tautomerism of heterocycles. New York: Academic Press. ISBN 0-1202-0651-X.
- ↑ IUPAC Gold Book Tautomerization
- ↑ 4,0 4,1 Roman M. Balabin (2009). "Tautomeric equilibrium and hydrogen shifts in tetrazole and triazoles: Focal-point analysis and ab initio limit". J. Chem. Phys. 131 (15): 154307. doi:10.1063/1.3249968.
- ↑ IUPAC Gold Book tautomerism
- ↑ IUPAC Gold Book valence tautomerization
- ↑ Vollhardt, K.P. Schore, N. Química Orgánica. 3ra edición. Barcelona. Omega. 2000. pp 784 e ss. ISBN 84-282-1172-8.
- ↑ McMurry, John. Química Orgánica. 6a edición. México DF. Thomson. 2004. pp 820 e ss. ISBN 970-686-354-0